纳米二氧化铈的潜在生态风险及毒性作用机制研究进展
许伊,杨士红,尤国祥,侯俊,*
1. 河海大学农业科学与工程学院,南京 210098
2. 河海大学环境学院,浅水湖泊综合治理与资源开发教育部重点实验室,南京 210098
纳米(nm)是物理学上的度量单位,当物质尺寸达到纳米尺度(1~100 nm)时,其物理化学性质会发生很大的变化,在材料强度、韧度、磁化率和催化能力等方面表现出特殊性能[1-2]。作为现代科技与交叉学科的发展基础,纳米技术在新材料研发、生态修复、生命健康和国家安全等诸多领域具有广阔的应用和发展前景[3-6]。铈(Ce)是元素周期表中第Ⅲ副族镧系元素,是一种稀土元素。稀土元素因其独特的金属特性被大量用于纳米材料的生产,而二氧化铈(CeO2)作为稀土氧化物中的重要组成部分,具有独特的理化性质和广泛的应用前景。2012年欧盟工作报告指出纳米CeO2的全球产量约为10 000 t (http://ec.europa.eu/nanotechnology/index_en.html, 2012)[7]。来自美国地质调查局的数据显示,全球市场中有超过80%的纳米CeO2来源于中国。
纳米CeO2及含有纳米CeO2的消费品的大规模生产和使用,必然会导致越来越多的纳米CeO2在其生命周期循环过程中向水、土和空气等环境介质释放。近年来,已有学者结合2014年市场统计数据,通过全生命周期评价模型,评估了自然介质中纳米CeO2的浓度,得出大气中的纳米CeO2浓度为0.01~0.6 ng·m-3,地表水中的纳米CeO2浓度为0.6~100 pg·L-1,沉积物中的纳米CeO2浓度为0.2~45 μg·kg-1,土壤中的纳米CeO2浓度为24~1 500 ng·kg-1[6]。在纳米CeO2的环境浓度迅速增加的同时,其生物安全与生态效应问题日益突出[8-11]。近年来,纳米CeO2的潜在环境风险及生态效应问题引起社会各界学者越来越多的关注。作为全球纳米CeO2最大的生产国和销售国,我国更加有必要加强对纳米CeO2生态安全性评价的研究。基于此,本文主要综述了不同生态环境内,纳米CeO2的生物毒性效应以及潜在的毒性作用机制,以期为纳米CeO2的安全评价提供科学依据。
1 纳米CeO2的潜在生态风险(Potential ecological risks of CeO2 nanoparticles)
随着大量含有纳米CeO2产品的生产、加工、运输和使用,势必会有越来越多的纳米CeO2通过各种途径进入大气、土壤及水环境中,进而可能会对人体和生态环境中的生物体产生潜在危害。此外,不同环境介质中的纳米材料在外部环境因子、生物及非生物的作用下,会发生溶解-释放、团聚-沉降、吸附-解吸及生物累积-放大等一系列行为变化,最终对生态系统产生毒性胁迫效应。纳米CeO2在其生命周期内可能的释放途径、环境行为及生态效应如图1所示。近年来,关于纳米CeO2的生物毒性及潜在环境风险受到广泛关注,国内外已经开展大量有关纳米CeO2对微生物细胞、典型水生生物、植物及模式微生物的生长和代谢的影响研究,发现不同生态环境下纳米CeO2的毒性效应不尽相同。
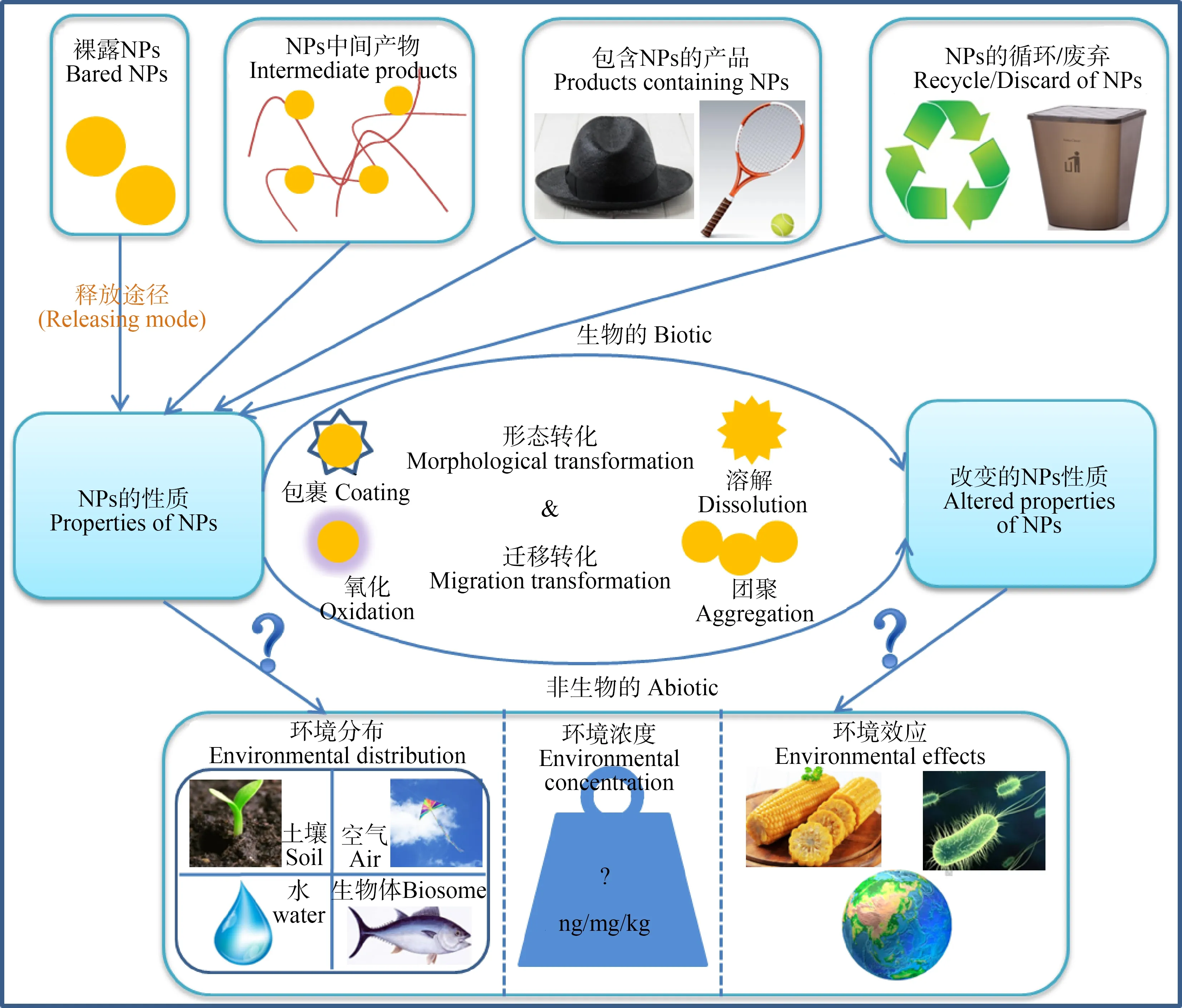
图1 纳米颗粒(NPs)在其生命周期内的环境行为及释放途径
1.1 纳米CeO2对细胞的毒性作用(Toxicity effects of CeO2 nanoparticles on cells)
细胞是组成生物体结构和功能的基本单位,关于纳米CeO2的细胞毒性研究已成为一大热点,但在分子水平上探究其毒性作用机制的研究还比较缺乏。纳米CeO2对不同的细胞系产生的毒性作用机制有所不同,了解并控制纳米CeO2致毒的机理可以为降低其毒性并制定安全性评价提供可靠的依据。Lin等[12]将A549细胞系暴露于纳米CeO2悬液中发现,细胞的存活率随暴露时间及暴露剂量的增加而下降:主要原因是细胞内活性氧(ROS)水平、脂质过氧化反应和细胞膜损伤程度增加,同时抗氧化水平下降,表明纳米CeO2在细胞内部引起氧化损伤[13]。
此外,纳米CeO2还可以导致炎性因子的分泌及DNA损伤,进而引起细胞形态受损和细胞的凋亡。Gojova等[14]用不同浓度的纳米CeO2悬液培养HAECs细胞,结果显示暴露细胞内部炎症标记物浓度与纳米CeO2浓度呈显著正相关性,该结果与纳米CeO2引起细胞DNA及染色体的损伤有关[15-16]。另有学者利用电流式细胞术结合电镜观察证实,纳米CeO2还可以通过损害细胞形态降低细胞活性,最终诱导细胞凋亡[17-18]。值得关注的是,纳米CeO2对不同细胞的毒性作用表现出一定的选择性。例如,Park等[18]的研究表明,相同处理条件下纳米CeO2使BEAS-2B细胞活力下降,但对T98G和H9C2细胞的活力没有影响。进一步研究表明, 纳米CeO2对放射介导下的不同细胞的凋亡和损伤呈现出不同的作用,即对正常的细胞具有保护作用而对相应的癌细胞具有灭活作用[19],这为纳米CeO2在医学领域的应用提供了思路[20]。
1.2 纳米CeO2对组织器官的毒性作用(Toxicity effects of CeO2 nanoparticles on tissues and organs)
纳米CeO2可以通过多种环境介质的传播和食物链传递等方式进入生物体内,因而纳米CeO2的广泛使用极大程度地增加了生态环境中的生产者、消费者等与纳米CeO2的接触机会。目前,纳米CeO2对生物体最直接的暴露途径是经呼吸道吸入。抛光粉、汽车尾气净化剂及柴油燃料添加剂中的纳米CeO2可以通过呼吸道直接进入机体内部。已有报道指出,当空气中纳米CeO2颗粒含量或毒性超过肺部防御能力时会引起肺损伤、纤维化等多种炎症反应。例如,Srinivas等[21]通过连续4 h给雌性和雄性大鼠吸入气溶胶浓度为641 mg·m-3的纳米CeO2并在24 h、48 h和14 d后检测大鼠肺部活性发现,急性暴露途径吸入的纳米CeO2颗粒会通过氧化应激效应诱导细胞毒性,最终导致慢性毒性的发生,但是该过程与暴露时间之间没有显著的相关性。向雄性大鼠滴注纳米CeO2的方式同样发现纳米CeO2可以引起肺部炎症和肺损伤,进一步导致肺纤维化[22],向雄性大鼠气管滴注纳米CeO2的方式可产生氧化应激诱导中性粒细胞及淋巴细胞等产生氧化损伤[23]。
纳米CeO2进入机体后,会随血液循环到达机体的其他组织器官,包括肝、肾、心和脑等部位并引发相应的毒性效应。对小鼠进行纳米CeO2灌胃实验证实,经口染毒的纳米CeO2也会引起肝肾功能的损伤[24]。对小鼠的一次性灌胃染毒实验进一步可以证实进入机体内部的纳米CeO2对脑、心脏和脾脏器官产生了一定的毒性作用[25]。根据已有研究可以得出,纳米CeO2对生物体的影响是全方位的。因为纳米CeO2的粒径较小,其不仅可以绕过血脑屏障到达嗅球,还可以随血液循环到达其他组织器官并产生毒性效应。但是,目前关于纳米CeO2作用的具体靶器官及损伤机制还不明确,有待进一步研究证实。
1.3 纳米CeO2对植物的影响(Toxicity effects of CeO2 nanoparticles on plants)
作为环境中的重要组成部分,植物在维持生态系统平衡、为动物和人类提供能量过程中发挥着不可替代的作用。然而,随着空气、水体和土壤中纳米颗粒的不断累积,植物会不可避免地通过根系或叶片暴露于纳米CeO2富集的环境中。一旦植物表面接触了纳米CeO2,其会在植物体内通过吸收、转运等方式储存在不同的部位,进而极有可能进入食物链并在高等生物体内累积、放大[26-27]。
Zhang等[28]研究黄瓜对纳米CeO2的吸收和运输时发现,黄瓜根部可以快速吸收纳米CeO2并向上迁移、转运到其他组织中,且纳米颗粒的尺寸越小越容易被吸收,累积量也越多[29]。进一步利用扫描透射电子显微镜及X射线精细近边结构谱技术发现,累积在黄瓜根部的纳米CeO2大部分被生物转化并主要以磷酸铈的形式存在,而在茎尖组织部位的纳米CeO2则大部分以羧酸铈的形式存在[28]。在纳米CeO2表面生成的磷酸铈沉淀会降低纳米CeO2的生物可利用性,进而降低其毒性[30]。另外,植物体内或根部在应对纳米暴露过程中分泌的物质可能会改变纳米颗粒的团聚状态和介质的pH值,导致纳米CeO2发生还原溶解的现象,这一结果是引起纳米CeO2不同的生物累积状况及生物毒性效应的原因[31]。
除在植物体内的吸收、运移和转化外,纳米CeO2对高等植物的毒性作用也得到了大量的证实。Priester等[32]研究了纳米CeO2对大豆的影响,发现纳米CeO2不仅会抑制大豆的生长、降低大豆的产量,高浓度情况下还会抑制大豆根瘤的固氮效果。利用随机扩增多态DNA技术可以直接证实纳米CeO2对大豆的基因毒性[33]。Hernandez-Viezcas等[34]和Bandyopadhyay等[35]同样观察到纳米CeO2暴露条件下,大豆及苜蓿根部共生的固氮菌活性会受到明显抑制,导致植物生长过程中氮循环过程受阻。Ma等[36]研究纳米CeO2对拟南芥生物量的影响时指出,500~2 000 mg·L-1暴露浓度下,拟南芥的生长与对照组相比减少了85%。而浓度为1 000 mg·L-1和2 000 mg·L-1时拟南芥叶片叶绿素含量分别降低了60%和85%。分析潜在机制主要是暴露过纳米CeO2的植物内脂质过氧化水平、电解质释放及功能酶活性都发生了变化,表明纳米CeO2对植物细胞造成氧化胁迫效应[37-38]。
1.4 纳米CeO2对水生生物的毒性效应(Toxicity effects of CeO2 nanoparticles on aquatic organisms)
目前为止,还没有确切的实验现象来证实纳米CeO2可以进入到生物细胞内部,但大量试验结果佐证了纳米CeO2的确可以进入到胞外聚合物(EPS)或吸附在微生物细胞膜上[39]。近年来关于纳米CeO2对水生生物的毒性效应的报道层出不穷,且毒性效应与纳米尺寸及生物体的种类息息相关。已有研究中关于纳米CeO2对水生生物毒性效应的详细内容如表1所示。

表1 纳米CeO2对水生生物的毒性研究
在纳米CeO2对水生生物的影响研究中,水生生物种类、暴露方式及积累的Ce含量的不同均会导致相应的半致死浓度(LC50)不同。例如,在暴露于亚致死浓度的纳米CeO2的过程中,吸附在小球藻(Chlorellapseudomonas)上的纳米CeO2的量是大型溞上面Ce元素总量的3倍。大型溞(Daphniapulex)主要是通过食物链的摄食过程吸收纳米CeO2,而小球藻自身较大的比表面积使其能够吸附更多的纳米CeO2[49]。van Hoecke等[43]将大型溞暴露于14、20和29 nm的纳米CeO2悬液21 d,发现对于2种较小尺寸的纳米CeO2LC50约为40 mg·L-1,而29 nm的LC50为71 mg·L-1。相比较于大型溞,同形溞(D.similis)对纳米CeO2的毒性抵抗能力更强,其LC50值大约是大型溞的350倍[50]。纳米CeO2对大肠杆菌(E.coli)和枯草芽孢杆菌(B.subtilis)的毒性明显高于奥奈达希瓦氏菌(S.oneidensis)[51]。当以隐杆线虫(C.elegans)作为模式生物时,0.172 μg·L-1的纳米CeO2即可以引起其体内ROS累积、氧化损伤及生命周期的缩短[52]。然而,在斑马鱼(Daniorerio)的暴露实验中,500 μg·L-1的纳米CeO2在斑马鱼的肝脏部位有明显的积累,5 000 μg·L-1浓度暴露下斑马鱼对纳米CeO2却没有明显的吸收,且纳米CeO2在72 h的暴露过程中只有超过200 mg·L-1时才对斑马鱼产生明显的毒性作用[43]。在贝类(Mytilusgalloprovincialis)对纳米CeO2的吸收实验中,不同的暴露方法(即直接暴露或通过摄食浮游植物暴露)对贝类吸收纳米CeO2量的影响只表现在前2周,因为随着贝类体内累积的纳米CeO2含量的增加,其自身清除速率也会相应增加以抵抗组织中不断增加的纳米CeO2含量[53]。
目前已有报道中,由于不同暴露实验中所用纳米CeO2的理化性质不同,导致相同水生生物对纳米CeO2暴露的毒性响应有所不同,因而难以对纳米CeO2在水环境中的生态效应得出一致的结论。此外,毒理实验中得到的纳米CeO2对水生生物的毒性效应浓度往往低于模型预测的浓度,可能原因是实际水环境介质中的天然有机物(NOM)、离子强度或pH对纳米CeO2的团聚分散行为与化学反应活性产生了影响,进而间接影响了其毒性效应。因此,建立不同水环境条件下纳米CeO2的赋存分布特征及反应活性与其毒性效应间的关系对全面认识并评估纳米CeO2的生态风险具有重要意义。
1.5 纳米CeO2对土壤生物的影响(Toxicity effects of CeO2 nanoparticles on soil organism)
由于纳米CeO2较小的尺寸,其可以透过土壤的宏观或微观孔隙,进而对土壤生物产生不利的影响。已有研究多关注纳米CeO2对土壤中无脊椎动物的生理活性的影响,而关于纳米CeO2对土壤微生物群落结构的影响的内容还比较少。因为纳米CeO2可以通过多种直接或间接的致毒途径影响微生物群落的组成结构,因而难以解析纳米CeO2实际的毒性效应及作用机制。直接作用主要源于纳米CeO2可以通过吸附作用改变有毒物质或营养盐的生物可利用性,而间接作用主要是由于纳米CeO2与NOM或毒性有机物的相互作用可以扩大或缓解其毒性效应[54]。Vittori Antisari等[55]选取2种土壤,用100 mg Ce·kg-1(土壤干质量)的纳米CeO2暴露60 d后发现2种土壤内微生物的生物量均未发生明显变化。但是,纳米CeO2降低了微生物的C与N比值且增加了微生物的代谢商数(qCO2),主要原因是微生物栖息的土壤环境组成成分发生变化,细胞内部受到胁迫效应。
关于土壤无脊椎动物的研究,目前主要集中在秀丽隐杆线虫(Caenorhabditiselegans)和蚯蚓(Eiseniafetidia)2种。对比Ce盐及3种不同粒径的纳米CeO2对蚯蚓的毒性作用发现[58],所有的暴露实验中,蚯蚓体内累积的Ce含量都随暴露浓度的增加而增加,且暴露于纳米CeO2颗粒的蚯蚓相比较暴露于离子态Ce的蚯蚓累积量更多。组织学观察结果显示,暴露于纳米CeO2的蚯蚓的体壁角质层损失明显,肠上皮细胞完整性遭到破坏。因而,尽管蚯蚓的生存及繁殖在相对较短的暴露实验中没有受到明显的影响,但是组织学的变化可以在一定程度上推断蚯蚓在长期暴露过程中受到的毒性抑制作用[59]。Collin等[57]进一步说明了纳米CeO2表面的电极电势对其毒性效应具有显著影响。带正电的纳米CeO2相较于中性及带负电的纳米CeO2表现出更高的生物累积及生物毒性效应,其在24 h暴露实验中对生长阶段的隐杆线虫LC50为15.5 mg·L-1。作为典型的土壤模式生物,纳米CeO2对秀丽隐杆线虫的毒性胁迫效应受到专家学者的广泛关注,纳米CeO2不同的理化性质导致其对秀丽隐杆线虫产生的毒性有所不同,具体内容如表2所示。
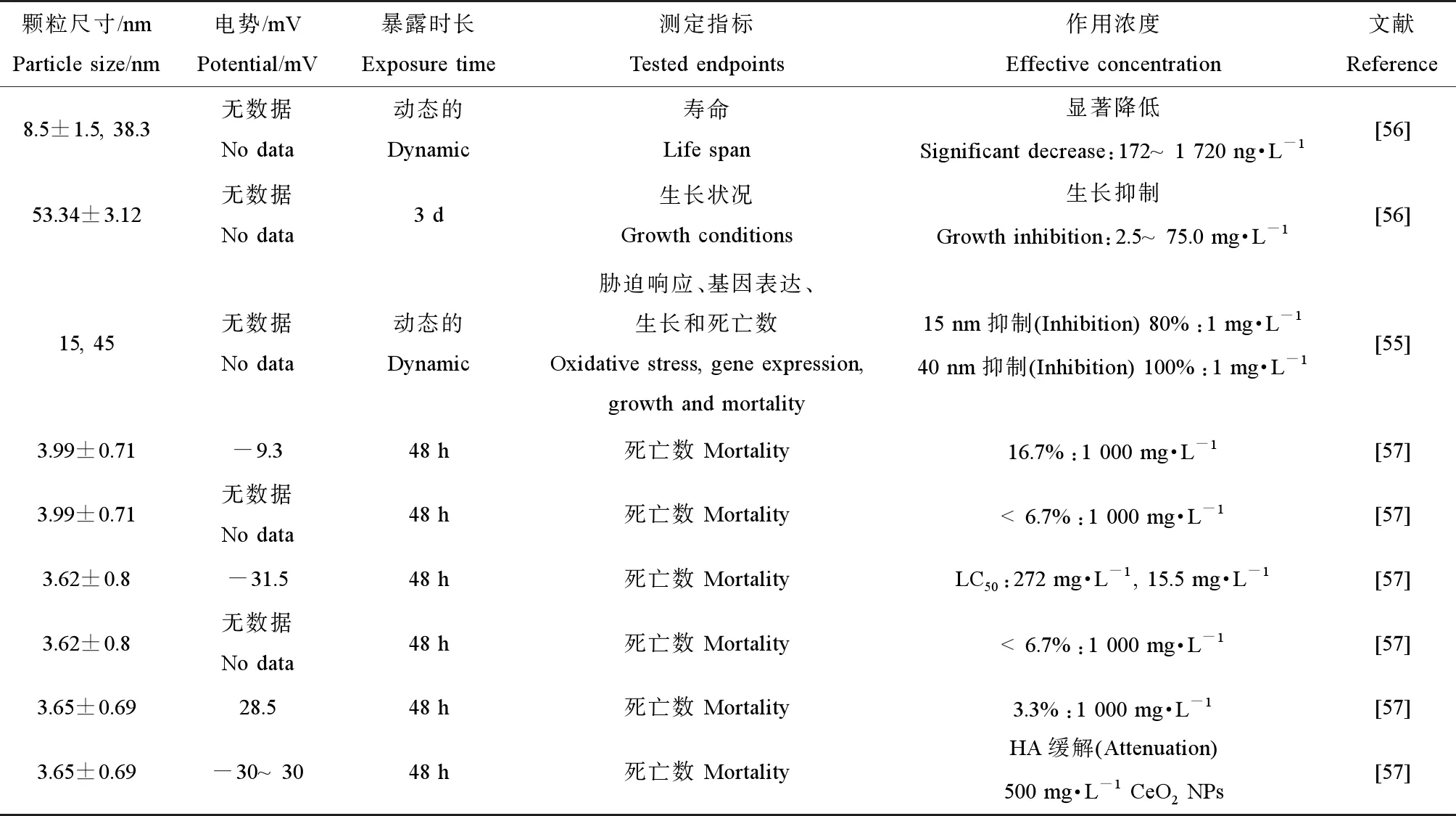
表2 纳米CeO2对土壤中秀丽隐杆线虫的毒性研究
综上所述,纳米CeO2对土壤生物的毒性效应会受到土壤中NOM含量、纳米CeO2自身电极电势及粒径的影响。因此,为缓解土壤中纳米CeO2的生态风险,可以对纳米CeO2进行改性、修饰,如通过吸附NOM以改变纳米CeO2颗粒的表面电势或增加纳米CeO2的粒径,以降低其被蚯蚓或线虫等吞食的风险。
2 纳米CeO2的生物致毒机制(Toxicity mechanisms of CeO2 nanoparticles on organisms)
已有研究中,众多学者对纳米CeO2的生物毒性作用机制进行了一系列的探索,但是目前还没有得出一致的、明确的结论,因为纳米CeO2较小的尺寸导致其可以在亚细胞结构(包括细胞膜、蛋白质和DNA分子等)上与生物系统发生相互作用进而产生毒性效应。根据已有研究,纳米CeO2对生物的毒性作用机理大致可以分为以下2个部分:直接或物理性抑制(包括与细胞本身或细胞膜直接接触并产生相互作用)和间接或化学抑制(即纳米CeO2与生物体的内在、外在环境作用进而产生一系列化学因素或化学反应而导致的毒性效应)。本文进一步将上述两方面总结绘制如图2所示的概要图。在复杂的生物体-纳米CeO2系统中,这2个方面的作用甚至会同时发生。
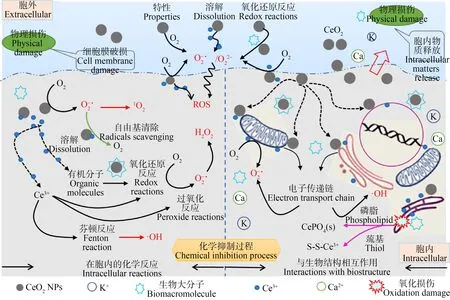
图2 纳米CeO2通过物理损伤或化学抑制产生的生物毒性作用机制
2.1 物理损伤(Physical damage)
纳米CeO2会通过直接吸附在生物细胞外膜上对生物体产生较强的毒性效应,其主要机理包括以下2个方面。(1)吸附在细胞表面的纳米CeO2会干扰生物体生存环境中的营养物质向细胞内部的迁移扩散,进而会引起生物体生存环境pH或氧化还原电势(EH)的改变并导致细胞营养缺乏[41,44];(2)一旦与细胞接触,纳米CeO2的不规则形状和粗糙的外表面会直接破坏细胞膜完整性,进而改变细胞膜的粘性及流动性、破坏离子泵的功能、使得胞内物质流出、干扰细胞与外部环境的物质交换过程,最终抑制生物体的生长[40,43-44,60]。
2.2 化学抑制过程(Chemical inhibition)
化学抑制是纳米CeO2产生生物毒性过程的重要方面,主要包括纳米CeO2在其颗粒表面或细胞内部发生的一系列氧化还原反应。生物体-纳米CeO2体系中相关的氧化还原化学过程会直接产生过量的ROS,引起细胞、蛋白质及DNA的损伤。下文主要从纳米CeO2表面产生的ROS、微生物细胞内部产生的ROS、纳米CeO2与生物体亚细胞结构间特殊的化学反应3个方面阐明其化学抑制机理。
2.2.1 纳米CeO2表面产生的ROS
在外部环境条件作用下,纳米CeO2的氧化还原特性会使得其晶格内部发生Ce(Ⅳ)与Ce(Ⅲ)相互转化的还原反应,进而激发可产生ROS的类芬顿反应或在其晶格内部直接产生ROS[61-64]。Preda等[64]证实,外部氧分子(O2)与纳米CeO2表面的氧空位(Vo)相互作用会形成过氧(O22-)或超氧自由基,相关反应过程可以描述为:
[2Ce3+,Vo] + O2→ [2Ce4+, O22-]
(1)
(2)
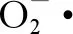
2.2.2 纳米CeO2在生物体内部产生的ROS
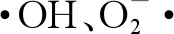
关于纳米CeO2在细胞内部诱导产生ROS的机理尚不明确,但是在生物体系中,诸多因素会激发氧化还原类的反应并产生ROS,例如纳米CeO2与无机、有机或液态的脂质发生的反应。根据已有文献,纳米CeO2在胞内产生ROS的主要过程可以归纳为以下几个反应[61,63,70-71]:
Ce(Ⅳ) + Xred-→Ce(Ⅲ) + Xox
(3)
(4)
(5)
H2O2+ Ce(Ⅲ)→Ce(Ⅳ) + OH-+ ·OH
(6)
2LOOH + Ce(Ⅲ)→Ce(Ⅳ) + 2LO·+·OH+ OH-
(7)
式中:Xred-表示胞内与生理学相关的还原性物质,Xox是其氧化状态,LOOH表示胞内脂质过氧化物,LO·表示过氧化反应中产生的烷氧基自由基。然而目前已有关于纳米CeO2在胞内产生ROS的化学反应过程的研究还不够全面,潜在机理方面的探究还有待深入。今后的研究应增加对纳米CeO2表面催化活性位点的关注,同时尝试分析氧化还原反应产物的物质的量比及分子组成,这2个方面会对未来揭示胞内ROS的产生机理提供一定的帮助。
2.2.3 纳米CeO2与生物大分子间的化学反应
系统阐明纳米CeO2与生物体相关的大分子间的化学反应是揭示纳米CeO2致死效应的关键。因此,关于纳米CeO2在微生物细胞内与胞体本身结构或组分间发生的化学反应受到越来越多的关注。
已有研究得出,当纳米CeO2进入到生物体内与生物大分子发生接触时,两者之间主要发生以下4个方面的相互作用。(1)纳米CeO2可以直接从磷脂双分子层中剥夺有机磷并与其形成络合物,导致细胞膜裂解和细胞器损伤[72];(2)纳米CeO2还可以直接使三磷酸腺苷(ATP)和含磷氨基酸中的磷脂键断裂,影响生物体的正常生理功能[73-74];(3)纳米CeO2与生物体系中电活性物质间的相互作用同样会诱导纳米CeO2的细胞毒性。例如,生物体中含有双硫键的大分子(金属硫蛋白、色氨酸等)是具有代表性的还原物质,其很容易被纳米CeO2氧化,从而导致大分子结构被分解[73,75];(4)由于Ce(Ⅲ)与Ca2+具有近乎相同的结构和半径,生物体内包含Ca2+的化合物中,Ca2+很容易被Ce(Ⅲ)取代[76-77]。然而,一旦控制细胞内部信号传导及起调节作用的蛋白分子结构中的Ca2+被Ce(Ⅲ)取代,细胞功能会发生紊乱,最终影响细胞活性[78]。
3 本领域存在的不足及未来发展方向(Insufficiency and future development direction in this field)
本文系统综述了纳米CeO2对细胞、组织器官、植物、水生生物及土壤生物的毒性效应,进一步从物理损伤和化学抑制2个方面剖析了纳米CeO2的毒性作用机制。但已有研究中在相同的环境介质内,不同暴露体系下受试生物的种类及培养模式、纳米CeO2的表面性质、生物活性的表征手段不同,导致得出的纳米CeO2的潜在生态风险存在差异。为进一步揭示纳米CeO2的环境生态效应,亟需开展更多相关方面的研究。
(1)已有的关于纳米CeO2生态毒性效应的研究很少关注到纳米CeO2本身的物理化学性质、在不同暴露介质中产生的迁移转化过程对其毒性效应的作用,进一步导致不同研究中的差异性结果难以得到合理的解释。因此,为更加深入的阐述纳米CeO2引起的生态环境风险,亟需探究纳米CeO2不同理化性质与其生物效应的关系。
(2)目前已有的关于纳米CeO2生态风险评估的实验中,所选用的纳米CeO2多为商业生产的纳米粉末。然而在实际的环境介质中累积、赋存的纳米CeO2多为经过老化后从包含纳米CeO2的产品中释放出来的,因此探究老化后纳米CeO2的生物毒性效应对真实客观地评价其生态风险是很有必要的。
(3)尽管研究者已经普遍认识到纳米CeO2具有的潜在生态风险,但哪些措施能够缓解其毒性效应、缓解机理是什么这一问题至今无人给出明确的答案。因此,在接下来的研究中,深入探究纳米CeO2生态毒性的缓解措施对推动纳米CeO2安全合理利用和纳米技术可持续发展具有重要意义。
(4)纳米CeO2表面存在的氧空缺及其晶格内部存在的Ce(Ⅲ)与Ce(Ⅳ)的相互转化,使其在特定的环境介质或一定的剂量范围内应用时生物毒性较低,甚至表现出一定的抗氧化损伤作用。因此,探究不同环境介质、不同环境浓度下纳米CeO2的抗氧化损伤作用及潜在机制对于纳米CeO2的安全合理利用具有重要意义。

