纳米材料的非毒性环境效应研究进展
马晓琳,何恩静,肖翔,,*
1. 江苏大学环境与安全工程学院,镇江 212013
2. 安徽大学物质科学与信息技术研究院,合肥 230601
纳米材料作为材料科学研究的热点,被认为是当前最具前途的科研领域之一[1]。但在快速扩大的生产及使用过程中,纳米材料会不可避免地被释放到环境中并对动物、植物及微生物造成毒性胁迫,从而引发人们对其生态环境风险的担忧[2]。但是相较于实验室细胞毒性研究所用的测试浓度,目前纳米材料的实际环境浓度一般较低。通过动态概率材料流动模型预测,纳米材料在地表水中浓度约为10-6~10-4mg·L-1,沉积物中浓度约为6.7~40 000 μg·kg-1[3]。其环境暴露尚难以引起严重的急性生物毒性效应[4]。纳米材料对生物体无明显生长抑制或毒性胁迫表型情况下的非毒性环境效应逐渐成为当前环境领域的研究热点。本文针对近年来纳米材料非毒性环境效应的研究进展进行了综述,以期对纳米材料环境效应有一个新的认识,并为纳米材料的实际应用扩展新的思路。
1 纳米材料的潜在危害及毒性作用机制(Potential hazards and toxic mechanisms of nanomaterials)
随着纳米产业的飞速发展,纳米产品的种类和数量急剧增加。根据2019年“纳米技术产品数据库”记录,纳米产品高达8 902种[5]。伴随着生产的增长和应用的扩大,纳米材料越来越多地被释放到大气、土壤及水体中,并在环境中不断迁移和累积[2]。纳米材料的尺寸较小,其环境释放后易于通过表面渗透、生物吸食以及食物链富集等方式从环境进入生物体内[6]。因此,纳米材料已被视为一种新型污染物并引起了人们对其生态安全性的广泛担忧。
目前,纳米材料的环境效应研究主要针对高剂量急性暴露条件下的细胞毒性胁迫而开展。现有研究证明,纳米材料对生物体产生的毒性效应主要通过以下几种机制:(1)纳米材料可通过静电或吸附作用结合于细胞表面,产生遮蔽效应,甚至改变细胞膜的结构与功能,从而影响细胞对外界营养物质的摄取[7];(2)纳米材料可以进入生物体,破坏细胞膜的完整性,并通过不同的机制诱导细胞产生活性氧自由基(ROS),从而引起脂质过氧化、蛋白质变性以及DNA损伤,甚至导致细胞死亡[4];(3)金属单质/金属氧化物纳米材料还可以释放金属离子,导致细胞氧化胁迫,进而对生物体产生毒性效应[8]。但是,目前环境中纳米材料的实际浓度较低,研究调查发现自然地表水和废水处理厂废水中纳米材料的浓度低至0.01 mg·L-1,尚未达到对环境生物造成严重毒性胁迫的程度[9]。因此,纳米材料的非毒性环境效应研究已逐渐引起人们的关注,并已成为当前环境领域的研究热点之一。
2 纳米材料对植物的非毒性影响(Non-toxic effects of nanomaterials on plants)
环境中的纳米材料通过不同的方式作用于植株。大气中的纳米材料可直接作用于植物地上部分,而土壤中的纳米材料则可直接影响根系发育,甚至进入植物内部从而影响植株生长[10]。环境释放的纳米材料种类的多样性也导致其对植物的非毒性影响的作用机制较为复杂。通常,纳米材料对植物的非毒性生态效应可从种子萌发和植物生长2个阶段来探究(图1)。
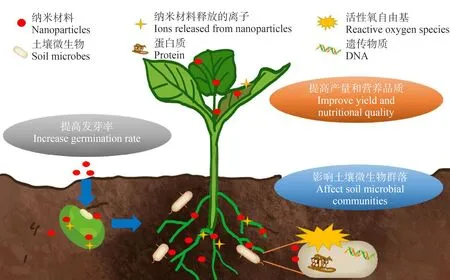
图1 纳米材料对种子萌发和植物生长的影响
2.1 种子萌发
种子萌发是植物生命周期的起点,也是植物对外界环境因子最敏感的时期之一。种子的萌发状况将直接影响植物的生长量以及生物生产量,进而影响农作物的产量和营养品质[11]。
稳定性较低的金属氧化物纳米材料可释放金属离子[12-13]。低浓度的金属离子可以刺激种子代谢,从而促进种子萌发。研究证实土壤中添加750 mg·kg-1的ZnO纳米颗粒能够提高紫花苜蓿种子的萌发率[12]。考虑到锌(Zn)是植物生长所必需的营养元素,纳米ZnO对种子萌发的促进效应可归因于其所释放的锌离子具有较高的生物利用度,易于吸收,从而促进种子的代谢。Acharya等[13]发现银(Ag)纳米颗粒(31.3 mg·L-1)释放的Ag+能够穿透种皮进入种子组织,促进种子内的多糖水解以提供能量,进而刺激了西瓜种子的萌发。
稳定性纳米材料虽不能释放金属离子,但是其低剂量暴露依然对植物种子的萌发呈现刺激效应[14-16]。Zhang等[14]发现40 μg·mL-1的纳米石墨烯(GO)可以促进番茄种子萌发。和对照组相比,GO处理能够将种子萌发率提高43%。Pandey等[17]也发现施加50 μg·mL-1的GO和多壁碳纳米管(multi-walled carbon nanotubes, MWCNTs)能显著提高柳枝稷种子的发芽率,并促进了高粱种子的早期萌发。纳米金(Au)在10 μg·mL-1的浓度下可以通过提高种子的吸水率显著促进拟南芥种子的萌发[15]。这些纳米材料对种子萌发的促进作用可归因于其能渗透种皮,并对种皮造成物理损伤,从而促进水分的吸收,提高种子的发芽率[14]。Khodakovskaya等[18]证实培养基中含有的碳纳米管(10~40 μg·mL-1)可以渗透番茄种皮并促进种子的萌发。另外,通过水培实验发现纳米TiO2(20 mg·L-1)也可渗透芦苇种皮,并对芦苇种子发芽有一定的促进作用[16]。
2.2 植物生长
纳米材料对植物的低剂量刺激效应主要体现在其能促进植物生长发育以及提高植物对不良环境胁迫的耐受性(表1)。
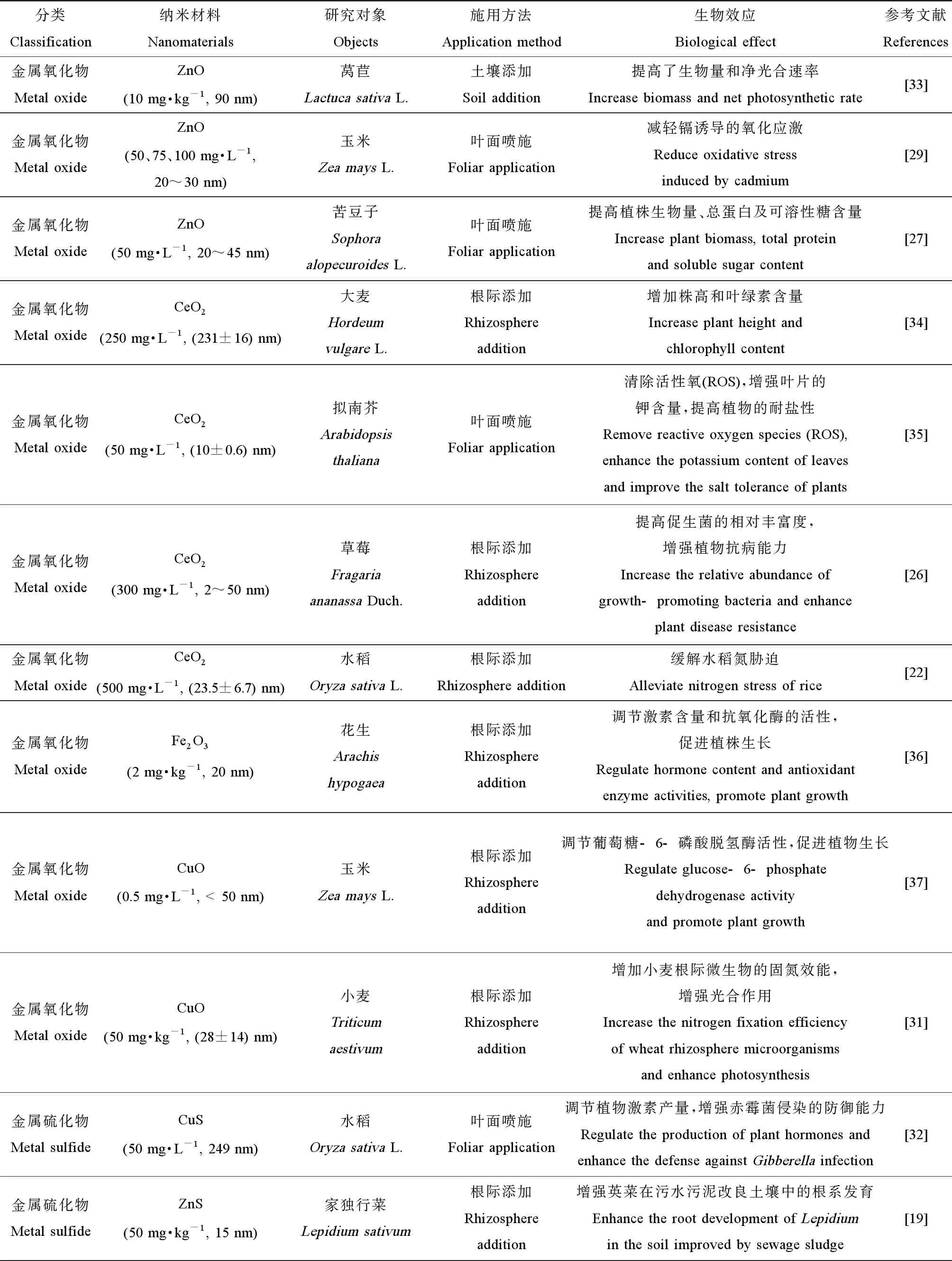
表1 纳米材料对植物的影响
所有植物都需要微量金属元素作为营养物质,以促进其代谢和其他生命活动。低浓度的纳米颗粒可以作为营养载体,为植物持续提供营养以促进其生长。与常规速溶矿物质相比,纳米颗粒在向目标物输送营养方面具有高效、缓释的优势。已发现施加50 mg·kg-1的金属氧化物ZnO和硫化物ZnS能够促进英菜在污水污泥改良土壤中的根系生长[19]。Liu等[20]研究发现,低浓度的纳米锰(Mn)(50 mg·L-1)作为纳米肥料所释放的有益金属离子虽然对生菜种子的萌发没有明显作用,但是却对根的生长有明显的刺激效应,从而促进植株发育。不溶性纳米材料也能影响植物的生长。Seddighinia等[21]发现50 mg·L-1的MWCNTs能通过根系吸收,促进苦瓜根系和茎的伸长。纳米材料还能缓解营养元素失衡对植物产生的不利影响。500 mg·L-1的纳米CeO2可以在0.72 mmol·L-1的低氮环境中增强参与氮同化作用的谷氨酰胺合成酶(GS)、谷氨酰胺草谷氨酸转氨酶(GOGAT)以及谷氨酸脱氢酶(GDH)的活性,促使植物中的氮含量增加;并在7.15 mmol·L-1的高氮环境下调节抗氧化酶系统、脯氨酸以及植物激素的含量,减少DNA的损伤,增强植物对氮胁迫的耐受性[22]。
纳米材料对植物生长的刺激效应还体现于提高植物对盐碱[23]、干旱[24]、重金属胁迫[25]以及病原菌[26]等不利环境因素的耐受性。
纳米材料可以提高植物对盐胁迫的耐受性。Ye等[23]发现纳米Mn(0.1、0.5和1 mg·L-1)可以渗透种皮并形成了纳米粒子-电晕复合物,促使辣椒根部伸长率提高约33%,缓解了盐胁迫。Wan等[27]发现在盐胁迫条件下,通过在叶面喷施50 mg·L-1的纳米ZnO能显著提高苦豆子植株高度、根系鲜重、叶片总蛋白含量、叶片/根系可溶性糖含量、叶片锌含量以及根内铜离子的含量,从而提高幼苗的耐盐性。碳基纳米材料也能对植物的耐盐性产生积极影响。Pandey等[17]发现GO和MWCNTs(50 μg·mL-1)可作为植物生长调节剂,不但能够促进能源作物高粱和柳枝稷的种子萌发,还能通过吸附去除Na+来显著缓解盐胁迫对植物生长的抑制。50 mg·L-1的单壁碳纳米角(single-walled carbon nanohorns, SWCNHs)可以提升光合效率及糖代谢,维持盐胁迫下膜的完整性[27]。
纳米材料能增强植物的耐旱性。Kim等[24]发现,0.1 g·L-1的纳米零价铁(nZVI)能刺激拟南芥中氢离子-三磷酸腺苷酶(H+-ATP)的活性,降低质外体的pH值,以及增加叶片面积和气孔孔径宽度,从而提高植物的耐旱性。100 μg·mL-1的GO通过增强植物抗氧化酶活性和光合作用,减少活性氧积累,维持细胞膜的稳定性、气孔的开放、叶肉细胞和细胞器的完整性来减轻干旱胁迫的损伤[28]。
纳米材料还可减轻有毒重金属对植物生长的胁迫。Rizwan等[25]发现使用纳米ZnO(25、50、75和100 mg·L-1)和纳米Fe(5、10、15和20 mg·L-1)浸种,可以降低镉在小麦中的累积,增加植物抗氧化酶活性,并减轻镉胁迫所导致的小麦叶片的电解质渗漏。纳米ZnO(50、75和100 mg·L-1)的叶面喷施,也能显著降低玉米对镉的吸收,从而缓解了镉诱导的氧化应激反应[29]。
植物的生长依赖于与土壤微生物的相互作用。纳米材料对植物生长的促进效应除了对植物自身的直接影响外,还体现于其调控植物-微生物的互作。土壤微生物能够调节有机质分解、养分循环和能量转换。纳米材料可以通过影响土壤微生物活性和群落组成,从而间接促进植物代谢[30]。Guan等[31]研究发现,向土壤中添加50 mg·kg-1的CuO纳米颗粒所释放的铜离子能够增加小麦根际微生物的固氮效能,同时抑制其反硝化作用,促进土壤硝酸盐的累积,从而间接刺激小麦光合作用。另有研究发现,暴露于300 mg·L-1的纳米CeO2可通过增加黄杆菌属(Flavobacterium)和假单胞菌属(Pseudomonas)等植物根系促生菌的相对丰富度,抑制致病性根瘤菌的生长来提高草莓的生长和抗病能力[26]。水稻叶面喷施的纳米CuS(50 mg·L-1)可缓慢释放出铜离子。铜离子一方面直接抑制赤霉菌的生长,另一方面可被植物所吸收,调节植物激素水杨酸和茉莉酸的产量,增强植物对赤霉菌侵染的防御能力,从而抑制农作物病害[32]。
3 纳米材料对微生物的非毒性影响(Non-toxic effects of nanomaterials on microorganisms)
3.1 纳米材料对抗性基因水平转移的影响及作用机制
近年来,抗生素抗性基因(antibiotic resistance genes, ARGs)的环境扩散已造成严重的公共卫生安全威胁。纳米材料不但能在高强度光激发条件下显著抑制耐药细菌及ARGs的水平转移,还能在低毒性胁迫下通过接合、转化和转导等途径来影响ARGs的环境传播(表2),从而对环境产生非毒性效应。Qiu等[43]首次发现纳米Al2O3(0~50 mmol·L-1)能够促进抗性质粒RP4从大肠杆菌(Escherichiacoli)到沙门氏菌(Salmonella)的接合转移效率。Liu等[44]的研究证明,添加10 mg·L-1的纳米Al2O3显著诱发细菌胞内ROS含量的增加,提高细胞膜通透性,刺激了外膜蛋白基因ompC和接合相关基因intA的表达,从而促进ARGs从E.coli到天蓝色链霉菌(Streptomycescoelicolor)的跨属水平转移。Lu等[45]也证实0.1 μg·L-1的银纳米颗粒能够诱导胞内ROS产生,造成细胞膜损伤并诱发应激反应,从而提高ARGs的跨属转移效率。Han等[46]首次证实0.5 mmol·L-1的纳米TiO2可促进丝状噬菌体gM13对E.coliTG1的转导效率,从而有助于ARGs的水平转移。除了人工合成的纳米材料,一些天然纳米材料也能促进ARGs的水平转移。Li等[47]证实天然闪锌矿纳米颗粒(0.5~50 mg·L-1)能够显著提高ARGs在E.coli种间的水平转移效率。
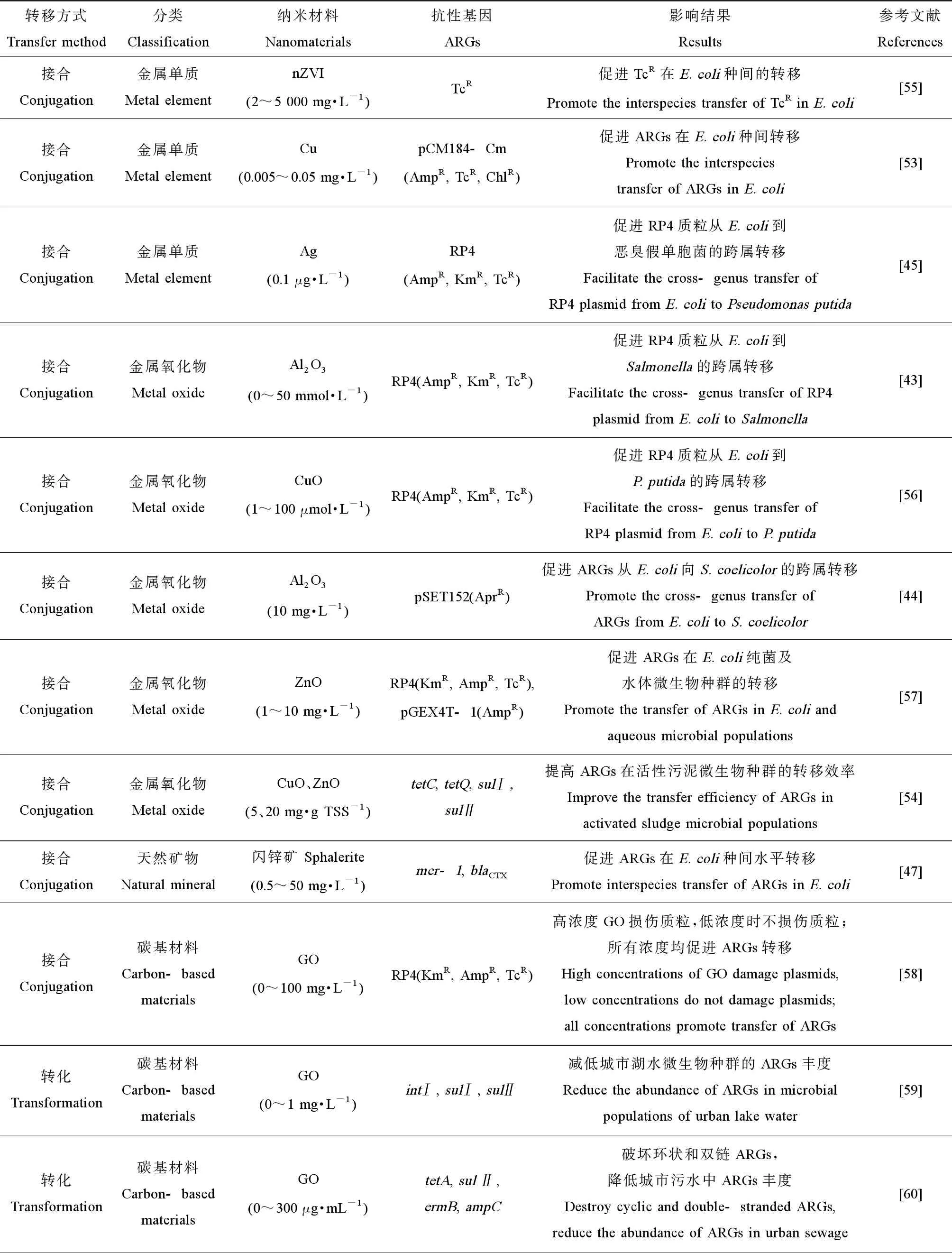
表2 纳米材料对抗生素抗性基因(ARGs)水平转移的影响
纳米材料的低剂量暴露不仅能促进纯菌体系中ARGs的水平转移,也能影响ARGs在天然混合菌群中的分布。Zhang等[48]发现铁纳米颗粒(0.5 g·L-1磁性Fe3O4和1 g·L-1nZVI)的添加,能够降低β-内酰胺酶抗性编码基因(blaOXA)的潜在宿主(变形杆菌、厚壁菌以及放线菌)在厌氧消化污泥中的菌群丰度,从而降低ARGs的绝对丰度。Xiang等[49]也发现0.5 g·L-1的磁性Fe3O4和1.0 g·L-1的nZVI可以增强厌氧序批式反应器的效能并显著降低红霉素耐药基因ermA和ermT等的丰度。Chen等[50]发现0.2~1 mg·L-1的纳米ZnO颗粒能够影响水体中微生物种群结构,促进sulⅠ、tetA、ermB以及qnrS等抗性基因丰度的增加,显著增加河口水中总ARGs的丰度。
纳米材料影响ARGs水平转移的作用机制,可归咎于以下因素。首先,纳米材料的亲水界面和高比表面积使其能够充当“连接桥”的作用,从而增强ARGs供体(裸露DNA、细菌和噬菌体)和受体菌的直接接触,促进ARGs水平转移的进行。有研究证明,纳米Al2O3(0.05~50 mmol·L-1)能吸附于菌体表面,促进供体菌与受体菌之间形成“接合桥”,从而将抗性质粒RP4跨属的转移效率提高200倍以上,并将属内的转移效率提高至250倍以上[43]。具有较好亲水性的纳米TiO2(0.5 mmol·L-1)有利于噬菌体在菌体周围聚集,从而有效促进ARGs以转导方式进行水平转移[46]。但是纳米材料的物理吸附特性有时也能抑制ARGs通过转化方式进行水平传播。Hu等[51]发现纳米ZnO、Al2O3以及TiO2的浓度<50 mg·L-1时,都能够吸附抗性质粒pUC19,显著阻碍E.coli对青霉素抗性基因的摄取。其次,外源ARGs无论以何种方式进入受体细菌,都需要经历穿膜过程。因而细胞膜的稳定性对于ARGs扩散效率至关重要。纳米材料可以通过自身的理化特性直接损伤细菌的生物膜,也可以通过诱发ROS来降低细胞膜的稳定性,从而降低细胞膜对ARGs进入细胞的阻碍作用,便于ARGs跨膜进入受体细菌[52]。但是对生物膜过度的损伤也可能会导致受体细菌死亡,从而降低ARGs的水平转移效率[53]。另外,无论接合、转化还是丝状噬菌体介导的转导,都需要受体细菌菌毛的参与。因此,纳米材料通过刺激菌毛相关基因的表达,增加细菌表面菌毛的合成,能够有助于ARGs进入细胞,提高水平转移效率[54]。
3.2 纳米材料调控生物膜形成及作用机制
生物膜是自然界中微生物存在的一种重要形式,其形成过程依赖于信号分子调控的细菌间信息交流或直接接触[61]。近年来,纳米材料被证实可以对微生物生物膜的形成发挥非毒性调控作用。
Ouyang等[62]发现低浓度纳米ZnO(0.5~30 mg·L-1)显著促进细菌生长和生物膜形成。一方面低浓度纳米ZnO可促使小部分死亡细菌释放的胞内DNA、RNA、脂质、蛋白质和糖等作为活细胞的营养物质,刺激活细胞数量增加;另一方面,纳米ZnO可促进细菌群体感应基因的表达,诱导细胞产生更多的信号分子(c-di-GMP),从而增强细胞间的通讯并提高细胞对环境压力的适应性,从而有利于生物膜的形成。与此同时,低浓度纳米Ag(21.6 μg·L-1)也被证实可以通过上调群体感应和脂多糖生物合成基因,将生物膜基质中糖和蛋白含量增加55%和114%,便于生物膜的附着和结构维护并促进生物膜的发育[63]。但是Xiao等[64]发现100 mg·L-1的纳米TiO2在低强度光催化条件下所产生的光生ROS虽不会对E.coliK12造成明显的细胞毒性,但却能通过降解群体感应Ⅱ型自诱导信号分子呋喃酰硼酸二酯(autoinducer-2, AI-2),延迟群体调控系统的触发,从而抑制鞭毛运动和胞外多糖的合成,并最终导致E.coliK12生物膜发育的迟滞。
3.3 纳米材料促进废水生物处理效能及作用机制
环境中释放的纳米材料可通过水循环汇集进入污废水处理系统。纳米材料虽然已被证实广泛分布于实际的废水处理过程中,但是由于活性污泥的不停更新,纳米材料的实际浓度难以抑制污废水处理过程[65]。因此,低浓度纳米材料对环境水处理的非毒性效应受到关注。现有的研究表明,纳米材料能够影响混合菌群的结构和功能,从而对废水有机物去除、脱氮和除磷效能产生影响[65-67]。
还原性纳米材料可以通过化学反应,降低水体溶解氧含量,从而为厌氧微生物提供良好的生存环境。Chen等[65]证实20 mg·L-1的nZVI可以通过化学-生物耦合作用消除废水处理系统中溶解氧,营造更加严格的厌氧条件以利于厌氧消化。同时释放的Fe2+能促进叶绿素和类胡萝卜素的合成,增加缺氧条件下光合细菌的生物量,并将废水的化学需氧量去除率提高164.3%,显著促进了废水中有机物的去除。
纳米材料能增强废水处理系统的脱氮效率。Wang等[66]发现虽然高剂量纳米Ag(10 mg·L-1)暴露会导致废水处理系统中过量ROS的积累和总抗氧化能力(T-AOC)的降低,抑制硝化和反硝化酶活性,减少功能基因丰富度,并降低耦合硝化和反硝化(coupled nitrification and denitrification, CND)效能。但是低剂量纳米Ag(2 mg·L-1)对厌氧微生物体现出明显的刺激效应。低剂量纳米Ag暴露可以提高反硝化基因narG的丰富度,增强硝化酶(氨单加氧酶(AMO)、羟胺氧化还原酶(HAO)和亚硝酸盐氧化还原酶(NOX))和反硝化酶(硝酸盐还原酶(NAR)和亚硝酸盐还原酶(NIR))的活性,从而显著增强CND效能。Peng等[68]发现纳米Ag(108 mg·L-1)能提高颗粒污泥内部孔径,促进基质的扩散,提高厌氧氨氧化相关酶(亚硝酸盐还原酶(NirS)、联氨脱氢酶(Hdh)和联氨合成酶(HZS))的活性,从而增强厌氧氨氧化颗粒污泥的生长速度和脱氮性能。
纳米材料还能有助于废水中磷的去除。Li等[67]发现10~60 mg·L-1纳米TiO2诱导产生的低水平ROS增强了多聚磷酸盐激酶(PPK)和多聚磷酸盐水解酶(PPX)的活性,提升聚磷菌的磷释放和吸收速率,提高磷的去除率。另外,为克服纳米颗粒的团聚并增强其分离性和水力传导性,在铁纳米颗粒表面镀铜所合成的双金属铁基纳米颗粒nZVI/Cu0(10 mg·L-1),其表面具有更强的活性位点,对水体总磷的吸附效率更高。同时此双金属纳米颗粒的腐蚀所产生的氢气能被细菌作为呼吸的电子供体,增加细菌生长,进而对后续混凝和沉淀过程产生重要影响[69]。
3.4 纳米材料增强生物能源生产及作用机制
生物能源是一种绿色无污染、易于生产、具有环保和经济效益的可再生能源。利用生物能源逐步取代化石能源已成为当前社会发展的共识。而纳米材料对生物能源生产的影响也逐渐受到人们的关注。
微生物可通过厌氧发酵将有机质转化成氢气。生物制氢是当前生物质能源生产最重要的形式。纳米材料较小的尺寸和较大的表面积为酶与底物的相互作用提供了更多的反应场所,从而直接提升酶促产氢效率[70]。另外,纳米材料还可通过刺激电子转移,提高生物制氢相关酶的活性,从而促进生物氢的生产。Zhang和Shen[71]认为5 nm纳米金(0.79 μg·L-1)可以通过表面效应和量子尺寸效应刺激氢的产生,并提高产氢细菌的生物活性,从而将底物利用率提高56%,生物氢产率提高46%。Beckers等[72]发现包裹在多孔二氧化硅内的纳米FexOy(10-6mol·L-1)能将丁酸梭菌的生物氢产量和生产率提高了38%和58%。这主要依赖于纳米材料在黑暗发酵过程中对电子转移效率和氢化酶活性的提升。氢化酶和固氮酶作为生物制氢途径最重要的2种酶,它们的活性位点都含有铁和镍作为金属辅基[73]。纳米材料,特别是添加到生物反应器中的磁性纳米材料,如铁或镍,可以与这些酶的活性位点结合,提升电子转移效率,从而提高生物制氢的产量[72, 74]。
纳米材料可以促进生物甲烷的产生。纳米TiO2(1 g·L-1)能够与厌氧污泥中的胞外多聚物紧密结合,促进厌氧消化过程从而增强甲烷的生成[75]。Aguilar-Moreno等[76]发现在厌氧消化鸡粪过程中,人为添加20 mg·L-1的Fe3O4纳米颗粒能显著提高甲烷的生产率和累计产量。另外纳米Fe3O4(750 mg·L-1)作为一种导电材料,能粘附于细胞表面,促进电子由二次发酵细菌至产甲烷古菌的种间电子转移,从而增加了甲烷产量,并促进可生物降解有机物的分解[77]。除Fe3O4纳米颗粒外,nZVI(1 g·L-1)也能促进污泥厌氧消化的效能,增强有机质的降解率,并将甲烷产量提高20%以上[48]。
纳米材料在提高微生物产电方面也卓有成效。纳米碳量子点(500 μg·mL-1)已被证实可被希瓦氏菌(ShewanellaoneidensisMR-1)有效吸收,提高细胞代谢率,增加细胞粘附和电负性,促进电子的跨膜传递和胞外转移,从而将S.oneidensisMR-1在微生物燃料电池中的电流峰值和输出功率分别提高7.34倍和6.46倍[78]。使用纳米Ti修饰的碳电极,不仅有助于电子从细菌向电极的转移过程,还有助于克雷白氏杆菌(KlebsiellapneumoniaeL17)细胞在碳电极上的附着,从而增强微生物的产电能力[79]。
4 总结与展望(Summary and prospect)
本文系统地概述了当前纳米材料非毒性环境效应的研究进展,概括了纳米材料对植物和微生物的非毒性作用机制,并探讨了纳米材料在农业生产、环境污染控制和生物质能源等方面的应用,从而加深了对纳米材料环境影响的理解,并为纳米材料的环境安全性评估及实际应用提供新的思路。但目前关于纳米材料非毒性环境效应的研究中仍然存在着一些不足,有待更多的深入研究。
(1)种类繁多的纳米材料在生产使用过程中已被释放到环境中。但是目前关于纳米材料非毒性环境效应的研究刚刚起步,尚局限于对单一纳米材料的生物效应进行评估。对于2种及多种纳米材料的复合非毒性环境效应还未见报道。考虑到不同纳米材料的生物效应机理的差异,纳米材料的非毒性复合生物效应可能会表现出更加复杂的结果。
(2)目前纳米材料的非毒性生物效应的研究尚未涉及低剂量纳米材料长期暴露研究。低剂量纳米材料的长期处理所导致的生物刺激或者毒理耐受是否会影响生态系统种群演变以及功能改变,值得进一步深入探究。
(3)当前低剂量纳米材料已经体现出对生物的刺激效应。下一步的工作需要从纳米材料-生物互作机理解析入手,全面开展纳米长效缓释肥、纳米短期刺激剂等新型纳米产品的开发,并全面研究其在农作物生产和环境污染治理方面的应用。

