β 榄香烯对脂多糖诱导的肾小管上皮细胞氧化应激和凋亡的影响及作用机制
杨嘉陵 ,谷成杰 ,欧国东
作者单位:1 重庆市双桥经济技术开发区人民医院药剂科,重庆 400900;2 重庆市巴南区接龙中心医院药剂科,重庆 401344;3 重庆市大足区第二人民医院药剂科,重庆 402368
肾小管损伤是各种急慢性肾病的主要病理特征,可见于肾脏因缺氧、中毒、缺血再灌注损伤、糖尿病肾病等,肾小管上皮细胞是肾小管损伤的直接靶细胞。研究药物对肾小管上皮细胞的修复机制对肾损伤病人具有重要意义。
脂多糖可诱导肾小管上皮细胞产生凋亡和氧化应激反应,造成细胞损伤,脂多糖诱导的肾损伤模型为大多研究者所采用。研究表明,β 榄香烯(β-elemene)是具有广谱抗肿瘤效果,在非肿瘤疾病中具有抗氧化损伤、抗凝血、抗血栓和延缓白内障的作用,且毒副作用小。研究还发现,β 榄香烯可抑制肾小球系膜细胞纤维化,并抑制炎症反应。但是 β 榄香烯在脂多糖诱导的肾小管上皮细胞(HK-2)中的影响和机制尚不清楚。
本研究于 2018年 1月至 2019年 2月以脂多糖诱导 HK-2 产生的氧化应激损伤为模型,以 β 榄香烯处理的方法来检测 β 榄香烯对脂多糖诱导的 HK-2损伤和凋亡的影响和作用机制。
1 材料与方法
1.1 材料
肾小管上皮细胞系 HK-2(购自 ATCC);DMEM 高糖培养基和胎牛血清(FBS)、胰蛋白酶Trypsin(购自 Gibco 公司);脂多糖、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)(购自 Sigma-Aldrich 公司);β 榄香烯(购自四川省维克奇生物科技有限公司);谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)试剂盒(购自北京索莱宝科技有限公司);Bcl-2 相 关 X(Bax)抗体、B 细胞淋巴瘤-2(Bcl-2)抗体、核因子 E2相关因子 2(Nrf2)抗体、血红素氧合酶-1(HO-1)抗体和抗 β 肌动蛋白(β-actin)抗体(购自英国 Abcam公司);活性氧自由基(ROS)和丙二醛检测试剂盒(购自上海碧云天技术有限公司);流式法细胞凋亡检测试剂盒(购自美国 BD 公司);流式细胞仪(购自美国 BD 公司),显微镜、酶标仪(购自美国 Bio-Rad公司),BCA 蛋白浓度检测试剂盒(购自江苏凯基生物技术股份有限公司)。1.2 方法
1.2.1 细胞培养和实验分组 将肾小管上皮细胞HK-2 培养于含 10 % FBS、1% 青-链霉素的 DMEM 高糖培养基中,置于 37 ℃、5% 二氧化碳、湿度 95% 的培养箱中培养,待细胞融合为一层时,消化传代。
NC 组:空白对照培养基不加药物;脂多糖组:培养基中加入终浓度 1 μg∕L 的脂多糖,培养 24 h;脂多糖+β 榄香烯组:培养基中加入终浓度 1 μg∕L 的脂多糖培养 24 h,弃培养液,然后加入含不同终浓度 β 榄香烯(2.5 mg∕L、5.0 mg∕L 和 10.0 mg∕L)的 DMEM 高糖培养液培养 24 h。
1.2.2 四甲基偶氮唑盐微量酶反应比色法(MTT法)检测细胞存活率 待“1.2.1”分组的 HK-2 细胞培养至对数生长期,收集细胞并进行消化,以每孔2×l0个细胞接种于 96 孔板中,培养细胞至 24 h、48 h、72 h 和 96 h 时,进行 MTT 实验,每孔加入 20 μL MTT 溶液,培养 4 h 后弃上清,再每孔加入 150 μL DMSO,室温震荡 5 min,酶标仪检测吸光度A 值(490 nm),计算细胞存活率。
1.2.3 流式细胞术测定细胞凋亡率 经脂多糖或∕和 β 榄香烯处理后各组细胞,以 2×10个∕孔接种于 6孔板中,培养 48 h ,弃培养液,消化,离心收集细胞,按照细胞凋亡检测试剂盒说明书进行操作,室温避光 20 min,流式细胞仪测定细胞凋亡率。
1.2.4 蛋白质印迹法检测蛋白表达 将对数生长期的各组细胞(NC 组、脂多糖组、脂多糖+β 榄香烯组)进行收集,加入 RIPA 裂解液裂解细胞,超声破碎,收集蛋白,BCA 试剂盒测定蛋白浓度。将每个样本进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),以 β-actin 为内参照,分析蛋白水平。
1.2.5 检测细胞中 GSH-PX、SOD、丙二醛和 ROS 含量 根据“1.2.4”的方法收集细胞,计数,裂解细胞,收集细胞上清液,根据 GSH-PX、SOD、丙二醛和 ROS试剂盒的说明书要求进行检测,计算细胞裂解上清中各指标含量。
2 结果
2.1 β 榄香烯可提高脂多糖诱导的肾小管上皮细胞HK-2 存活率
结果显示,与 NC 组[24~96 h 细胞存活率分别为(100.00±3.56),(100.00±4.78),(100.00±3.17),(100.00±5.64),周期蛋白依赖性激酶(CDK)4含量(0.79±0.09),CDK6 含量(0.64±0.05)]相比,脂多糖组的 HK-2 细胞存活率在 24~96 h[(73.65±3.39),(68.24±5.93),(63.52±3.10),(58.27±4.05)]显著下降 ,CDK4(0.23±0.03)和 CDK6 表达量(0.41±0.05)显著下降(P
<0.001,P
<0.001,P
<0.001,P
<0.001,P
<0.001,P
<0.001);与脂多糖组相比 ,β 榄香烯 2.5 mg∕L+ 脂多糖组[(78.42±3.39),(74.63±4.29),(65.39±4.18),(62.37±4.14)]、β 榄香烯 5.0 mg∕L+脂多糖组[(89.43±5.67),(79.64±6.27),(73.64±4.29),(65.37±4.12)]和 β 榄香烯 10.0 mg∕L+脂多糖组[(87.24±5.68),(78.69±5.42),(72.13±4.09),(63.27±4.25)]的细胞存活率增高 ,CDK4[(0.42±0.04),(0.51±0.05),(0.65±0.07)]和CDK6 表达量[(0.51±0.04),(0.56±0.04),(0.62±0.05)]显著增多(P
=0.030、0.016、0.003、0.000、0.034、0.023;P
=0.009、0.000、0.000、0.000、0.008、0.014;P
=0.000、0.000、0.000、0.000、0.000、0.002),见图1。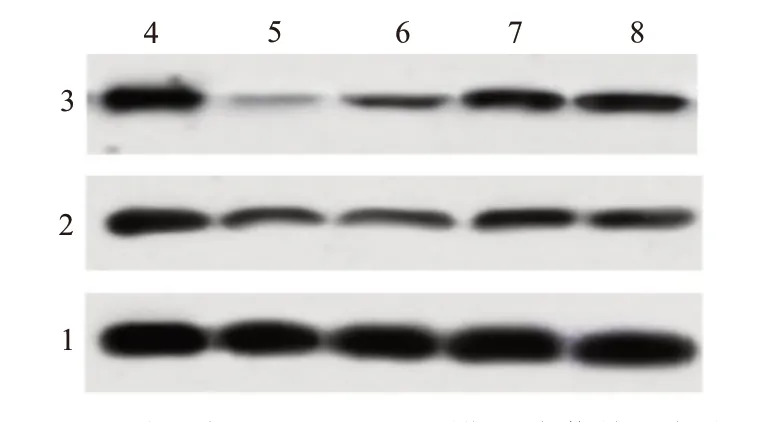
图1 不同浓度 β 榄香烯对脂多糖诱导的肾小管上皮细胞存活
2.2 β 榄香烯抑制脂多糖诱导的肾小管上皮细胞HK-2 凋亡
流式细胞术和蛋白质印迹法结果显示 ,与 NC 组[(4.86±0.62);(0.64±0.05);(0.78±0.08)]相比,脂多糖组(27.34±2.68)的 HK-2 细胞凋亡率升高,促凋亡蛋白 Bax 表达量(0.83±0.08)升高,抗凋亡蛋白 Bcl-2 表达(0.37±0.04)降低(P
<0.001、P
<0.001、P
<0.001);与脂多糖组相比,β榄香烯 2.5 mg∕L+脂多糖组、β 榄香烯 5.0 mg∕L+脂多糖组和 β 榄香烯 10.0 mg∕L+脂多糖组的细胞凋亡率[(25.64±2.89),(23.67±2.24),(18.64±2.08)]和 Bax表 达 量[(0.77±0.06),(0.68±0.06),(0.65±0.06)]逐渐降低 ,Bcl-2 表达量[(0.46±0.04),(0.59±0.07),(0.62±0.07)]逐渐升高(P
=0.043、0.026、0.019;P
=0.005、0.001、0.001;P
=0.001、0.000、0.000),见图2。
图2 不同浓度β榄香烯对脂多糖诱导的肾小管上皮细胞凋亡的影响:A为流式细胞术检测;B为蛋白质印迹法检测
2.3 β 榄香烯促进脂多糖诱导的 HK-2 细胞产生GSH-PX 和 SOD
与NC组[(82.91±6.18),(36.76±2.68)]相比 ,脂多糖组的 HK-2 细胞中 GSH-PX(57.23±3.17)和 SOD(21.13±1.34)水平 降低(P
<0.001、P
=0.003);与 脂 多 糖组相比 ,β 榄香烯 2.5 mg∕L+脂多糖组、β 榄香烯 5.0 mg∕L+脂多糖组和 β 榄香烯 10.0 mg∕L+ 脂多糖组 HK-2 细胞中 GSH-PX[(65.37±2.54),(70.26±4.36),(72.46±3.64)]和 SOD[(25.69±1.67),(27.67±1.65),(28.96±1.85)]水平增高(P
=0.039、0.017、0.009;P
=0.025、0.018、0.012)。2.4 β 榄香烯对脂多糖诱导的肾小管上皮细胞丙二醛和 ROS 的影响
与 NC 组[(1.00±0.06),(1.00±0.09)]相比,脂多糖组的 HK-2 细胞中丙二醛(1.62±0.13)和 ROS(3.34±0.32)水平升高(P
=0.001、P
<0.001);与脂多糖组相比 ,β 榄香烯 2.5 mg∕L+脂多糖组 、β 榄香烯 5.0 mg∕L+脂多糖组 和 β 榄香烯 10.0 mg∕L+ 脂多糖组 HK-2 细胞中丙二醛[(1.43±0.08),(1.35±0.11),(1.31±0.09)]和 ROS[(2.34±0.21),(1.85±0.12),(1.61±0.11)]水平逐渐降低(P
=0.024、0.026、0.012;P
=0.006、0.000、0.000)。2.5 β 榄香烯对脂多糖诱导的肾小管上皮细胞Nrf2/HO-1 信号通路的影响
蛋白质印迹法结果显示 ,与 NC 组[(0.79±0.06),(0.62±0.05)]相比 ,脂多糖组的 HK-2 细胞中 Nrf2(0.33±0.04)和 HO-1(0.27±0.03)表达水平显著降低(P
<0.001、P
<0.001);与脂多糖组相比,β 榄香烯 2.5 mg∕L+脂多糖组、β 榄香烯 5.0 mg∕L+脂多糖组和 β 榄香烯 10.0 mg∕L+脂多糖组 HK-2 细胞中 Nrf2[(0.42±0.04),(0.57±0.06),(0.63±0.06)]和 HO-1[(0.35±0.03),(0.43±0.05),(0.45±0.05)]表达水平逐渐升高(P
=0.018、0.007、0.000;P
=0.033、0.002、0.000),见图3。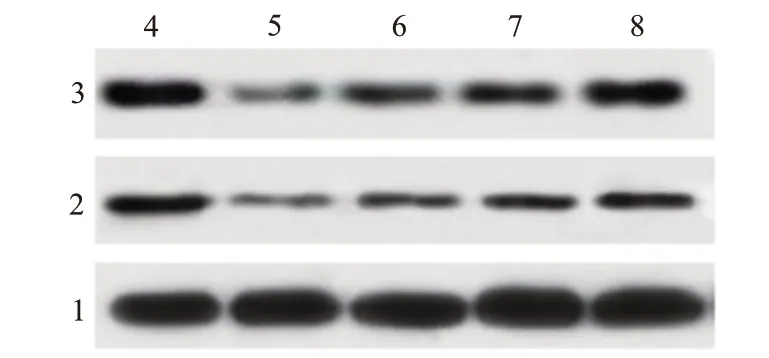
图3 不同浓度 β 榄香烯对脂多糖诱导的肾小管上皮细胞 Nrf2∕HO-1 信号通路的影响
3 讨论
肾小管细胞损伤(包括细胞坏死和凋亡)引起细胞功能紊乱导致肾损伤,慢性进展性肾损伤通常会进展至肾纤维化或肾衰竭。氧化应激产生的活性分子 ROS 或脂质氧化产物丙二醛通常引起细胞凋亡,而氧化应激及其引发的细胞凋亡是多种肾病的致病因素。
脂多糖可导致包括肺、肝和肾等多种细胞产生氧化应激,造成细胞炎症反应引起急性损伤。脂多糖诱导的细胞损伤模型相对简单,也被大多数研究者认可。本研究通过建立肾小管上皮细胞 HK-2 的脂多糖模型,发现脂多糖可抑制 HK-2 细胞存活并诱导细胞凋亡,抑制细胞中 GSH-PX 和 SOD 的表达,促进细胞大量产生丙二醛和 ROS,造成细胞氧化应激损伤。
β 榄香烯是中药温莪术中的一种萜类抗肿瘤活性成分,β-榄香烯可诱导非小细胞肺癌(NSCLC)细胞凋亡和抑制膀胱癌。β 榄香烯(20、40 mg∕L)通过 β - 连环蛋白(β -catenin)的失活下调 Wnt∕β -catenin 信号通路,从而抑制促炎性介质和细胞因子的产生,在脂多糖诱导的炎症中起保护作用。β榄香烯(50 μmol∕L)还可通过减轻血管氧化应激水平和抑制促炎细胞因子的产生,减轻 ApoE-∕-小鼠动脉粥样硬化病变的大小和增强斑块稳定性。β 榄香烯(80、120、160 mg∕L)还可通过抑制结缔组织生长因子(CTGF)和纤维连接蛋白(FN)的表达,抑制转化生长因子-β(TGF-β)诱导的肾小球系膜细胞的纤维化。β 榄香烯对肾小管上皮细胞的影响还不清楚。本研究发现,2.5 mg∕L、5 mg∕L 和 10 mg∕L 的 β榄香烯可以抑制脂多糖诱导的 HK-2 凋亡,提高细胞存活率,减轻脂多糖诱导的 HK-2 细胞氧化应激损伤,以上述研究结果类似,且所需 β 榄香烯的浓度相对低一些。
Nrf2∕HO-1 信号通路是人体内重要的内源性防御体系,在多种组织(心、脑、肝、肾和神经组织)中可被激活,是抗氧化应激损伤的关键因子。当机体进入氧化应激状态时,Nrf2 可诱导 HO-1 过表达,阻止氧化反应、抗炎和抑制细胞凋亡。本研究结果表明,脂多 糖 抑制 HK-2 细 胞中 Nrf2 和 HO-1 的表达 ,抑 制 Nrf2∕HO-1 信号通路 ,而 β 榄香烯可促进Nrf2 和 HO-1 的表达,说明 β 榄香烯可能通过激活Nrf2∕HO-1 信号通路,保护 HK-2 细胞减轻脂多糖诱导的氧化应激损伤。
本研究发现,在脂多糖诱导的 HK-2 中,β 榄香烯可能通过激活 Nrf2∕HO-1 信号通路,抑制细胞凋亡,提高细胞存活率,从而减轻脂多糖诱导的氧化应激损伤。β 榄香烯在肾损伤等肾病中可能具有治疗作用。本研究只进行了体外细胞的研究,后续将根据条件进行动物体内模型试验,进一步确认 β 榄香烯在治疗肾损伤等肾病的临床意义。

