气相色谱-质谱联用法测定植物油料中角鲨烯的含量及方法比较
吕春玲,陈小媚,王秀嫔,李培武,张 奇,张 文
(中国农业科学院油料作物研究所,湖北武汉 430062)
角鲨烯又名鱼鲨烯、鲨烯、三十碳六烯等,化学式为C30H50,是一种高度不饱和脂肪族烃类化合物,角鲨烯最初是从鲨鱼的肝油中发现的,是一种功能性活性脂质不皂化物[1-3]。其生理功能主要包括抗氧化、抗辐射、调节胆固醇代谢、提高体内超氧化物歧化酶活性[4-5]、防癌抗癌、增强机体免疫能力、皮肤保湿、抗衰老[6-7]和抑制微生物生长等。因此,角鲨烯被广泛应用于医药产品、化妆品和功能性食品等相关产品的开发[8]。
食用植物油是人体生长和代谢过程不可缺少的三大基本营养素之一,同时含有丰富的特质营养成分,如甾醇、角鲨烯、生育酚、白藜芦醇等[9-12]。随着农业供给侧结构性改革与质量兴农战略的实施,我国油料生产已从高产量向高质量多用途战略转变,植物油料特异品质检测技术是发掘和利用特异营养品质实现高质量发展的关键,然而植物油料中微量特质营养成分检测灵敏度低、技术匮乏严重制约油料品质提升与产业增效[13-15]。目前发现角鲨烯的替代来源主要以植物为主,油料作物如橄榄、油茶、大豆、花生、芝麻、油菜等种子中含有一定浓度的角鲨烯[16-18]。
目前,角鲨烯的测定方法主要有气相色谱法、气相色谱质谱法、高效液相色谱法、超高效合相色谱以及超高效液相色谱法[19-21],样品的前处理方法可分为传统提取方法和新型提取方法,传统提取方法有皂化法、结晶法以及有机溶剂提取法,新型提取方法包括固相微萃取法、超临界二氧化碳萃取法以及固相萃取法[22-23]。但植物油料中角鲨烯的检测,并未有相关文献记录,因此开发一种植物油料中角鲨烯的检测方法显得尤为重要。由于角鲨烯是一种植脂不皂化物,因此本文采取一种皂化方法先给植物油料的种子样品脱脂,然后用正己烷萃取角鲨烯,用气相质谱联用法从复杂基质中分离出角鲨烯,因为相对其他仪器检测方法气质联用法重现性好、灵敏度高、峰型尖锐干扰少、定量准确[24-26]。本实验结果可应用于植物油料中角鲨烯的日常分析。气质联用法可以降低检测限,提高油料中微量角鲨烯的检测准确性,为植物油料的高质量发展提供技术支撑,为选育高角鲨烯含量的草本油料品种提供方法依据[27]。
1 材料与方法
1.1 材料与仪器
植物油料 购自本地市场(湖北武汉);样品包括花生、大豆、芝麻和油菜籽,用高速研磨机磨成粉末,过60目筛,为防止所取样品变质而影响数据的准确性,样品均避光冷藏保存。角鲨烯(纯度>98%) 色谱纯,德国Dr. Ehrenstorfer公司;正己烷、乙醇 色谱纯,国药集团化学试剂有限公司;氢氧化钾、氯化钠 分析纯,西陇化工股份有限公司。
气相色谱质谱联用仪、色谱柱HP-5 MS(30 m×0.25 mm×0.25 μm) 美国Agilent Technologies公司;Centrifuge-V 型离心机 美国Thermo Scientific公司;Milli-QA10型纯水仪 美国Millipore公司;Tiss-46型均质仪 上海净信科技;Auw220型分析天平 日本Shimadzu公司;DTC-27J 超声波水浴锅 中国湖北鼎泰生化技术设备制造有限公司;BF-2000型氮气吹干仪 北京八方世纪科技有限公司。
1.2 实验方法
1.2.1 标准溶液的配制 角鲨烯标准储备液(1 mg/mL):准确称取0.0100 g角鲨烯标准品于10 mL容量瓶中,用正己烷定容至刻度,混匀冷藏备用;角鲨烯标准中间液(100 mg/L):准确吸取1.00 mL角鲨烯标准储备液于10 mL容量瓶中,用正己烷定容至刻度,混匀冷藏备用;角鲨烯标准工作溶液:分别吸取适量角鲨烯标准中间液,用正己烷稀释,使标准工作溶液浓度分别为0.1、0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0 mg/L。
1.2.2 样品处理 称取已磨碎过筛试样0.20 g放入15 mL离心管中,加入2 mL 2 mol/L的氢氧化钾-乙醇溶液,超声皂化40 min(在75 ℃条件下)后;取出离心管,冷却至室温;加入2 mL水,1 mL正己烷提取,离心管至旋涡均质器中混匀3 min,充分提取;4500 r/min离心3 min,若出现乳化现象,加入1 mL饱和氯化钠溶液破乳,4500 r/min再次离心3 min,转移上清液至尖底玻璃试管中。再用1 mL正己烷重复此提取操作二次,并将三次提取上清液合并至尖底玻璃试管中,置于旋涡混合器中混匀,然后用氮吹仪吹干溶剂,再立即加入1 mL正己烷复溶,4500 r/min离心3 min,经0.22 μm有机相膜过滤后进样。如果样液中角鲨烯浓度超过标准工作曲线线性范围,需将样液用正己烷稀释一定的倍数,使其浓度在线性范围之内。
1.2.3 色谱条件
1.2.3.1 气相色谱参考条件 气相色谱柱:HP-5(30 m×0.32 mm×0.25μm)色谱柱;载气:高纯氮气(纯度99.999%),恒压:16 psi,分流比1∶12;进样口温度:320 ℃;柱温采用程序升温方式,100 ℃保持1 min,以40 ℃/min的速率从100 ℃升温到290 ℃,保持20 min,然后以20 ℃/min的速率升温到320 ℃,保持10 min;最后以40 ℃/min的速率降温到100 ℃,保持1 min。FID检测器:温度320 ℃,气流速200 mL/min,尾吹气流速24 mL/min;进样量:1.0 μL。
1.2.3.2 气相色谱质谱联用法参考条件 色谱柱:HP-5MS(30 m×0.25 mm×0.25μm);升温程序:200 ℃保持1 min,然后以25 ℃/min升温至300 ℃,保持5 min,载气为高纯度氦气,流速1.0 mL/min,进样方式:分流,分流比50∶1,进样体积是1 μL。质谱条件:GC-MS接口温度300 ℃,进样口温度300 ℃,四级杆温度150 ℃,离子源温度230 ℃,电离方式EI源,电离电压70 eV,选择性离子监测(SIM)模式:m/z 69、81、95、137,定量离子为m/z 69,离子相对丰度m/z 69>81>95>137。
1.3 数据处理
使用Origin软件处理分析数据。
2 结果与分析
2.1 样品前处理条件的选择
2.1.1 超声皂化的温度对角鲨烯含量的影响 称取已磨碎过筛试样0.20 g放入15 mL离心管中,加入2 mL 2 mol/L的氢氧化钾-乙醇溶液,分别在60、70、80、90、100 ℃条件下超声皂化30 min后,取出离心管,冷却至室温;加入2 mL水,1 mL正己烷提取三次,将离心管放到旋涡均质器中混匀3 min,充分提取,最后经气相色谱质谱联用法测定角鲨烯的含量,得出不同皂化温度对油菜籽中角鲨烯含量测定的影响,结果见图1。由图1测定的角鲨烯含量随着皂化温度的变化可知,油菜籽中角鲨烯含量随着皂化温度的升高而升高,在80 ℃时达到最大浓度后有下降趋势。当反应温度过高时,会破坏皂化液中的抗氧化成分,从而使得角鲨烯失去保护,导致其含量降低。因此,综合经济等因素选择80 ℃为最佳皂化温度。
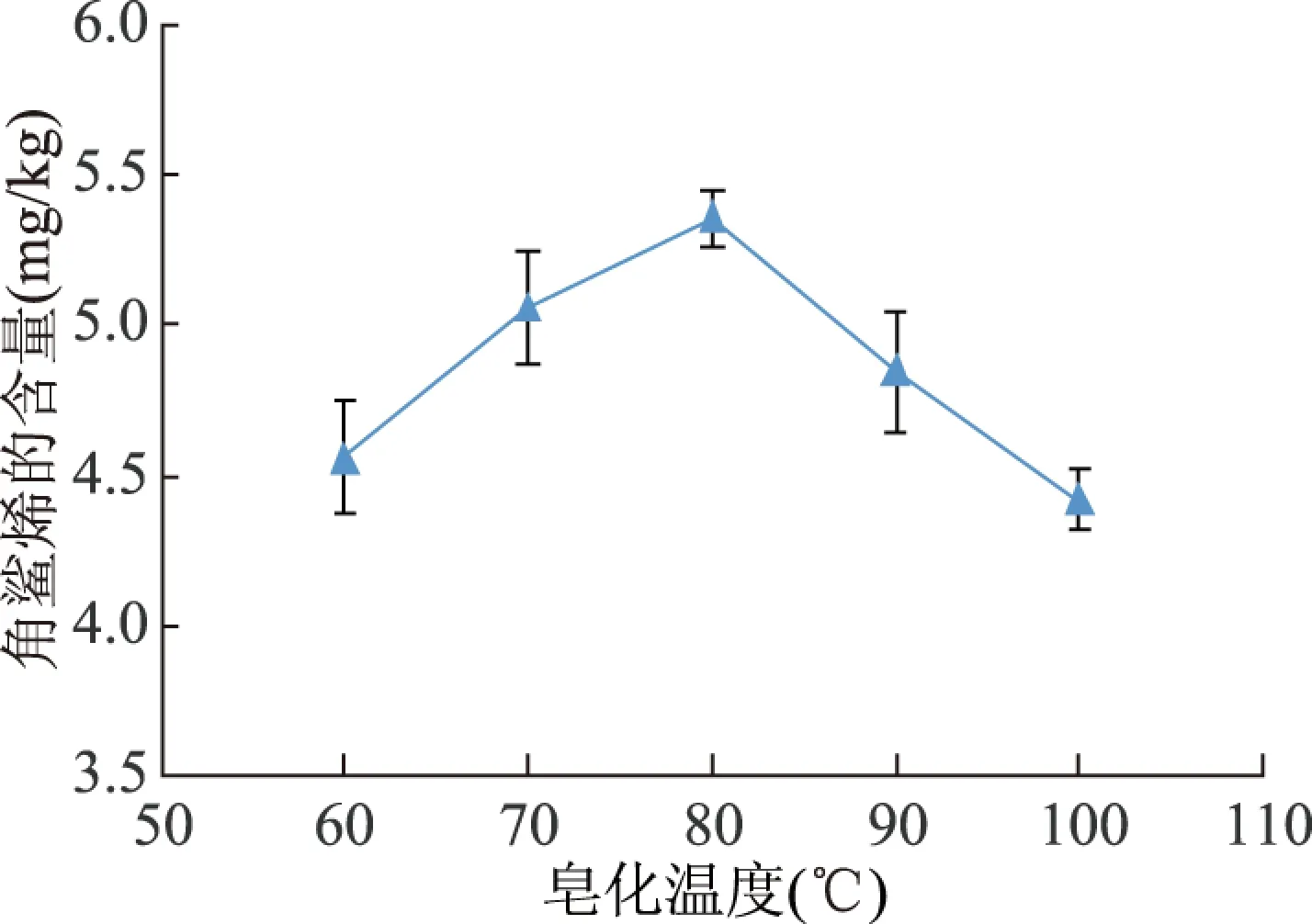
图1 皂化温度对角鲨烯含量的影响Fig.1 Effect of saponification temperature on the content of squalene
2.1.2 超声皂化的时间对角鲨烯含量的影响 称取已磨碎过筛试样0.20 g放入15 mL离心管中,加入2 mL 2 mol/L的氢氧化钾-乙醇溶液,分别在80 ℃条件下超声皂化20、30、40、50、60 min后,取出离心管,冷却至室温;加入2 mL水,1 mL正己烷提取三次,将离心管放到旋涡均质器中混匀3 min,充分提取,最后经气相色谱质谱联用法测定角鲨烯含量,得出不同皂化时间对油菜籽中角鲨烯含量测定的影响,结果见图2。

图2 皂化时间对角鲨烯含量的影响Fig.2 Effect of saponification time on the content of squalene
由图2测定的结果可以看出,随着皂化时间的逐渐延长,角鲨烯的含量先增加后减少,皂化时间为40 min时,角鲨烯的浓度达到最大值,在高温的碱性浓度下,随着时间的延长,角鲨烯的结构遭到破坏,从而其含量有所降低。因此,综合经济等因素选择40 min为最佳皂化时间。
2.1.3 超声皂化的碱液浓度对角鲨烯含量的影响 称取已磨碎过筛试样0.20 g放入15 mL离心管中,分别加入2 mL 1.6、1.8、2.0、2.2、2.4 mol/L的氢氧化钾-乙醇溶液,分别在80 ℃条件下超声皂化30 min后,取出离心管,冷却至室温;加入2 mL水,1 mL正己烷提取三次,将离心管放到旋涡均质器中混匀3 min,充分提取,最后经气相色谱质谱联用法测定角鲨烯含量,得出不同皂化碱液浓度对油菜籽中角鲨烯含量测定的影响,结果见图3。由图3测得的结果可以看出,在碱液浓度低于2.0 mol/L时,由于反应速率较低,体系中角鲨烯的含量比较低,当碱液的浓度达到2.0 mol/L时,反应速率明显增大很多,反应完全,角鲨烯含量上升明显,但当碱液浓度继续增大时,角鲨烯含量减少。因此,最佳碱液浓度为2.0 mol/L。

图3 皂化碱液浓度对角鲨烯含量的影响Fig.3 Effect of KOH-C2H5OH solution concentration on the content of squalene
2.1.4 超声皂化的萃取次数对角鲨烯含量的影响 称取已磨碎过筛试样0.20 g放入15 mL离心管中,分别加入2 mL 2.0 mol/L的氢氧化钾-乙醇溶液,分别在80 ℃条件下超声皂化30 min后,取出离心管,冷却至室温;加入2 mL水,分别用1 mL正己烷萃取1、2、3、4、5次,将离心管放到旋涡均质器中混匀3 min,充分提取,最后经气相色谱质谱法测定角鲨烯含量,得出不同皂化萃取次数对油菜籽中角鲨烯含量测定的影响,结果见图4。由图4测得结果可知,随着皂化萃取次数的增加,油菜籽中角鲨烯含量先增加后减少,因为当正己烷萃取次数少时提取不完全,角鲨烯含量比较少;但当正己烷萃取次数较多时,角鲨烯的浓度反而减少,可能是由于有机试剂萃取过程中的损失,致使角鲨烯含量下降。因此,最佳皂化萃取次数为3次。

图4 皂化萃取次数对角鲨烯含量的影响Fig.4 Effect of saponification extraction times on squalene content
2.2 气相色谱质谱联用法方法学验证结果
2.2.1 角鲨烯的定性与定量离子选择 用标准文库NIST匹配了角鲨烯标准样品的质谱,通过全扫描模式的质谱分析,匹配度为99%,确定了角鲨烯标准物质的主要碎片离子为m/z 69、81、95、137。然后设置选择的离子监测模式。选择离子监测模式对目标进行定量时,通常选择灵敏度高、抗干扰能力强的碎片离子作为目标离子定量。因此角鲨烯的定量离子是m/z 69,定性离子是m/z 81、95、137。角鲨烯在SIM模式下的总离子流图和质谱图见图5和图6。

表1 角鲨烯的线性范围以及检出限Table 1 Linear ranges and limits of detection for squalene
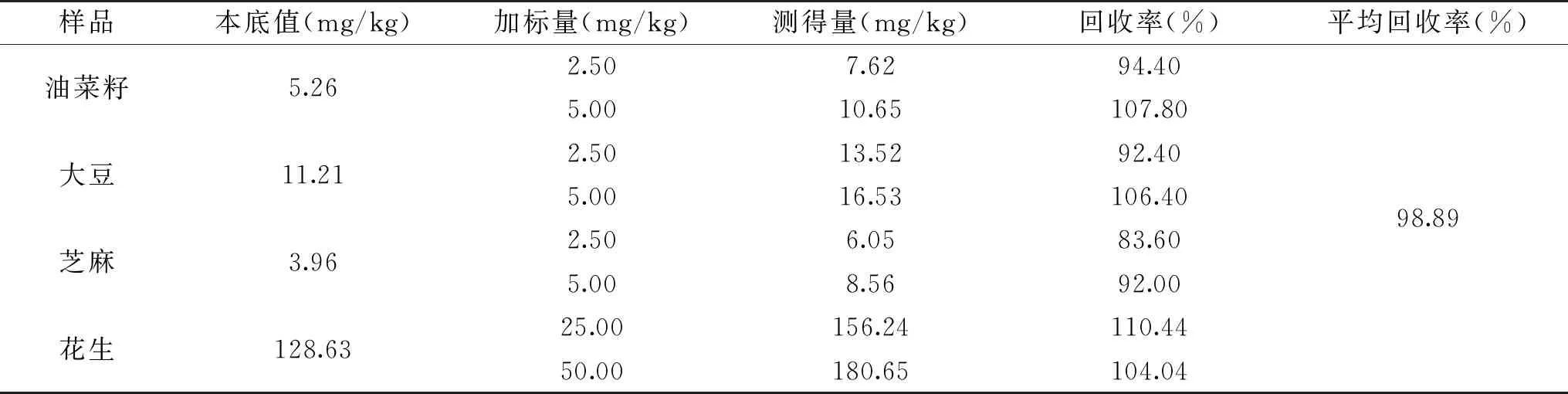
表2 角鲨烯的准确度实验结果Table 2 Accuracy test results of squalene
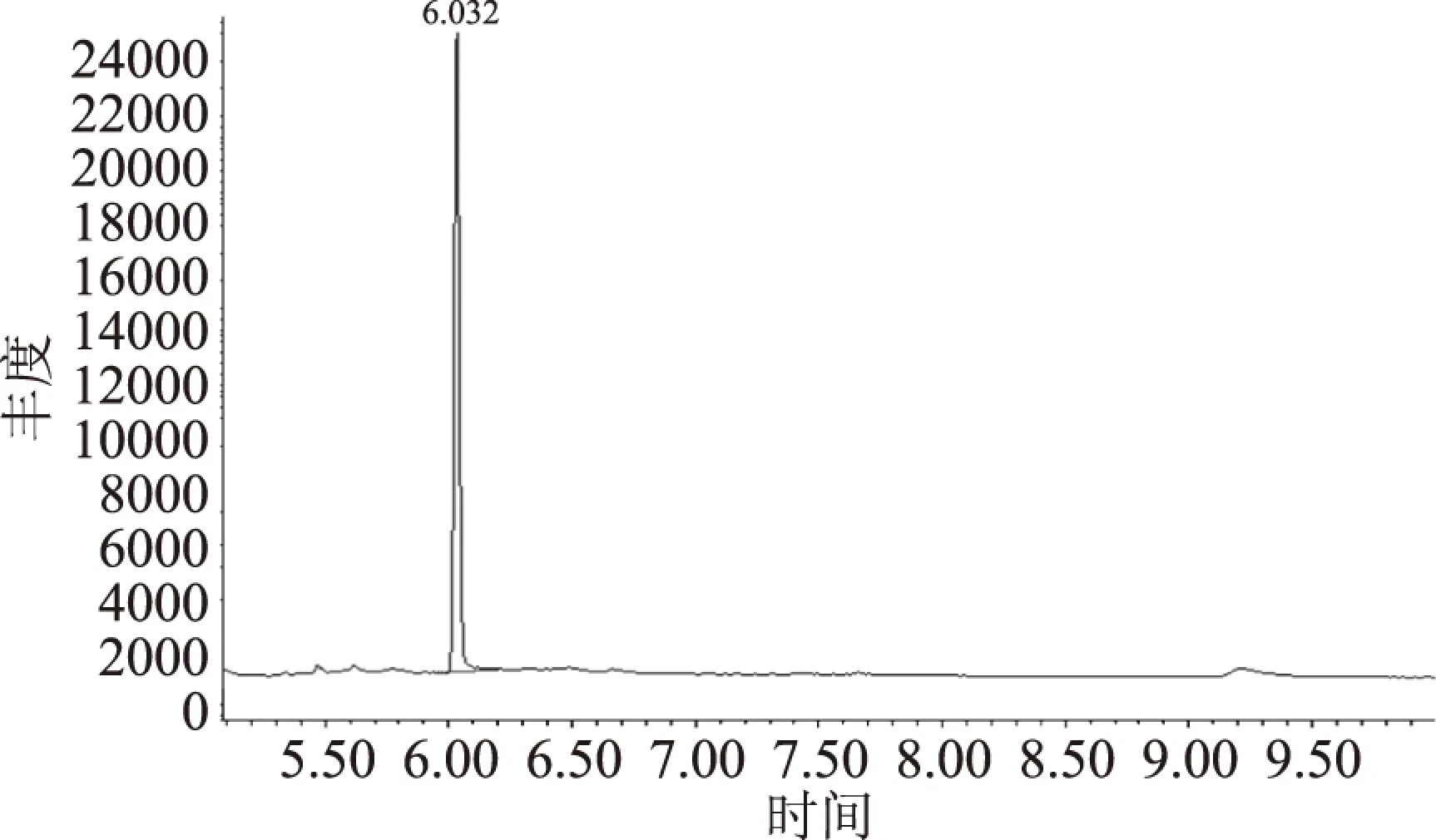
图5 SIM模式下角鲨烯标准品的总离子流图Fig.5 Total ion current diagram of squalene in SIM mode
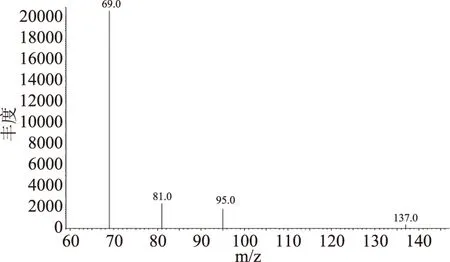
图6 SIM模式下角鲨烯标准品的质谱图Fig.6 Mass spectrum of squalene in SIM mode
2.2.2 线性范围和最低检出限 取1.2.1中的标准储备液,分别稀释成6个浓度梯度,按2.1.1节优化后前处理皂化条件进行测定,并绘制角鲨烯标准品的质量浓度(横坐标x,mg/L)与峰面积(纵坐标y,AU)标准曲线,进行线性回归分析,得到线性回归方程y=14106x-5987,线性相关系数0.9998。且当信噪比(S/N)为3和10时,该方法的最低检出限及定量限如表1所示。结果表明,无论是使用GC还是GC-MS/MS法测定角鲨烯的含量,都具有良好的线性相关性,均能满足对植物油料中的角鲨烯进行检测的要求。
2.2.3 样品准确度和精密度实验结果 在油菜籽、大豆、和芝麻样品中,分别添加 2.50、5.00 mg/kg的角鲨烯标准品,在花生样品中添加25.00、50.00 mg/kg的角鲨烯标准品,前处理方法按2.1.1节优化后的前处理皂化条件进行测定,测定后计算回收率,结果见表2。由表2中的结果可见,四种不同植物油料的加标回收率在83.60%~110.44%之间,平均回收率为98.89%,说明该方法的准确度满足方法学要求,适合植物油料中角鲨烯含量的测定。
对油菜籽、大豆、芝麻和花生样品分别重复测定7次,结果见表3。由表3可知,油菜籽、大豆、芝麻和花生中角鲨烯测定结果的相对标准偏差(RSD)分别为 3.34%、3.35%、2.38%、1.00%,说明该方法具有良好的精密度,重现性好。
2.2.4 气相色谱法和气相色谱质谱法检测结果的比较 为了更好的证明方法的准确性,随机抽取4个植物油料种子,分别用不同的检测方法进行对比试验,按2.1.1节优化的前处理皂化条件进行操作后,按照1.2.3的色谱条件进行测定,结果见表4。
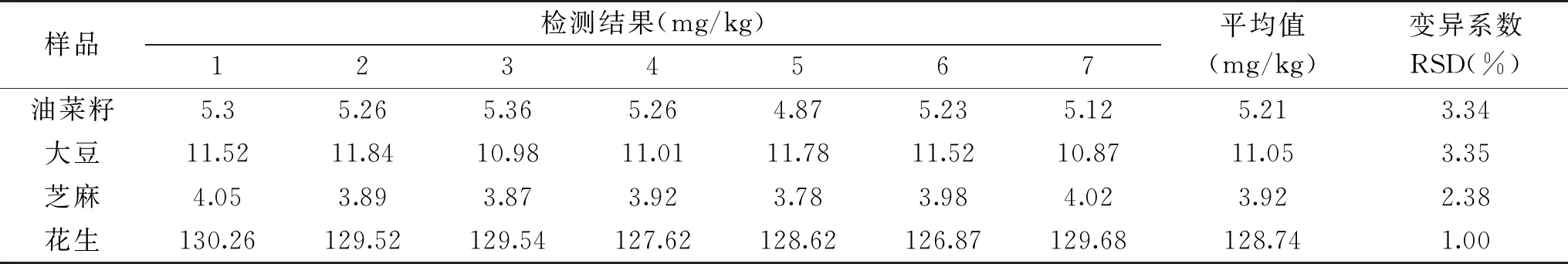
表3 角鲨烯的精密度实验结果Table 3 Precision experiment results of squalene

表4 不同检测方法的比对结果Table 4 Comparison results of different detection methods
由表4可知,GC-MS/MS的检测结果和GC的检测结果相对误差小于10%,两种方法的检测结果基本一致,均能满足检测的要求,检测结果可靠。从已有的相关文献报道得知气相色谱法和气相色谱质谱联用法同样适用于植物油脂和小宗油料样品中角鲨烯的检测。相对于气相色谱法,气相色谱质谱联用法不但检测灵敏度更高,还节约时间成本大大提高检测效率,适合植物油料中角鲨烯含量的测定。
3 结论
综上,本文建立了气相色谱质谱联用法测定植物油料中角鲨烯含量的方法。优化了氢氧化钾乙醇溶液超声皂化的条件:皂化最佳温度80 ℃,皂化最佳反应时间40 min,皂化最佳碱液浓度2.0 mol/L,最佳萃取次数3次。该方法角鲨烯的最低检测限为 0.10 mg/L,相对标准偏差在1.00%~3.35%(n=7),加标回收率在83.60%~110.44%之间,说明该方法重现性好,灵敏度高,定量准确。并用气相色谱质谱联用法和气相色谱法测定了四种不同植物油料中角鲨烯的含量,结果表明,两种方法均能满足检测要求,气相色谱质谱联用法检出限低,分离效率高,定量准确,更适合植物油料中微量角鲨烯含量的测定,并对植物油料的高质量发展具有一定的指导意义。

