沙棘多酚提取纯化工艺研究
吕佳玮,王 颉,刘亚琼,孙剑锋,王文秀,龚 慧,牟建楼
(河北农业大学食品科技学院,河北保定 071000)
沙棘(HippophaerhamnoidesL.)是胡颓子科沙棘属[1],又被称为醋柳、黑刺,我国是世界上沙棘资源蕴藏量最丰富的国家[2],素有“沙棘”王国之称。沙棘为药食同源的植物,沙棘的根、茎、叶、花、果,特别是沙棘果实富含丰富的营养物质和生物活性物质[3],可以广泛应用于食品、医药等领域[3]。据测定沙棘果实含有维生素、脂肪酸、多酚等营养物质[5]。
沙棘中含有黄酮类、多酚类、甾醇类及微量元素等功能活性物质[6],其中多酚类化合物是其主要的功能性成分[6]。目前,沙棘多酚的提取方式主要有超临界流体萃取法和常规溶剂提取法,常规溶剂提取法效率低,耗时长,而超临界流体萃取法则存在设备成本大以及产品回收率低等缺点[8],超声波辅助提取法具有效率高、节省溶剂、时间短、对有效成分影响小等特点[9],被广泛应用于食品中活性成分的提取。虽然越来越多的提取方法被优化,但是多酚粗提物中仍含有大量的蛋白质、糖、酯类等,沙棘多酚纯化的方法有离子沉淀法、大孔树脂吸附法和膜过滤法等,其中膜过滤法存在膜容易受到外界杂质的影响、纯化速度慢等缺点,离子沉淀法存在某些有毒金属离子在产品中有残留、对设备耐腐蚀性较高等缺点,而大孔树脂吸附法具有选择性高、可重复利用等特点,目前已有研究表明用大孔树脂纯化后的多酚纯度以及抗氧化性都有明显提高,但不同的大孔树脂对沙棘多酚的纯化效果也不相同[10-12],所以大孔树脂的选择也是值得关注的问题。
沙棘的营养价值和药用价值极高,但我国对沙棘的研究开发起步较晚,缺少高附加值、精深加工产品,如果能有效利用沙棘中的营养物质,则可以很大程度上推动我国西部地区的发展,创造更高的经济和社会效益。本试验以沙棘冻干粉为主要原料,通过响应面法优化超声辅助溶剂提取工艺参数,并采用大孔树脂对多酚进行纯化,旨在为沙棘的高质化利用奠定一定的理论基础。
1 材料与方法
1.1 材料与仪器
阿勒泰大果沙棘冻干粉 采自新疆维吾尔自治区阿泰勒地区;无水乙醇、福林酚、碳酸钠、没食子酸标品 天津天利化学试剂有限公司,分析纯;2,2-联苯基-1-苦基肼基(DPPH)、2,2-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 广州伟伯科技有限公司,分析纯;D101大孔树脂(非极性)、AB-8大孔树脂(弱极性)、NKA-9大孔树脂(极性) 东鸿化工有限公司。
ID5002C型电子天平 天津天马横基仪器有限公司;TU-1810型紫外可见分光光度计 北京普析通用仪器有限公司;15R型高速冷冻离心机 力康生物医疗科技控股有限公司;RHCX-100W型超声清洗机 济宁荣汇超声波设备有限公司;SHB-Ⅲ型循环水式多用真空泵 郑州世纪双科试验仪器有限公司;RE-52C型旋转蒸发器 上海精密仪器仪表有限公司;DHG-9146A型电热恒温鼓风干燥箱 广东精华智能装备有限公司;Multiskan FC全自动酶标仪 济南铭倍医疗器械有限公司。
1.2 实验方法
1.2.1 沙棘多酚提取 准确称取1 g沙棘冻干粉,置于100 mL锥形瓶中,按照试验设计加入一定浓度的乙醇溶液,混合均匀后,在300 W功率和一定温度的超声辅助下提取一定时间,将得到的粗提液在5000 r/min下离心10 min,得到沙棘多酚提取液[13]。
1.2.2 单因素实验 在乙醇浓度为50%,超声时间为50 min,超声温度为50 ℃,考察料液比为1∶10、1∶20、1∶30、1∶40、1∶50 (g/mL)对沙棘多酚提取量的影响;在料液比为1∶20 g/mL,超声时间为50 min,超声温度为50 ℃时,考察乙醇溶液浓度为20%、30%、40%、50%、60%、70%、80%对沙棘多酚提取量的影响;在料液比为1∶20 g/mL,乙醇浓度为50%,超声温度为50 ℃时,考察超声时间为20、30、40、50、60 min对沙棘多酚提取量的影响;在料液比为1∶20 g/mL,乙醇浓度为50%,超声时间为50 min时,考察超声温度为30、40、50、60、70 ℃对沙棘多酚提取量的影响。
1.2.3 沙棘多酚提取条件优化 在单因素实验础上,选择料液比、乙醇浓度、超声时间和超声温度四个因素,多酚提取量为指标,进行Box-Behnken响应面试验,优化提取参数,响应面试验因素水平表见表1。
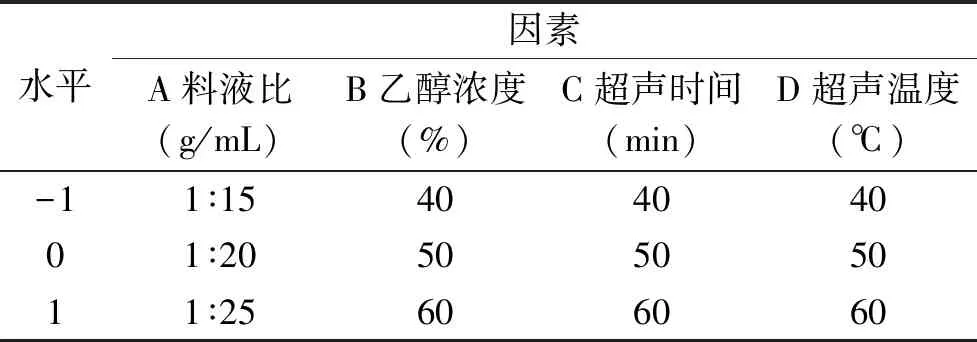
表1 响应面试验因素水平表Table 1 Factors and levelsTable of response surface experiment
1.2.4 没食子酸标曲绘制 参照苏海兰等[14]的方法,用移液枪移取没食子酸工作液(10、20、40、60、80 μg·mL-1)、去离子水各1.0 mL加入到10 mL容量瓶中,再分别在容量瓶中加入1.0 mL的10%福林酚试剂,摇匀,反应5 min,之后再分别在容量瓶中加入2.0 mL 7.5% Na2CO3溶液,加去离子水定容至刻度,放在室温下反应60 min,在765 nm波长下测定吸光度(A)。以没食子酸浓度(C)为横坐标,吸光度(A)为纵坐标,作没食子酸标准曲线,得回归方程为Y=0.7547X+0.0396(R2=0.9972),表明没食子酸在0.01~0.08 μg/mL呈良好线性关系。
1.2.5 沙棘多酚提取量测定 用1.2.1中得到的沙棘提取液代替没食子酸工作液,测定吸光值,代入标准曲线中,按照下式计算多酚提取量。
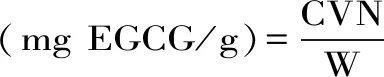
式(1)
其中:C为待测液中多酚浓度(μg/mL),V为提取液的体积(mL),N为稀释倍数,W为称取沙棘冻干粉的质量(g),EGCG为没食子酸当量。
1.2.6 沙棘多酚的纯化
1.2.6.1 大孔树脂预处理 参照何婷等[15]的方法,用95%乙醇溶液浸泡24 h,再用1 mol/L HCl溶液浸泡8 h,用去离子水冲洗大孔树脂,再用1 mol/L NaOH溶液浸泡8 h,用去离子水冲洗树脂。
1.2.6.2 大孔树脂选择 参照杨美莲等[16]的方法,采用静态吸附-解析方法选择合适的大孔树脂,准确称取1 g处理好的大孔树脂,置于100 mL容量瓶中,20 mL加入0.6 mg/mL沙棘多酚粗提液放置于25 ℃下振荡24 h,并通过下式计算吸附率(2)。
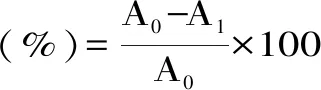
式(2)
将1.2.6.2中吸附完全的大孔树脂洗净滤干,加入20 mL 50%乙醇溶液,放置于25 ℃下振荡24 h进行解析,并通过下式计算解析率(3)。
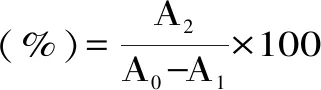
式(3)
其中:A0为吸附前吸光度,A1为吸附后吸光度,A2为解析后吸光度[17]。
1.2.7 沙棘多酚体外抗氧化性测定 利用选择的树脂对沙棘多酚进行纯化,将纯化前后的沙棘多酚进行旋转蒸发,以除去乙醇,然后进行冷冻干燥,测定纯化前后沙棘多酚对DPPD自由基清除率和ABTS+·清除率。
1.2.7.1 纯化前后沙棘多酚对DPPD自由基清除率的测定[18]准确吸取200 μL 0.1 mmol/L的DPPH溶液置于96孔板中,分别加入100 μL不同稀释倍数的沙棘多酚样液(50、100、200、500、1000 μg/mL),充分混合均匀后,避光反应30 min,在517 nm下测定吸光度值A1,相同的方法测定100 μL不同浓度的样液和200 μL无水乙醇的吸光度值A2以及测定200 μL DPPH溶液和100 μL无水乙醇的吸光度值A3,按照公式(4)计算DPPH自由基清除率。
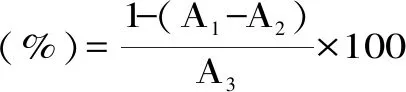
式(4)
1.2.7.2 纯化前后沙棘多酚对ABTS+·清除率的测定[18]ABTS工作液配制:配制7.4 mmol/L的ABTS溶液和2.6 mmol/L过硫酸钾溶液,然后将两种溶液等体积混合,并使其在黑暗中反应14 h后,在734 nm处调整吸光度A约为0.7。
准确吸取250 μL ABTS工作液置于96孔板中,分别加入50 μL不同稀释倍数的沙棘多酚样液(10、20、50、100、200 μg/mL),充分混合均匀后,避光反应60 min,在743 nm下测定吸光度值Ai,相同的方法测定50 μL不同浓度的样液和250 μL无水乙醇的吸光度值Aj以及测定250 μL BTS工作液和50 μL无水乙醇的吸光度值A0,按照公式(5)计算ABTS+·清除率。
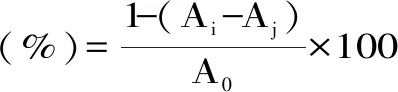
式(5)
1.3 数据统计
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对多酚提取量的影响 料液比对多酚提取量的影响如图1所示,多酚的提取量随着料液比的增加呈现先上升后保持稳定的趋势,料液比为1∶20 g/mL多酚提取量最大,达到8.13 EGCGmg/g。料液比在1∶10~1∶20之间时沙棘多酚的提取量差异性显著(P<0.05),可能是因为溶剂的增加提高了多酚物质与溶剂的浓度差,从而使提取的多酚提取量上升,料液比1∶20~1∶30之间,多酚的提取量差异不显著,可能是因为多酚的溶出量达到了最大[20-21],在实际生产中,料液比的高低和生产效益密切相关,乙醇用量越大,相对效益减少,因此,为尽量减少生产成本,1∶20 g/mL为较适宜的料液比。
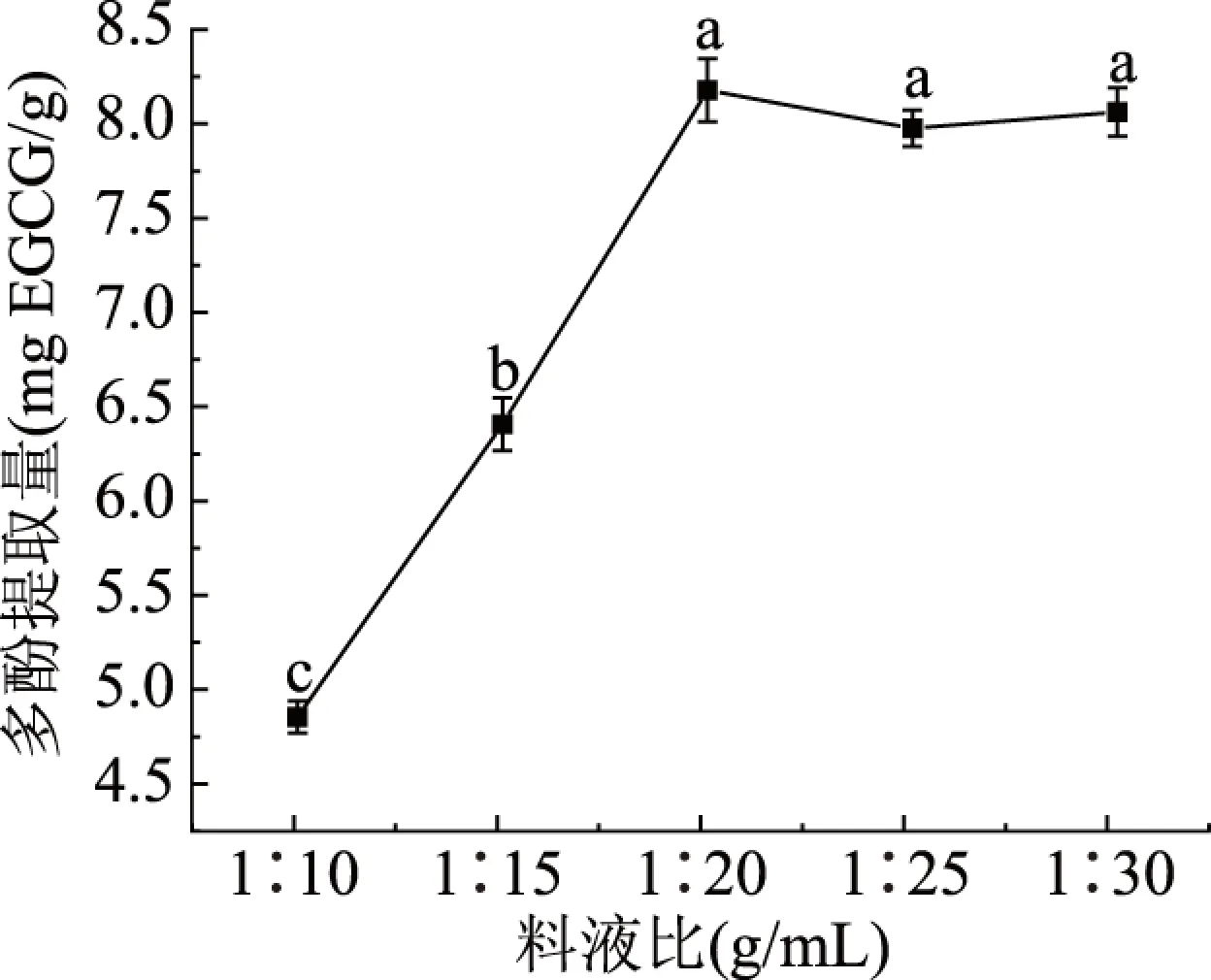
图1 不同料液比对多酚提取量的影响Fig.1 Effect of different feed-liquid ratio on polyphenol extraction注:不同小写字母表示在0.05水平上差异显著;图2~图4同。
2.1.2 乙醇浓度对多酚提取量的影响 乙醇浓度对多酚提取量的影响如图2所示,多酚提取量随着乙醇浓度的增加呈现先上升后下降的趋势,乙醇浓度为50%时沙棘多酚的提取量达到最大,达到8.80 mgEGCG/g。50%的乙醇浓度与其他浓度相比存在显著性差异(P<0.05),40%和60%差异不显著,当乙醇浓度增大时,溶剂的极性降低,更容易破坏植物体内多酚类物质与多糖、蛋白质等物质间的氢键,促使多酚类物质的溶出增加,继续增加乙醇浓度时,溶剂极性较弱,增加了沙棘中的其他醇溶性物质与多酚的竞争性溶出[22],从而使多酚的提取量下降,所以50%为较合适的乙醇浓度。
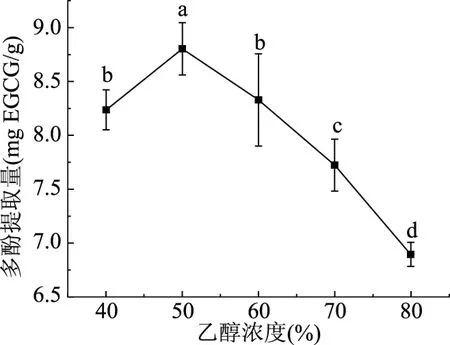
图2 不同乙醇浓度对提取多酚提取量的影响Fig.2 Effect of different ethanol concentrations on polyphenol extraction
2.1.3 超声时间对多酚提取量的影响 超声时间对多酚提取量的影响如图3可示,沙棘多酚的提取量随着超声时间的增加呈现先增加后不变的趋势,超声时间为50 min时,多酚提取量达到最大,为8.46 mgEGCG/g。50 min的超声时间与其他超声时间(20~40 min)相比存在显著性差异(P<0.05),50和60 min之间没有显著性差异,由于时间的增加,导致其他的物质的溶出,从而抑制多酚的溶出,从而使多酚的提取量不变,所以50 min为较合适的超声时间。
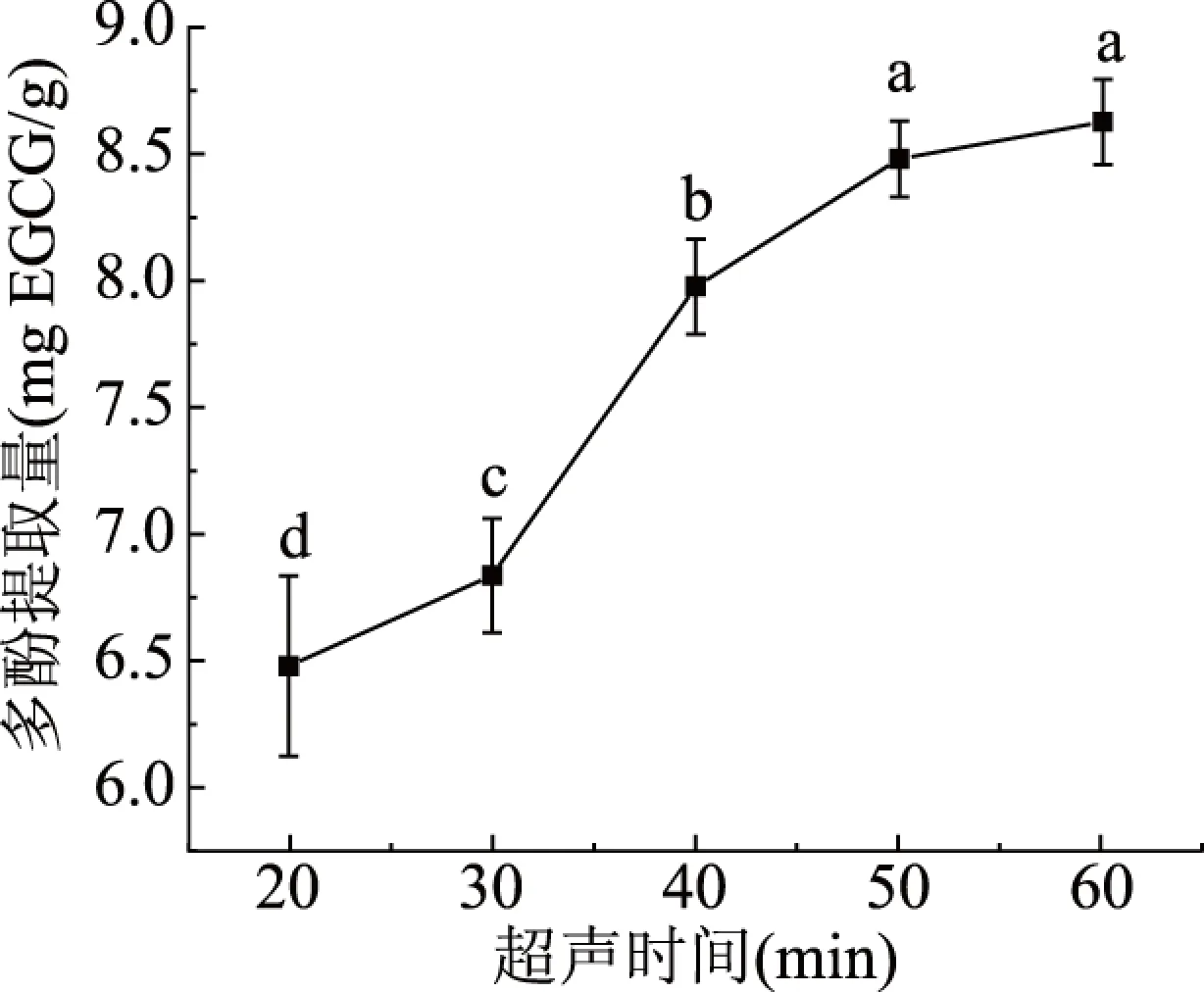
图3 不同超声时间对多酚提取量的影响Fig.3 Effect of different ultrasonic time on the extraction of polyphenols
2.1.4 超声温度对多酚提取量的影响 超声温度对多酚提取量的影响如图4所示,多酚的提取量随着超声温度的增加呈现先增加后不变的趋势,超声温度在50 ℃时,多酚的提取量达到8.53 mgEGCG/g。50 ℃的超声温度与60和70 ℃之间没有显著性差异,与其他温度之间有显著性差异(P<0.05),这是可能是由于随着温度的升高,沙棘粉的颗粒运动加快,有利于沙棘多酚的溶出,当温度过高时,沙棘多酚被分解,而且有利于油溶性物质溶出[23],与多酚产生竞争,从而影响了多酚的提取量,所以50 ℃为较合适的超声温度。
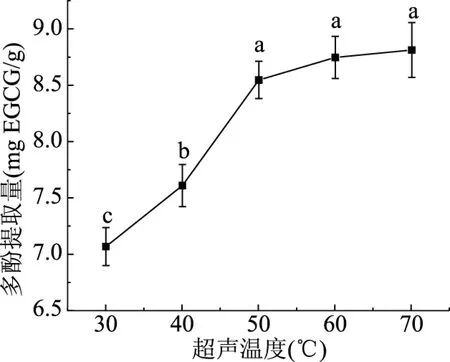
图4 不同超声温度对多酚提取量的影响Fig.4 Effect of different ultrasonic temperatures on polyphenol extraction
2.2 响应面优化沙棘多酚提取试验结果
2.2.1 回归模型的建立与分析 在单因素实验的基础上,进行响应面试验,试验方案及结果如表2所示。以多酚含量(y)为响应值,建立与自变量料液比(A)、乙醇浓度(B)、超声时间(C)、超声温度(D)的四因素回归模型,通过Design-Expert 8.0软件对试验结果进行分析,得到的多元二次回归方程分别为:y=8.80+0.18A-0.097B+0.069C-0.015D-8.490E-003AB+0.018AC-0.26AD-0.032BC-6.569E-003BD-0.039CD-0.69A2-0.41B2-0.31C2-0.52D2。
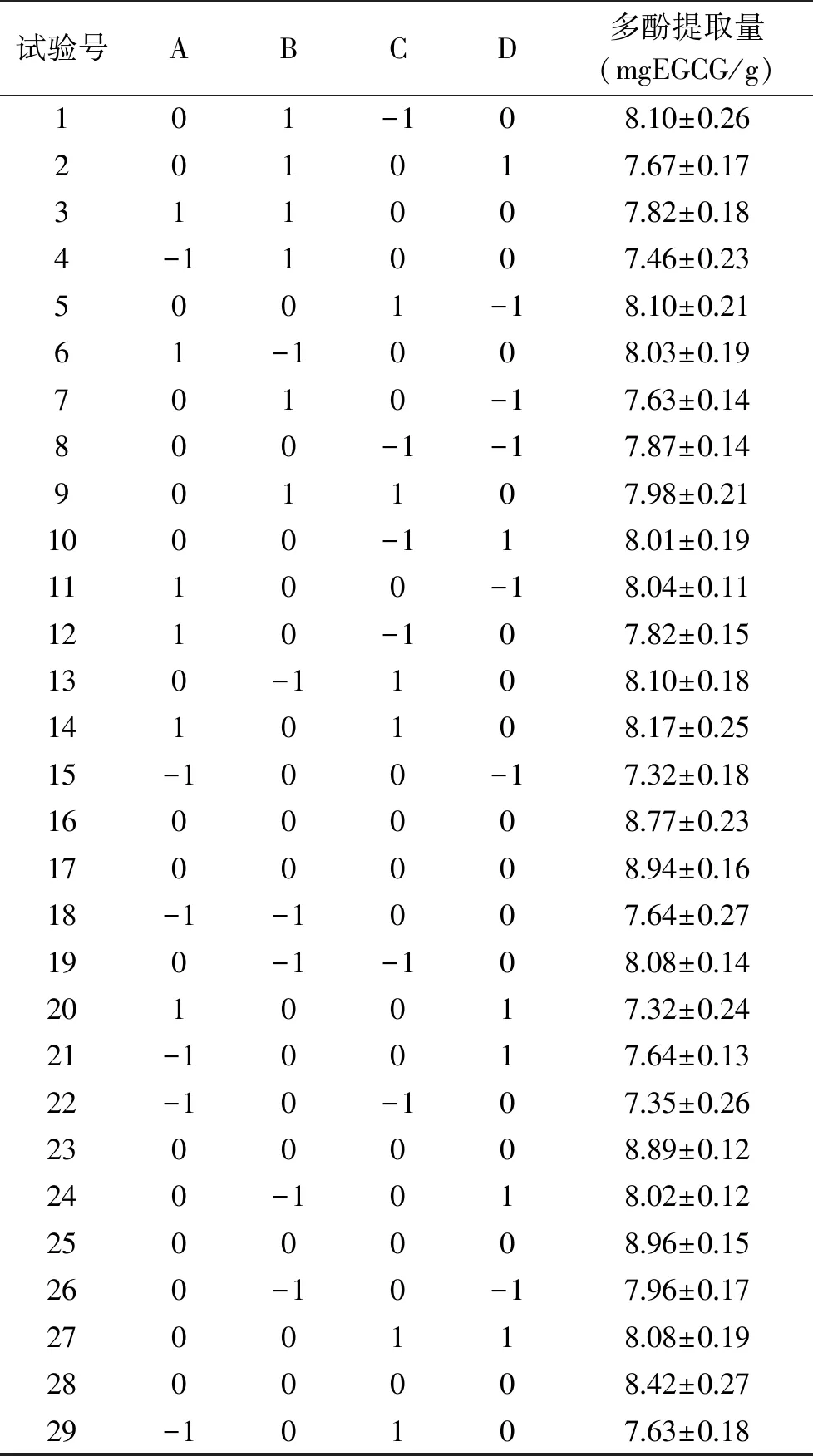
表2 响应面试验方案及结果Table 2 Response surface test design and results
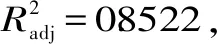
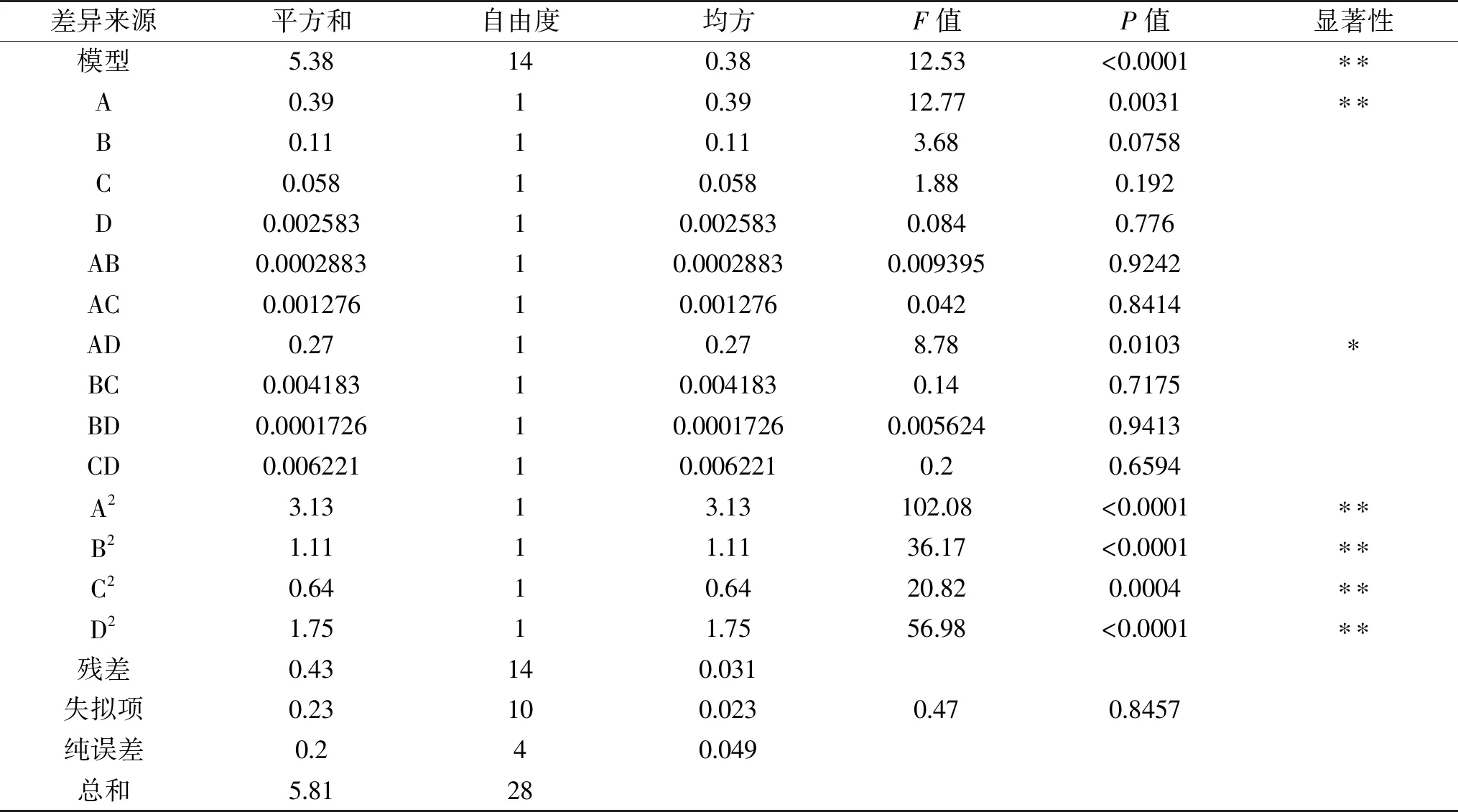
表3 响应面模型方差分析结果Table 3 Response surface model analysis of variance
2.2.2 响应交互作用图及等高线分析 利用Design-Expert 8.0.6软件对回归模型进行响应面优化,得到料液比、乙醇浓度、超声时间和超声温度四个因素交互影响对沙棘多酚提取的响应曲面图和等高线图。运用响应面回归方程模型和各因素交互作用三维曲面图进行分析[23]。
料液比、乙醇浓度、超声时间和超声温度对响应值多酚提取量的影响如图5所示,等高线的趋势和形状可以代表各因素间交互作用的强弱,等高线偏向椭圆代表二者交互作用显著,圆形则代表交互作用不显著。在图中可以看出,料液比与超声温度交互作用对多酚提取量的影响显著,其它因素交互作用对多酚提取量的影响不显著,这与方差分析结果一致。
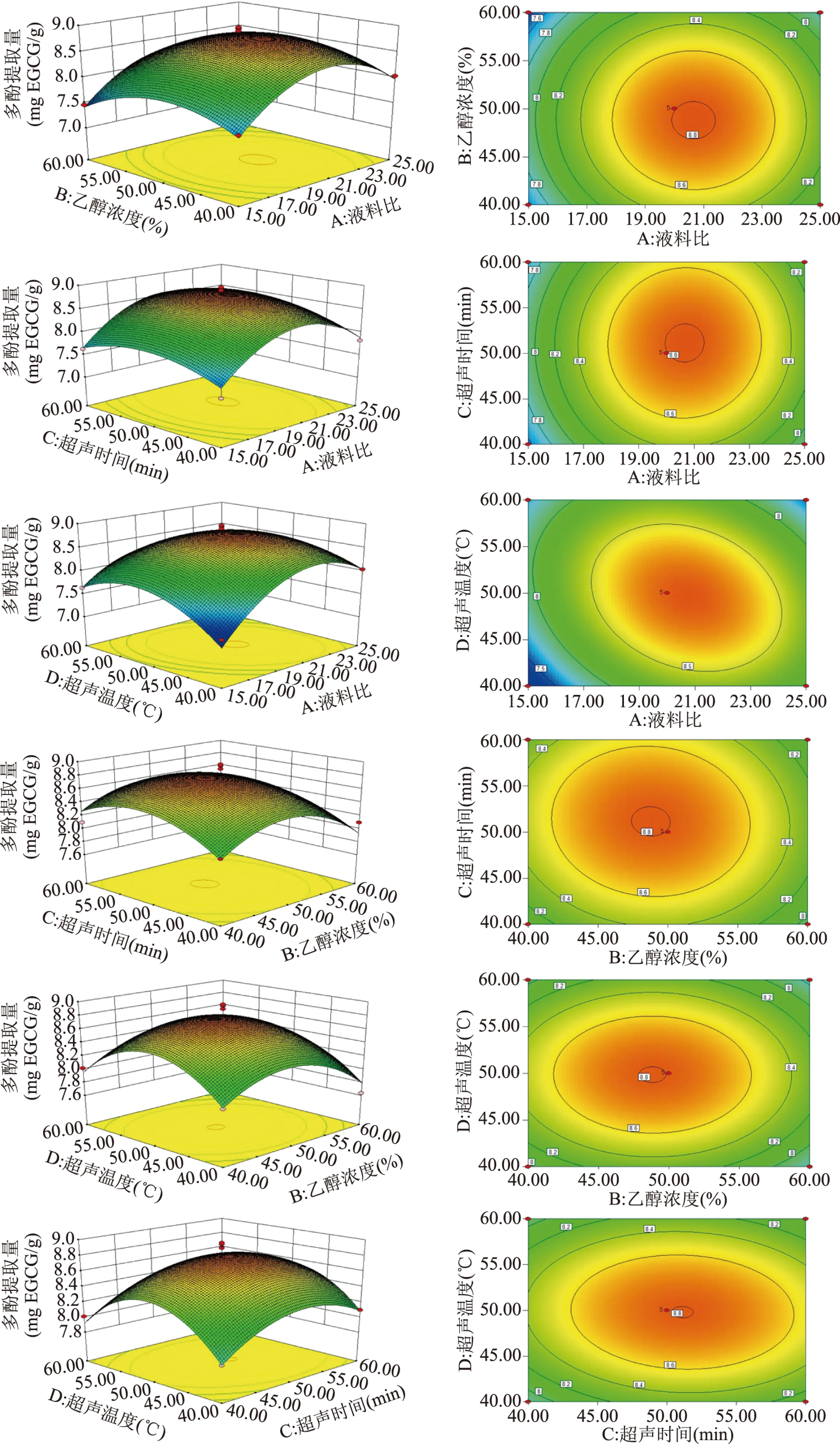
图5 料液比、乙醇浓度、超声时间和超声温度对响应值多酚提取量的影响Fig.5 Effect of material-liquid ratio,ethanol concentration,ultrasonic time and ultrasonic temperature on response polyphenol content
2.2.3 回归模型验证 根据回归模型预测最佳发酵工艺参数为:料液比为1∶23.56 g/mL,乙醇浓度为48.71%,超声时间为51.50 min,超声温度为48.02 ℃,在此条件下响应值最大,预测值为(8.61±0.25) EGCGmg/g,考虑到实际生产的操作性,将提取工艺参数修正为料液比为1∶24 g/mL,乙醇浓度为49%,超声时间为52 min,超声温度为48 ℃,为验证该模型的预测是否正确,在修正后的参数下进行3次试验,得到的多酚提取量为(8.60±0.14) EGCGmg/g,与预测值接近,表明该模型有效。
2.3 沙棘多酚的纯化
2.3.1 大孔树脂的筛选 如表4所示,AB-8、D101和NAK-9的吸附率有显著差异(P<0.05),其中AB-8的吸附率最高,D101的解析率最高,综合吸附率和解析率来看,选择AB-8为纯化沙棘多酚的合适的树脂。

表4 不同大孔树脂对多酚吸附率和解析率的影响Table 4 Effect of different macroporous resins on polyphenol adsorption and resolution
2.3.2 纯化前后多酚含量 沙棘多酚纯化前后多酚含量如图6所示,纯化后的多酚含量显著高于未纯化的多酚(P<0.05),纯化前多酚含量为(36.07±2.61) mgEGCG/g,纯化后为(62.40±3.20) mgEGCG/g,经过纯化后的沙棘多酚含量增加了41.20%。
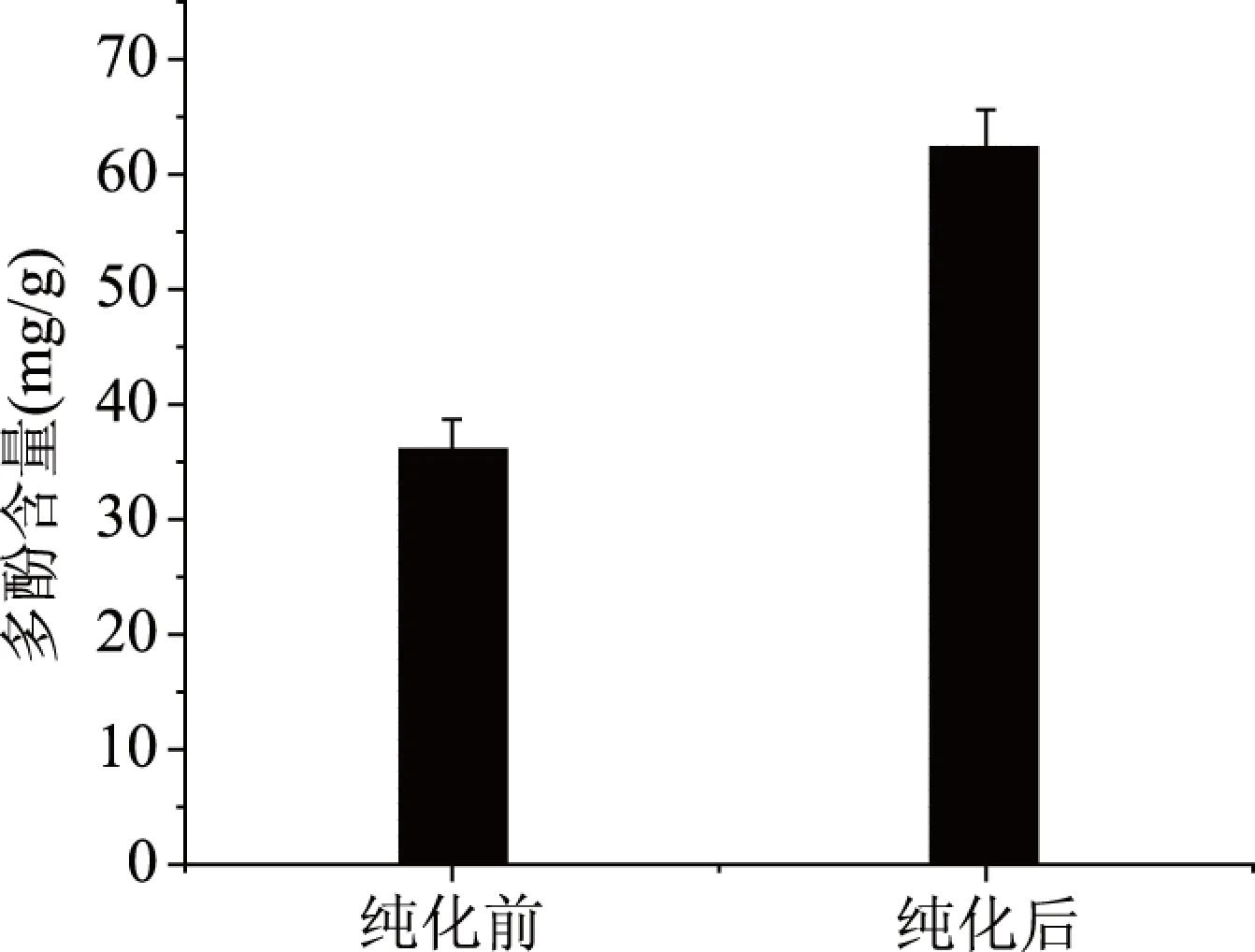
图6 沙棘多酚纯化对沙棘含量的影响Fig.6 Effects of seabuckthorn polyphenol purification on seabuckthorn content
2.4 沙棘多酚抗氧化活性分析
2.4.1 DPPH自由基清除效果 沙棘多酚纯化前后对DPPH自由基清除效果如图7所示,在试验浓度内,随着沙棘多酚浓度的增加,DPPH自由基的清除率不断增加,当多酚浓度为500 μg/mL时,纯化后的多酚清除率达到了92.24%±1.39%,而纯化前的多酚的清除率为43.46%±0.98%,纯化前后沙棘多酚清除DPPH自由基的IC50值分别为(713.22±5.92)、(142.53±3.65) μg/mL,经过纯化后的沙棘多酚的DPPH自由基清除率显著高于纯化前(P<0.05),所以纯化后的沙棘多酚有较强的DPPH自由基清除率。
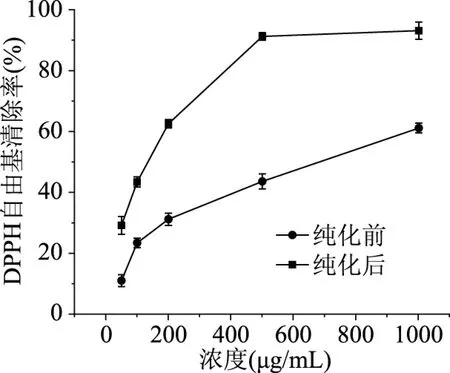
图7 沙棘多酚纯化前后对DPPH自由基清除曲线Fig.7 Scavenging curve of DPPH free radicals before and after seabuckthorn polyphenol purification
2.4.2 ABTS+·清除效果 沙棘多酚纯化前后对ABTS+自由基清除效果如图8所示,在试验浓度内,随着沙棘多酚浓度的增加,ABTS+·的清除率不断增加,当多酚浓度为200 μg/mL时,纯化后的清除率达到了94.05%±1.98%,而纯化前的多酚的清除率为66.67%±1.39%,纯化前后沙棘多酚清除ABTS+·的IC50值分别为(61.92±0.29)、(8.68±1.03) μg/mL,经过纯化后的沙棘多酚的ABTS+·清除率显著高于纯化前(P<0.05),所以纯化后的沙棘多酚有较强的ABTS+·清除率,可能由于大孔树脂对沙棘多酚起到了富集的作用[25-26],也可能由于多酚的纯度的提高增加了沙棘多酚的抗氧化能力[27],也还与酚羟基的数量和所在的位置有很大的关系[28]。
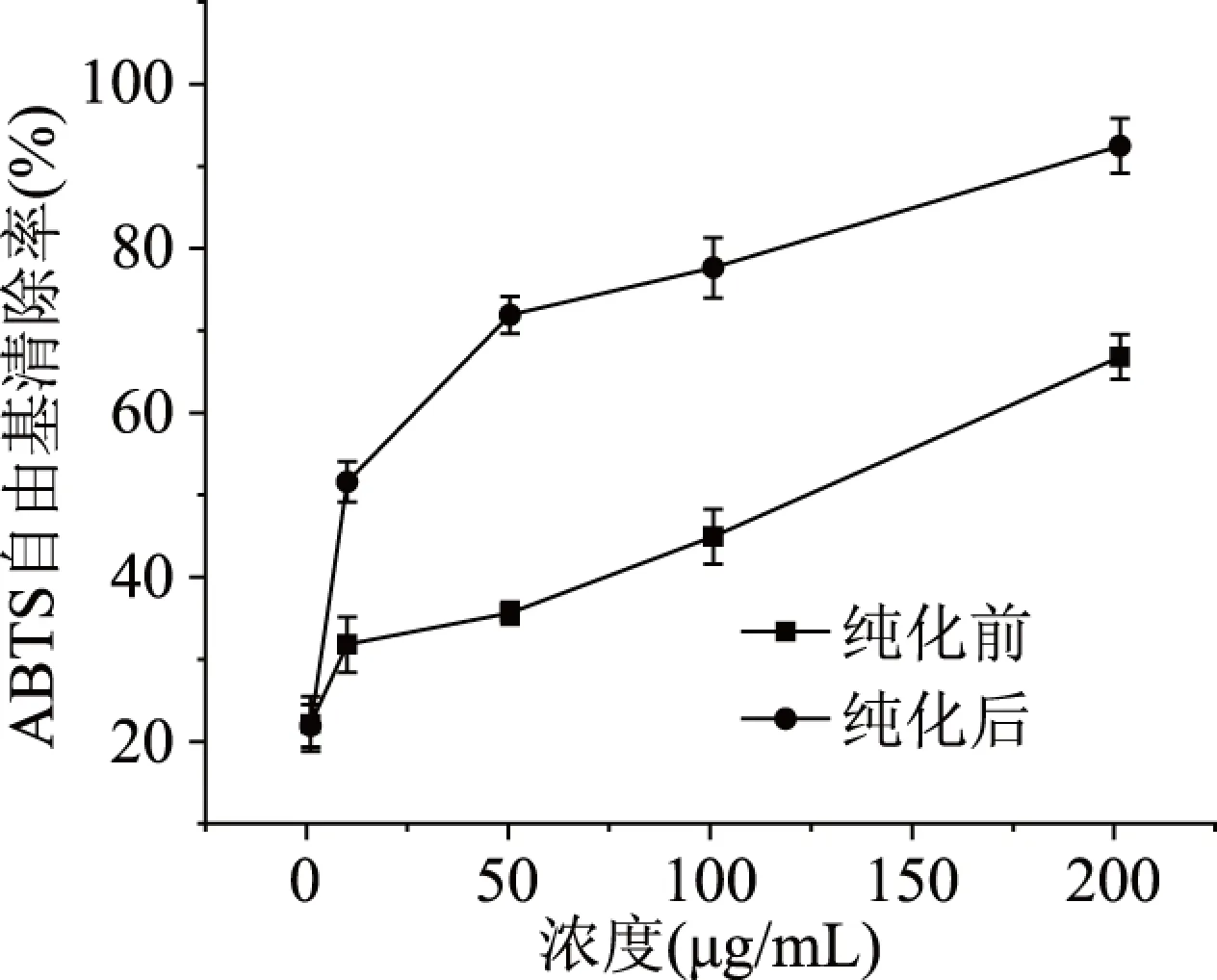
图8 沙棘多酚纯化前后对ABTS自由基清除曲线Fig.8 ABTS free radical scavenging curve before and after seabuckthorn polyphenol purification
3 结论
用响应面法考察了超声辅助溶剂提取法中料液比、乙醇浓度、超声时间、超声温度对沙棘多酚提取量的影响,确定了最佳工艺参数:料液比为1∶24 g/mL,乙醇浓度为49%,超声时间为52 min,超声温度为48 ℃,此条件下沙棘多酚的提取量为8.60 mgEGCG/g,并通过筛选得到AB-8为沙棘多酚合适的纯化树脂,纯化后的多酚含量提高了41.20%,纯化前清除DPPH·和ABTS+·的IC50值分别为713.22、61.92 μg/mL,纯化后清除DPPH·和ABTS+·的IC50值分别为142.53、8.68 μg/mL,经过纯化后的沙棘多酚抗氧化性明显升高。利用超声辅助法提取沙棘多酚,提高了提取效率,同时节约了成本,经过大孔纯化后的沙棘多酚中多酚的含量和抗氧化性有了明显的升高,但对于沙棘多酚的组成有待进一步研究。以上研究内容为沙棘多酚进一步的研究与开发奠定了基础。

