腹腔镜Miles术后行盆底关闭的临床效果观察
王昕,黄平,吴作友,倪春华,戴青松,张伟伟,陈启,翁和语,周备胜,栾海飞,夏文豪,洪勇智,王少杰
南京医科大学附属逸夫医院肛肠外科 江苏南京210000
在我国,直肠癌发病率在恶性肿瘤中居第三位,病死率居第五位[1],其中中低位直肠癌约占直肠癌的70%[2]。根治性手术切除是目前治疗直肠癌的重要手段。近年来保肛手术的发展给低位直肠癌患者带来福音,但保肛手术的实施条件较为严苛,对于肿瘤分期较晚(T3、T4)、肿瘤侵犯范围广、肿瘤与肛缘距离近或者已侵犯肛门外括约肌、肛提肌等情况,腹会阴联合切除术(Miles术)仍是无保肛指征的直肠癌患者的经典术式[3-4]。切除直肠及肛管后形成了骨性结构围绕的空腔,容易形成积血、积液,导致切口感染、会阴部窦道、盆腔脓肿等发生,所以在开放Miles术后关闭盆底腹膜为常规步骤[5-6]。
在腹腔镜操作中,前述步骤对主刀技术要求较高,且术中情况变化多样,若术者经验不足则常导致中转开腹,对患者造成不必要的损伤,而在操作空间相对狭小的盆腔使用腹腔镜缝合打结较为费时费力,因此大部分腹腔镜Miles术后并不关闭盆底腹膜[7]。但是盆底开放使骶前腔隙与游离腹腔相通,容易造成盆底疝、腹内疝、粘连性肠梗阻及盆腔感染等并发症,若患者术后需行放疗还会因小肠坠入盆腔引起放射性小肠炎。此外,在腹腔镜下直接缝合需要注意腹膜的张力,不可强制缝合,否则术后腹膜撕裂将导致小肠内疝发生,且直接缝合也并非适合所有患者,对于肥胖、术前行新辅助放疗导致腹膜纤维化、肿瘤已经侵犯盆底的患者均不适用此法。1996年,希腊学者Voros等[8]报道使用小肠系膜平铺于骨盆入口以减少恶性肿瘤术后残存骶前空腔所导致的肠梗阻发生。本研究回顾性分析于我科接受腹腔镜Miles术的55例低位直肠癌患者资料,旨在分析Miles术后行盆底关闭的治疗效果,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年6月至2020年1月于我科收治并接受腹腔镜Miles术的55例低位直肠癌患者资料,其中男性32例(58.2%)、女性23例(41.8%);年龄35~85岁;肿瘤临床TNM分期:Ⅰ~Ⅱ期16例(29.1%),Ⅲ~Ⅳ期39例(70.9%);肿瘤下缘距肛缘距离2.0~4.5 cm。按照不同的处理方式分为三组:A组(采用小肠系膜行盆底关闭,n=15),B组(直接行盆底腹膜缝合,n=20),C组(不关闭盆底腹膜,n=20)。三组一般资料比较差异均无统计学意义(均P>0.05),见表1。所有患者术前均对治疗内容知情同意,本研究经医院伦理委员会批准。
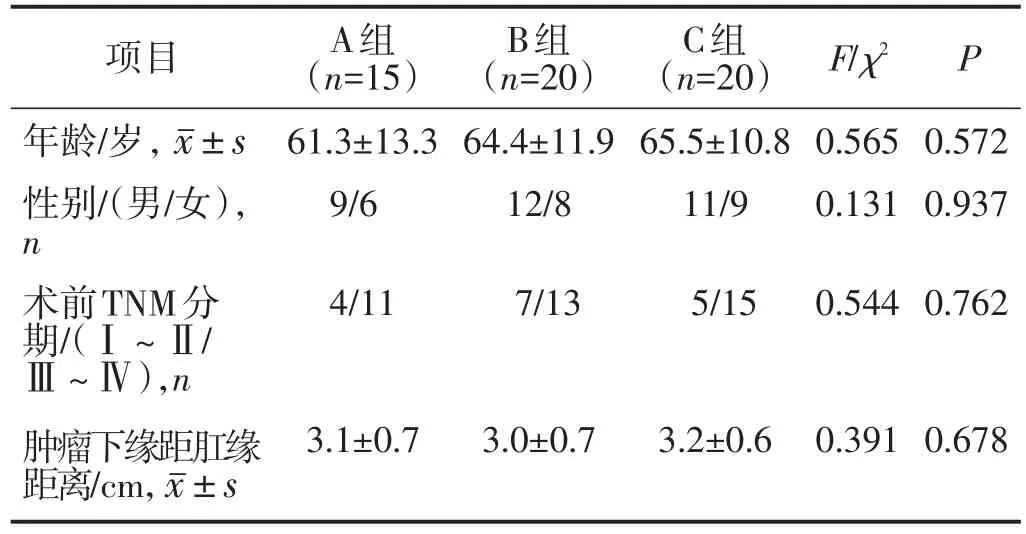
表1 三组一般资料比较
1.2 纳入与排除标准
纳入标准:(1)术前行电子结肠镜检查,经活检病理确诊为直肠癌;(2)肿瘤下缘距肛缘≤5 cm但无保肛指征;(3)术前KPS功能状态评分≥80分。排除标准:(1)中转开腹;(2)曾行子宫切除术或行膀胱手术;(3)曾行小肠部分切除术;(4)有肝、肺等远处转移,或术前行新辅助化疗;(5)术前合并贫血、低蛋白血症,或合并严重心脑血管疾病,术前一般情况较差;(6)术前已出现肠梗阻、消化道出血等肿瘤急症。
1.3 手术方法
取截石位,选取脐上1 cm处为观察孔,右下腹麦氏点为主操作孔,脐平面右腹直肌外缘、反麦氏点、脐平面左腹直肌外缘为辅助操作孔,建立CO2气腹,压力维持在14 mmHg。在肿瘤近端约15 cm处予以线型切割闭合器离断肠管,近端乙状结肠于左下腹壁造口。会阴部以肛门为中心做长径为前后方向的椭圆形切开皮肤和皮下组织,切除肛门、直肠、部分乙状结肠,将切除的组织从该切口拉出体外,冲洗盆腔后将会阴部切口分两层缝合。
(1)A组:再次建立气腹,确认腹腔充分止血后,腹腔组医师经右髂部腹膜外将一乳胶引流管末端置于截石位时骶前间隙的最低点(尾骨尖前方的骶前间隙)。理顺整个小肠,将部分回肠呈扇形展平,平铺于骨盆入口,充分挡住盆腔入口(见图1),用倒刺线沿肠系膜近肠管侧无血管区前方缝合于子宫(女性)/膀胱壁(男性)上(见图2),左右侧方分别缝合于左右侧腹膜上(见图3)。缝合完毕后检查有无空隙,若出现较大空隙则使用3-0可吸收线间断加固2~3针,确保盆腔入口已完全被小肠系膜覆盖且缝合后间隙无法通过小肠或其系膜。

图1 小肠系膜平铺于盆腔入口
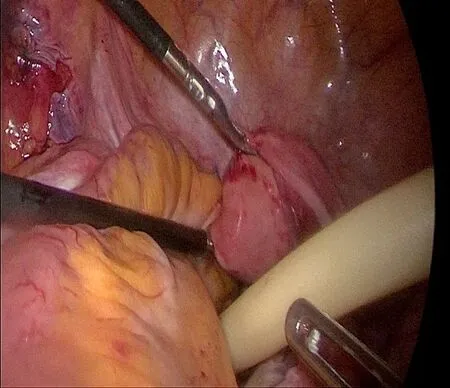
图2 系膜近肠管侧前方与子宫缝合
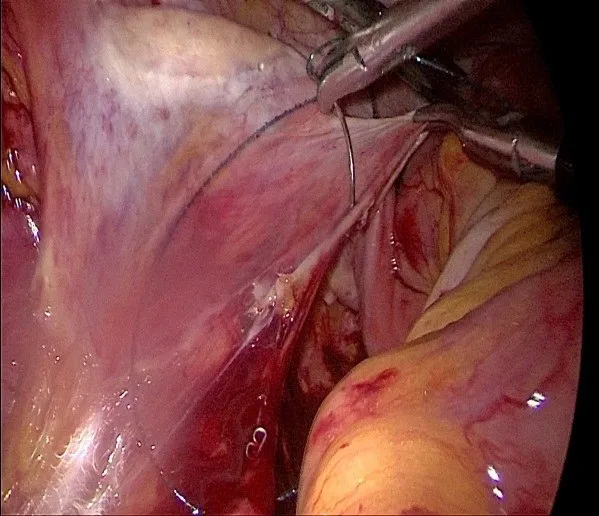
图3 小肠系膜与侧腹膜缝合
(2)B组:采用3-0可吸收线自腹膜返折与骶骨岬连线中点处盆底腹膜(两侧游离缘)进针,先自中点向两侧方向进行单纯连续缝合,后再将两侧缝线折返连续缝合至起点,两线打结(见图4)。最后腹腔组医师经右髂部腹膜外将一乳胶引流管末端置于截石位时骶前间隙的最低点。
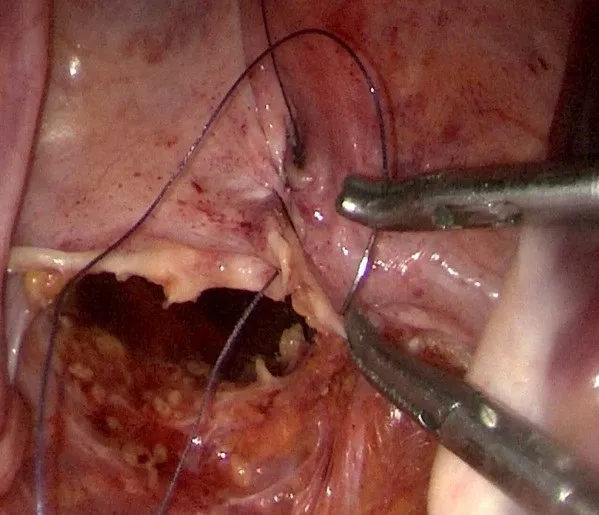
图4 两侧游离盆底腹膜连续缝合
(3)C组:不做盆底重建,直接经右髂部腹膜外将一乳胶引流管末端置于截石位时骶前间隙的最低点。
1.4 观察指标及术后诊疗计划
记录三组指标:(1)手术相关指标,包括手术时间、术中出血量、术后住院时间、术后首次造口通气时间;(2)手术及放疗相关并发症。术后第4周返院复诊,由手术医师评估恢复情况,并制定下一步辅助治疗计划,之后每6个月返院复诊一次。
1.5 统计学方法
2 结果
2.1 手术相关指标
三组手术时间、术中出血量以及术后首次造口通气时间比较差异均无统计学意义(均P>0.05);三组术后住院时间比较差异有统计学意义(P<0.05),A组、B组术后住院时间均短于C组(均P<0.05)。见表2。
表2 三组手术相关指标比较 ±s
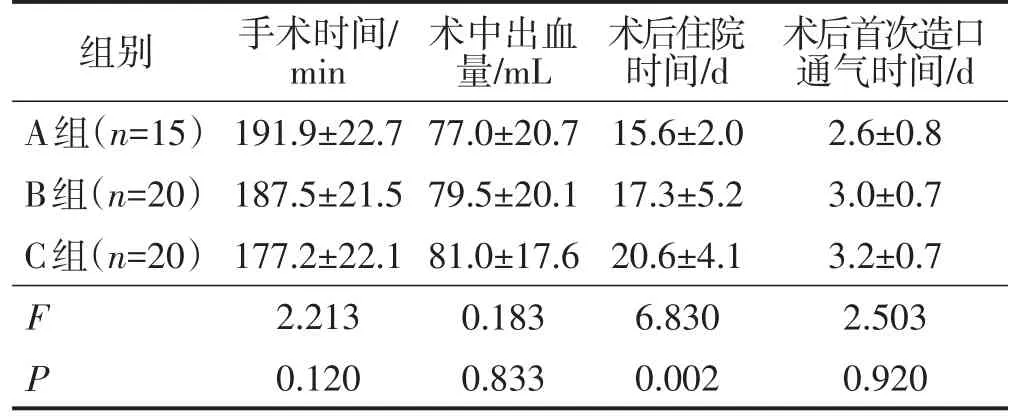
表2 三组手术相关指标比较 ±s
组别A组(n=15)B组(n=20)C组(n=20)F P手术时间/min 191.9±22.7 187.5±21.5 177.2±22.1 2.213 0.120术中出血量/mL 77.0±20.7 79.5±20.1 81.0±17.6 0.183 0.833术后住院时间/d 15.6±2.0 17.3±5.2 20.6±4.1 6.830 0.002术后首次造口通气时间/d 2.6±0.8 3.0±0.7 3.2±0.7 2.503 0.920
2.2 手术及放疗相关并发症
三组手术及放疗相关并发症发生情况见表3。其中B组有1例患者于术后第4天出现恶心、呕吐、腹痛、腹胀等症状,行腹部CT示小肠明显扩张,肠腔内出现气液平(见图5),小肠坠入盆腔(见图6),患者急诊行二次手术,术中见盆底腹膜缝合线裂开,部分小肠坠入盆腔形成盆底疝,术后患者症状好转。

表3 三组手术及放疗相关并发症发生情况 n
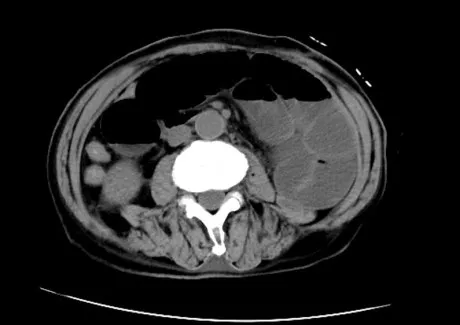
图5 小肠肠管扩张及肠腔内气液平
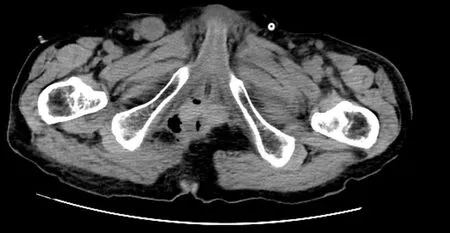
图6 小肠坠入盆腔
3 讨论
遵循肿瘤根治原则,标准的Miles术需切除肿瘤所在区域一定范围内的肠管及其系膜全部淋巴结、肛提肌、坐骨直肠窝内的脂肪、肛管和肛门周围直径约6 cm的皮肤及全部肛门括约肌[3,9]。由于该术式盆腔内组织切除的范围较大,术后形成的盆腔缺损也会带来相关的并发症,如小肠坠入盆腔后因粘连形成肠梗阻,盆腔与腹腔相通增加感染发生及感染蔓延的概率等。故在开放Miles术后,常规关闭盆底腹膜以减少术后并发症的发生[5,10]。而在腹腔镜Miles术后,缝合盆底腹膜则对主刀医师操作水平有较高的要求,另有文献报道关于腹腔镜Miles术后关闭盆底腹膜对术后并发症的发生率是否有影响尚无统一认识[7],因此部分外科医师在腹腔镜Miles术后选择不关闭盆底腹膜。
腹膜具有较强的修复和愈合能力,还可以分泌少量浆液以润滑和减少脏器运动摩擦,盆底腹膜是人体的天然屏障之一。此外,腹腔镜Miles术后盆腔不可避免会有许多渗液生成,若引流不畅,渗液蓄积在盆腔则极易滋生细菌、形成感染灶,若无腹膜屏障,感染易扩散至腹腔造成弥漫性腹膜炎、脓毒症等[11-13],重建的盆底腹膜有效地隔离了腹腔与盆腔,可防止盆腔感染逆行上传至腹腔,控制感染扩散,并且关闭盆底腹膜可以阻挡小肠坠入盆腔,降低粘连性肠梗阻及术后放疗所造成放射性小肠炎的发生率,有利于患者术后康复,减轻患者经济负担。周其乐等[14]对比腹腔镜Miles术后是否行盆底腹膜关闭的临床效果,结果显示腹腔镜Miles术后行盆底腹膜关闭安全可行,能降低术后会阴部相关并发症的发生率,缩短术后住院时间,本研究结果与之有相符之处。因此,笔者团队认为在腹腔镜Miles术后行盆底重建安全可行,也是有必要的。
但是,关闭盆底腹膜也存在相当的局限性和技术难度,主要体现在以下几个方面:(1)男性骨盆空间狭窄,女性骨盆相对较宽,但有子宫、附件等阻挡,难以清晰暴露视野;(2)直接缝合张力较大,若患者术后出现咳嗽动作等导致腹腔压力增大,极易撕裂;(3)直接缝合属于张力缝合,难免会导致腹膜撕裂,缝线处出现缝隙,难以实现紧密的连续缝合;(4)术前行新辅助放化疗患者腹膜水肿,质地脆,更易导致腹膜撕裂;(5)当肿瘤较大或者盆腔粘连较重时,腹膜分离难度大,此时往往需要切除更多的腹膜,更加难以实现盆底腹膜直接缝合;(6)腹腔镜缝合常用连续缝合,但缝合时可能由于助手配合不当或可吸收线过早吸收等原因造成盆底腹膜关闭不严,更易形成盆底腹膜裂孔疝或导致关闭失败[15]。
在本研究中,A组采用小肠系膜覆盖盆腔入口的方法来防止小肠坠入盆腔,结果表明该组患者均在腹腔镜下成功实施该操作,在术后随访期间该组患者均未发生粘连性肠梗阻、盆底疝、放射性小肠炎等并发症,术后仅2例患者出现会阴部切口未一期愈合,经局部开放换药后患者切口愈合良好;B组有1例患者因盆底腹膜关闭不严而发生严重并发症;C组术后会阴部切口愈合不良率高达50%,而开放换药既增加了患者的痛苦,也延长了患者的住院时间,增加患者的经济负担。笔者团队认为,利用小肠系膜完成盆底关闭的方法不仅解决了直接关闭盆底腹膜时张力大的问题,同时因采用间断缝合的方法,术者单人即能完成缝合,减少了可能出现的关闭不严问题,减少了盆底腹膜裂孔疝的发生,也有助于缩短缝合时间。将小肠系膜近肠管侧缝合于盆腔入口平面,不仅在盆腔入口处形成一屏障,防止小肠坠入盆腔底部,还防止了腹腔与盆腔两者间的感染蔓延。在因患者肥胖、直接缝合张力较大、盆腔粘连严重等情况而无法直接行盆底腹膜关闭时,使用小肠系膜覆盖盆腔入口的方法关闭盆底有效可行,值得进一步推广。但应用该方法缝合时要注意避开肠系膜血管区,防止缝合造成肠系膜血管出血及缝闭肠系膜血管造成肠管缺血,且如果既往有小肠切除手术史或术中探查发现小肠系膜粘连严重,则不可行此方式。
综上所述,腹腔镜Miles术后行盆底关闭可以缩短患者术后住院时间,在减少手术及放疗相关并发症方面也有一定的优势,采用小肠系膜行盆底关闭或直接行盆底腹膜缝合总体安全可行。