旋覆代赭汤对反流性食管炎模型大鼠食管组织及外周血中IL-18及相关促炎因子表达的影响
刘 菊 柳 媛 金振宇 薛建国 袁红霞
(1.昆山市中医医院,江苏昆山215300;2.天津中医药大学,天津300193)
反流性食管 炎(reflux esophagitis,RE)又称糜烂性食管炎(erosive esophagitis,EE),是 指胃或十二指肠内容物反流入食管,引起食管黏膜损伤的一种疾病,主要病理表现为食管黏膜的炎性损伤和愈复过程[1]。RE属于胃食管反流病(gastroesophageal reflux disease,GERD),流行病 学调查显示,GERD的全球患病率约为13.98%,中国约为4.16%,而RE约 占GERD的30%~40%[2]。RE破 坏正常的食管鳞状上皮,并发症包括食管溃疡、狭窄、Barrett食管等,其中Barrett食管被认为是食管腺癌的前身。因此,早期截断食管炎症,对防治RE并发症,预防食管腺癌很有必要。
有研究表明,RE并不是开始于食管黏膜表面的化学性损伤,而是始于反流物诱发的细胞因子聚集介导的食管炎症反应[3]。白介素-18(interleukin-18,IL-18)是一种强力促炎因子,已有研究证实IL-18对Barrett食管及食管腺癌具有免疫调节作用[4-5],但其在RE中的研究报道较少。本研究观察了旋覆代赭汤对RE模型大鼠IL-18及相关炎症因子白介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、环氧合酶2(cyclooxygenase -2,COX-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达的影响,探索旋覆代赭汤对RE的治疗机制。
1 实验材料
1.1 实验动物 健康雄性SPF级Wistar大鼠60只,12周龄,体质量(220±20)g,由北京斯贝福生物技术有限公司提供,许可证号:SCXK(京)2016-0006,合格证号:1100111911047350,饲养于天津市南开医院实验动物研究中心。本实验通过天津市南开医院实验动物伦理委员会审查,编号:NYKKDWL-2019-083。
1.2 实验药物 旋覆代赭汤使用江阴天江药业有限公司生产的颗粒剂,参考前期实验结果[6],将《伤寒论》第161条原方剂量按汉代度量衡折算为:旋覆花15g、赭石5g、生姜25g、半夏15g、人参10g、炙甘草15g、大枣10g。依据“人和动物体表面积折算等效剂量比率表”计算大鼠用药剂量为人类剂量的6.25倍,颗粒剂加热水充分搅拌后,配制成浓度为0.989g/mL的溶液。奥美拉唑肠溶片,由阿斯利康制药有限公司生产,产品批号:J20130093;枸橼酸莫沙必利片,由鲁南贝特制药有限公司生产,产品批号:H19990317。奥美拉唑+莫沙必利配制成浓度为0.26 mg/mL的混悬液(奥美拉唑0.208 mg/mL,莫沙必利0.052 mg/mL)。上述药液均密封后放置于4 ℃冰箱保存备用。
1.3 主要试剂与仪器 主要试剂:各梯度酒精、二甲苯、苏木精/伊红染色剂等病理染色基本试剂由天津市南开医院中西医结合急腹症研究所提供;IL-18、IL-6、TNF-α酶联免疫吸附测定(ELISA)法试剂盒(批号:BG190308RAC、BG190218RAC、BG190218RAC),上海蓝基生物科技有限公司生产;IL-18、COX-2、iNOS抗体(批号:ab191860、ab52237、ab15323),英国Abcam公司生产;BCA蛋白浓度测定试剂盒(批号:PAB180002、PAB180013、PAB180024),Bioswamp公司生产。
主要仪器:超薄切片机(型号:EMUC6),正置荧光显微镜(型号:DM400B+DFC500+LA),德国Leica公司;倒置相差光学显微镜(型号:IX71),日本Olympus;电子显微镜(型号:H7650),日本日立公司;凝胶成像系统(型号:Universal Hood Ⅱ),化学发光分析仪(型号:ChemiDocXRS),电泳仪(型号:MiNi Proteam 3 Cell),美国Bio-Rad公司;台式冷冻离心机(型号:H2050R),湖南湘仪集团;恒温水浴箱(型号:DZKW-4),北京中兴伟业仪器有限公司;分光光度计(型号:KHB-ST-360),上海科华生物。
2 实验方法
2.1 分组与造模 60只雄性Wistar大鼠,随机分为正常组、模型组、西药组(奥美拉唑+莫沙必利)、中药组(旋覆代赭汤),每组15只。除正常组外,其余各组大鼠采用“4.2 cm幽门夹+2/3胃底结扎术”[7]制备RE模型。术后24 h禁食不禁水,此后常规喂养。术后3 d内,每天每只大鼠给予1.5 mg/kg盐酸左氧氟沙星注射液腹腔注射。
2.2 药物干预 术后第8天开始,每日模型组给予生理盐水1 mL/100g体质量灌胃,正常组同期予等量生理盐水灌胃,西药组与中药组给予相应药液1 mL/100g体质量灌胃,每日分2次,连续14 d。
2.3 取材 各组大鼠最后一次灌胃结束后,禁食不禁水24 h,0.3%戊巴比妥钠腹腔注射过量麻醉剂处死,常规开腹采集腹主动脉血,置于离心管中室温静置1 h以上,常温825×g离心10 min,取上清,置于EP管中,-80 ℃保存待检测,用于血清学指标测定。开腹后纵向剖开食管,观察食管黏膜表象并进行病理分级,取胃食管交界上0.5 cm处向咽喉部截取1.5~2.0 cm食管组织,分为2份,一份制备病理切片,一份-80 ℃冻存待测。
2.4 观察指标
2.4.1 食管黏膜肉眼表现、RE分级及病理形态学观察 将各组大鼠食管腔用预冷的生理盐水漂洗,纵行切开,肉眼观察食管黏膜大体表现并进行RE分级,分级标准参考中华医学会消化内镜分会发布的《反流性食管炎诊断及治疗指南(2003年)》[8]。取食管下段小块组织,置于组织包埋盒中,使用10%福尔马林固定,常规石蜡包埋制备病理切片,苏木素-伊红(HE)染色后,通过光镜观察病理形态学表现。
2.4.2 Western blot检测食管组织中IL-18、COX-2、iNOS蛋白表达 用清洁的手术剪将食管组织块尽可能剪碎,置于EP管内称重。按每20 mg组织200 μL裂解液的比例加入匀浆器中匀浆,置于冰上30 min,每隔10 min摇晃一次助溶,于4 ℃、1200×g离心15 min,吸取上清。采用BCA蛋白定量法测定样本蛋白浓度,制备SDS-PAGE浓缩胶及分离胶,转膜后加入一抗、二抗孵育,凝胶成像系统显影。
2.4.3 ELISA法检测血清中IL-18、IL-6、TNF-α含量 将分离的血清采用双抗体夹心法进行操作。按次序加入100 μL标准品,空白孔加入100 μL样品,空白对照加入100 μL PBS,各孔加入50 μL酶标溶液,密封后37 ℃孵育1 h。充分洗涤酶标板,吸水纸拍干后加入显色剂A、B各50 μL,37 ℃下避光反应15~20 min后加入50 μL终止液。在450 nm波长处测定各孔的OD值。以标准物的浓度为纵坐标,OD值为横坐标,计算出标准曲线的回归方程,将样本的OD值代入方程式,计算样本实际浓度。
2.5 统计学方法 使用SPSS 22.0统计软件分析数据,Graphpad 6.0绘制统计图。等级资料组间比较采用秩和检验,两两比较采用混合排秩后行方差分析。计量资料若符合正态分布,以(±s)表示,组间比较采用单因素方差分析;若方差不齐或不符合正态分布,采用welch检验。组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
3 实验结果
3.1 大鼠死亡情况 各组大鼠于处死前,共死亡8只。正常组大鼠实验过程中无死亡;模型组1只死于幽门梗阻,1只死于腹腔感染,1只死于肠梗阻;中药组1只死于幽门梗阻,1只死于肺感染;西药组2只死于腹腔感染,1只死于肠梗阻。最终剩余:正常组15只,模型组12只,中药组13只,西药组12只。
3.2 各组大鼠食管黏膜肉眼表现及RE分级 正常组大鼠食管黏膜光滑,无肉眼可见病理改变。模型组大鼠食管黏膜充血明显,中下端可见点片状红斑改变,散见针尖至米粒样大小不等白色溃疡,少数食管下端出现“树皮样”增生白斑。中药组大鼠食管黏膜平整,多数食管下端有水肿,色泽粉红,散见充血点,未见糜烂性溃疡及增生白斑。西药组大鼠食管黏膜较光滑平整,未见糜烂、溃疡或增生白斑。各组大鼠食管黏膜肉眼RE分级见表1。
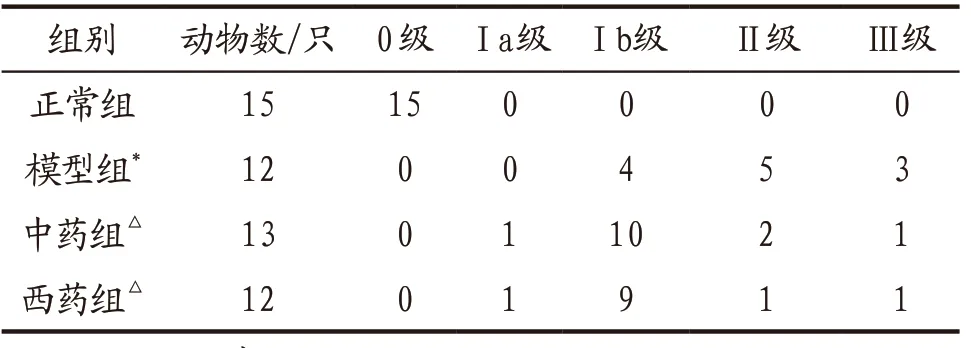
表1 各组大鼠食管黏膜肉眼RE分级 单位:只
3.3 各组大鼠食管黏膜组织病理形态学表现 正常组大鼠光镜下可见食管黏膜层表面为非角化复层鳞状上皮,基底细胞层中有少许黑色素母细胞和内分泌细胞。模型组可见食管鳞状上皮基底细胞增生,固有膜乳头延长,嗜酸性粒细胞、中性粒细胞浸润,可见黏膜糜烂或溃疡形成,少数有柱状上皮化生。中药组大鼠食管黏膜鳞状上皮增生较少,糜烂、溃疡等病理较少出现,黏膜间质见少许淋巴细胞及单核细胞浸润。西药组大鼠食管黏膜鳞状上皮内可见慢性炎细胞浸润,细胞间隙增宽,未见明显糜烂、溃疡。见图1。
3.4 各组大鼠食管组织IL-18、COX-2、iNOS蛋白表达比较 模型组大鼠食管组织中IL-18、COX-2、iNOS 蛋白含量明显高于正常组,差异具有统计学意义(P<0.01);中药组、西药组上述指标蛋白表达明显低于模型组(P<0.01);中药组与西药组组间比较,差异无统计学意义(P>0.05)。见图2、表2。
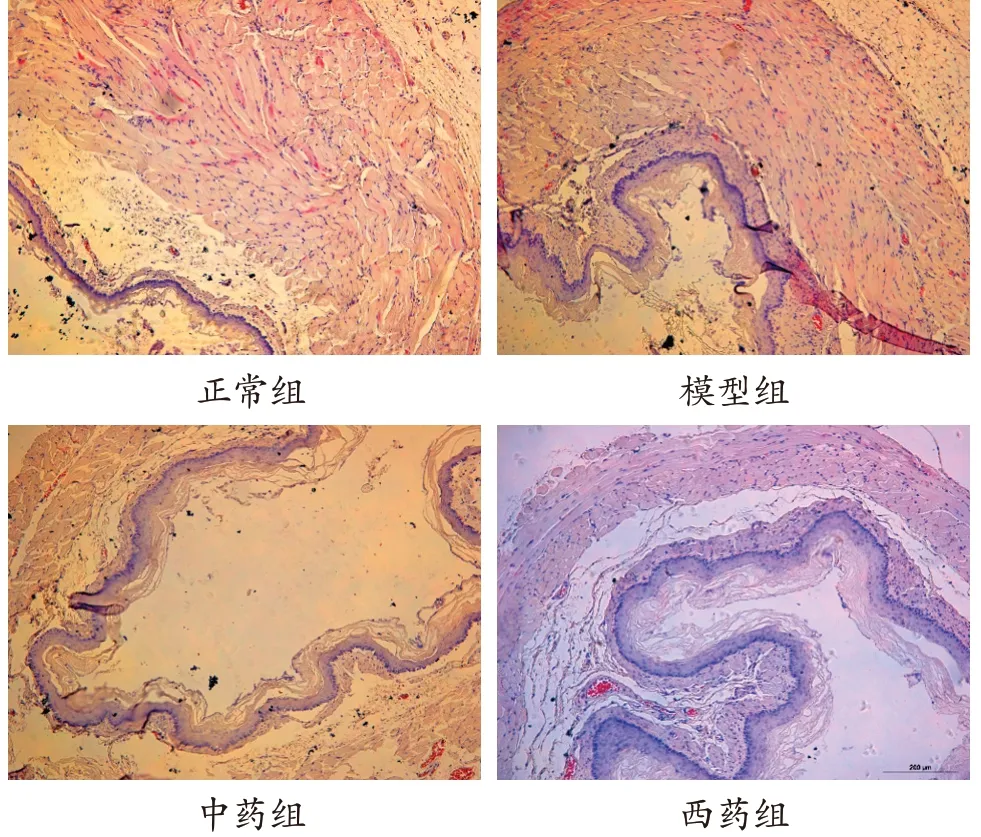
图1 各组大鼠食管黏膜组织病理表现(HE染色,×200)
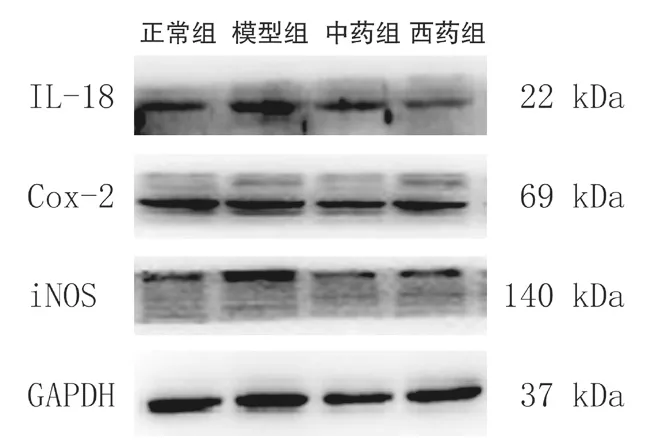
图2 各组大鼠食管组织IL-18、COX-2、iNOS蛋白表达比较
表2 各组大鼠食管组织IL-18、COX-2、iNOS蛋白表达比较(±s)
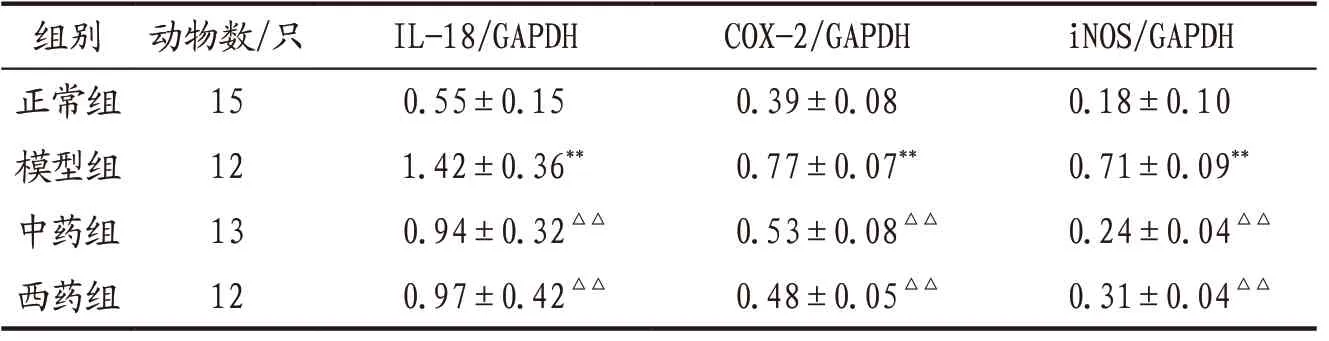
表2 各组大鼠食管组织IL-18、COX-2、iNOS蛋白表达比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,△△P<0.01。
组别 动物数/只 IL-18/GAPDH COX-2/GAPDH iNOS/GAPDH正常组 15 0.55±0.15 0.39±0.08 0.18±0.10模型组 12 1.42±0.36** 0.77±0.07** 0.71±0.09**中药组 13 0.94±0.32△△ 0.53±0.08△△ 0.24±0.04△△西药组 12 0.97±0.42△△ 0.48±0.05△△ 0.31±0.04△△
3.5 各组大鼠血清IL-18、IL-6、TNF-α表达比较 模型组大鼠血清IL-18、IL-6、TNF-α表达明显高于正常组,差异具有统计学意义(P<0.01);中药组、西药组上述指标表达明显低于模型组(P<0.05)。中药组与西药组组间比较,差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清IL-18、IL-6、TNF-α表达比较(±s) 单位:pg/mL

表3 各组大鼠血清IL-18、IL-6、TNF-α表达比较(±s) 单位:pg/mL
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05。
组别 动物数/只 IL-18 IL-6 TNF-α正常组 15 170.65±14.62 18.08±7.01 168.65±9.29模型组 12 1 088.79±36.41** 81.06±9.51** 186.52±5.87**中药组 13 933.76±39.65△ 35.97±5.59△ 177.00±6.16△西药组 12 917.48±45.67△ 23.77±4.30△ 176.29±4.70△
4 讨论
4.1 正气不足、邪气有余的炎症微环境是RE的内在发病基础 正气是存在于人体内的一类具有调节机体功能、适应环境刺激、抵御外邪侵袭等作用的细微物质,正气作为人体固有的生理之气,与邪气存在对立制约关系。“正气存内,邪不可干”,将邪正盛衰的斗争作为人体虚实变化及疾病产生的内在根源。体内正气充足则卫外得固、气机调畅,机体可维持正常生理功能,保持免疫环境稳定,抵御外在致病因素的侵袭;“邪之所凑,其气必虚”,若正气不足,则卫外不固,气机升降出入失于畅达,免疫内环境失稳,外邪侵袭,外界的病原微生物或机体自带的炎症因子乘虚而起,形成炎症性疾病。正气不足、邪气有余是慢性炎症性疾病的内在发病基础,治疗此类慢性炎症性疾病应着眼于扶正补虚、调节免疫[9-10]。RE是消化系统常见的慢性炎症性疾病,炎症反应在食管疾病中的作用已被证实,因此正气不足导致的炎症微环境也应成为RE治疗的着眼点之一。
4.2 IL-18是炎症免疫应答中的关键驱动因子 IL-18是一种强有力的促炎因子,在炎症及免疫应答中具有重要作用。IL-18基因位于人类的11号染色体上,编码193个氨基酸的前体,最初作为无活性的24 kDa前体合成,在巨噬细胞、小胶质细胞、人外周血单核细胞、肠上皮细胞、气道上皮细胞等细胞中累积[11-12]。IL-18前体在细胞内被蛋白水解酶caspase 1加工成18 kDa的成熟IL-18蛋白。Caspase 1可通过与各种典型的炎性小体包括NLRP3、NLRP4、NLRP1等结合而被激活,从而促进IL-18加工成熟并释放。成熟的IL-18通过与其受体,即IL-18R结合来发挥作用,其受体由异源二聚体组成,广泛存在于多种细胞中,属于IL-1R/Toll样(TLR)受体超家族。IL-18的初级受体为IL-18Rα,共受体为IL-18Rβ,三者结合形成IL-18/IL-18Rα/IL-18Rβ三元复合物,触发炎症反应信号。IL-18/IL-18Rα/IL-18Rβ复合物已被证明可诱导多种炎症因子如TNF-α、IL-1β、IL-6、IL-8 等的合成和分泌[13],与COX-2存在剂量依赖性[14],同时参与NFκB、NLRP3、STAT3和MAPK等多条信号通路,构成复杂细胞因子网络,形成自激活的循环连接,进而产生炎症瀑布反应,参与多种慢性炎症性疾病[15-16]。
4.3 旋覆代赭汤可通过益气和胃、免疫调节治疗RE 正气不足、邪气有余导致的慢性炎症是“正常食管-食管炎-Barrett食管-食管腺癌”进展过程中的主要驱动因素,了解食管炎症发生发展过程中的主要影响通路及关键促炎因子可以为反流性食管炎的治疗提供重要参考。本实验研究结果提示,IL-18在RE模型大鼠食管组织及血清中呈现高表达,同时促炎因子COX-2、iNOS、IL-6、TNF-α在食管及血清中也呈现高表达,提示反流性食管炎中存在多种炎症因子的活化聚集。经方旋覆代赭汤可有效降低RE模型大鼠IL-18及相关促炎因子的含量,改善食管黏膜病理,提示旋覆代赭汤可以通过抑制促炎因子的表达,对反流性食管炎起到一定的免疫调节作用。
我们前期通过临床研究发现,胃食管反流病患者呈现明显的脾胃虚弱症状,且脾胃虚弱评分与胃食管反流症状评分呈正相关[17],与患者自主神经功能减弱呈正相关[18],提示脾胃虚弱是胃食管反流的重要发病因素,这一结果与反流性食管炎“胃虚气逆”的关键病机相吻合。脾胃为后天之本,气血生化之源,是正气的重要补充来源,“脾胃虚弱,正气不足”可能是机体免疫漂移、食管炎症微环境形成的内在基础。我们选用益气补虚、和胃降逆之经方旋覆代赭汤治疗本病临床疗效显著。本研究验证了旋覆代赭汤对IL-18及相关炎症因子的抑制作用,结合前期研究,此抑炎作用的部分机制可能与其调控NF-κB、NLRP3信号通路有关[19-20],在此过程中,IL-18是否作为关键炎症细胞因子介导了免疫细胞迁移和局部聚集,尚有待进一步研究证实。

