基于NLRP3炎性小体探讨芍药甘草汤对神经根型颈椎病大鼠的抗炎镇痛机制
杨芳洁,吴大伟,何 坚*
(1.福建中医药大学康复医学院,福建 福州350122;2.江苏省盐城市中医院,江苏 盐城224000)
颈椎病是一种与年龄有关的常见颈椎退行性疾病[1],我国颈椎病的患病率为17.3%,其中神经根型颈椎病(cervical spondylotic radiculopathy,CSR)占60%~70%[2]。该病的主要临床表现为神经根性痛,炎症介质是诱发CSR疼痛的关键因素[3]。最新研究报道,NLRP3炎性小体的合成与释放在神经根性疼痛中具有重要作用[4]。芍药甘草汤可柔肝益脾、通顺血脉、缓急止痛,是治疗痉挛疼痛的良方。本团队前期研究证明芍药甘草汤对于治疗颈椎病有效[5-6],但芍药甘草汤治疗急性期CSR的作用机制尚未明确。本研究采用“椎管插线法”建立急性期CSR大鼠模型[7],探讨芍药甘草汤对CSR模型大鼠的可能作用机制,为芍药甘草汤临床疗效的科学内涵以及进一步推广提供实验依据。
1 实验材料
1.1 实验动物 60只健康成年的SPF级SD大鼠,鼠龄6~8周,体质量200~250g,于福建中医药大学实验动物中心饲养,许可证号:SYXK(闽)2012-001。
1.2 实验药物 芍药甘草汤药物组成:白芍12g,甘草12g,购自福建中医药大学附属康复医院中药房的颗粒剂(江阴天江药业有限公司)。
1.3 实验试剂 苏木素伊红染液(北京索莱宝公司);rat IL-18 Elisa Kit(上海西唐生物公司);Anti-NLRP3 antibody(英国艾博抗公司)。
1.4 实验仪器 YB-6LF生物组织石蜡包埋机(湖北阳光科技有限公司);RM2235石蜡切片机(德国Leica公司);BH-2德国光学显微镜(日本奥林巴斯公司);Tecan M200 PRO多功能酶标仪(瑞士Tecan公司);Leica DM4000B荧光显微镜(德国Leica公司);ChemiDocXRS+System超高灵敏度化学发光成像系统(美国Bio-Rad公司);BioSpec 70/20USR小动物核磁成像系统(美国BRUKER公司)。
2 实验方法
2.1 模型制备及分组 将大鼠分为假手术组(n=12)和造模组(n=48),适应性喂养1周后参照文献[7]对造模组大鼠进行造模,术后予注射庆大霉素防止局部感染。造模第2天采用影像学测评结合BBB评分[8]验证造模是否成功之后进行药物干预。
2.2 干预方法 将造模组随机分为模型组、芍药甘草汤低剂量组(低剂量组)、芍药甘草汤中剂量组(中剂量组)和芍药甘草汤高剂量组(高剂量组)各12只。低、中、高剂量组大鼠分别按1.08、2.16、4.23 g/(kg·d)予芍药甘草汤药液进行灌胃,假手术组及模型组以同等剂量予生理盐水灌胃,早、晚各灌1次,连续干预1周。
2.3 检测指标及方法
2.3.1 机械痛阈测定 分别于药物干预后的第1天、第3天及第7天,采用up-and-down法通过Von Frey纤维丝测定各组大鼠后脚趾对机械刺激50%缩爪阈值的变化。
2.3.2 IL-18检测 于末次阈值测定后,在深度麻醉下经腹主动脉采全血,采用酶联免疫法测定大鼠血清IL-18含量,用酶标仪在450 nm波长下测量光密度(OD值)。
2.3.3 脊髓前角运动神经元计数 每组随机选取6只大鼠,经10%水合氯醛深度麻醉并取血后取出脊髓组织。采用苏木素染色以及伊红染色法将大鼠颈脊髓组织染色后,使用光学显微镜高倍光镜下观察各组大鼠颈部脊髓组织中脊髓前角运动神经元数量的变化情况。
2.3.4 检测脊髓组织中NLRP3蛋白表达水平 采用蛋白印迹法检测颈部脊髓组织中NLRP3蛋白的表达水平,用超高灵敏化学发光成像系统显影与分析。
2.4 统计学方法 运用SPSS 22.0统计软件分析实验数据。计量资料符合正态分布以(±s)表示,多组数据比较采用单因素方差分析。
3 结果
3.1 5组大鼠机械痛阈值比较 见表1。
表1 5组大鼠机械痛阈值比较(±s)s

表1 5组大鼠机械痛阈值比较(±s)s
注:与假手术组比较,1)P<0.01;与模型组相比,2)P<0.01;与低剂量组相比,3)P<0.01。
组别假手术组模型组低剂量组中剂量组高剂量组n 1212121212术后1 d 13.41±1.3111.16±1.021)11.33±1.541)11.25±0.971)11.08±1.241)术后3 d 13.25±1.849.91±0.991)10.41±0.901)10.00±1.201)10.08±0.791)术后7 d 12.91±1.316.91±1.311)6.83±1.191)10.33±1.151)2)3)10.08±0.991)2)3)
3.2 5组大鼠颈部脊髓前角运动神经元计数 见图1、表2。

图1 5组大鼠颈部脊髓前角HE染色图(×400)
表2 5组大鼠颈部脊髓前角运动神经元计数(±s) 个/高倍视野

表2 5组大鼠颈部脊髓前角运动神经元计数(±s) 个/高倍视野
注:与假手术组比较,1)P<0.01;与模型组比较,2)P<0.01;与低剂量组比较,3)P<0.01。
组别假手术组模型组低剂量组中剂量组高剂量组n 66666数目62.2±6.735.9±4.21)47.9±4.22)54.9±4.42)3)58.2±5.72)3)
3.3 5组大鼠颈部脊髓NLRP3蛋白表达比较 见图2、表3。

图2 5组大鼠脊髓NLRP3蛋白电泳图
表3 5组大鼠颈部脊髓NLRP3蛋白表达比较(±s)

表3 5组大鼠颈部脊髓NLRP3蛋白表达比较(±s)
注:与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01;与低剂量组比较,4)P<0.01。
组别假手术组模型组低剂量组中剂量组高剂量组n66666 NLRP351.57±3.3791.71±5.261)83.42±4.922)59.34±7.363)4)51.64±5.153)4)
3.4 5组大鼠IL-18表达水平比较 见表4。
表4 5组大鼠IL-18表达水平比较(±s)pg/mL
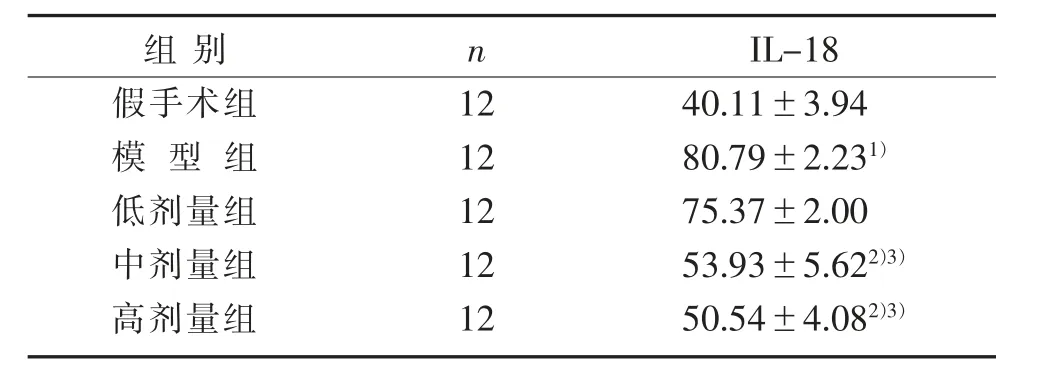
表4 5组大鼠IL-18表达水平比较(±s)pg/mL
注:与假手术组比较,1)P<0.01;与模型组比较,2)P<0.01;与低剂量组比较,3)P<0.01。
组别假手术组模型组低剂量组中剂量组高剂量组n 1212121212 IL-1840.11±3.9480.79±2.231)75.37±2.0053.93±5.622)3)50.54±4.082)3)
4 讨论
大量证据表明,在急性CSR的脊髓损伤中,炎症反应起关键作用[3,9]。NLRP3作为炎症反应的核心,是最典型的炎性小体,其在介导CSR的炎症中至关重要。感觉神经损伤后,位于脊髓背角的NLRP3炎性小体被激活,诱导半胱氨酸蛋白酶-1,进而促进IL-18的合成,并通过多个下游信号通路促使神经炎症反应,引起神经元损伤[10]。而神经元存活是脊髓损伤后功能恢复的基础[11]。本研究结果显示,模型组NLRP3炎性小体信号通路蛋白及IL-18表达升高,各剂量组NLRP3蛋白及IL-18表达均降低;模型组大鼠脊髓前角运动神经元数量显著减少,各剂量组运动神经元数量增加明显。由此可见,抑制小胶质细胞活化,阻断持续性炎症,促使神经元存活是治疗急性CSR的关键。
不仅如此,NLRP3炎性小体活化增强,释放炎症因子IL-18时,还会加速痛觉传导,导致自发性疼痛、痛觉过敏(对伤害性刺激的痛觉增加)和机械性超敏(对正常无害刺激的痛觉过敏)[12]。本实验机械痛阈结果表明,模型组大鼠的3次痛阈值持续降低,中、高剂量组的痛阈值显著增高。由此可见,在神经性疼痛中,当神经系统受到损害时,其敏感性的变化会持续存在,产生疼痛,痛阈值会急剧下降,导致无害的刺激也会产生疼痛,并且对有害刺激的反应持续时间和强度也会增加[13]。因此,芍药甘草汤可通过抑制NLRP3炎性小体,进而抑制机体炎症反应,保护神经根型颈椎病大鼠神经根组织,产生抗炎镇痛的功效。
综上所述,芍药甘草汤对CSR大鼠模型有明显镇痛作用,能够缓解局部的炎症损伤,抑制脊髓局部NLRP3炎性小体活化,进而抑制促炎性细胞因子IL-18的表达,这可能是芍药甘草汤治疗大鼠急性期CSR的作用机制之一。本实验仅对颈部脊髓前角相关神经组织进行研究,而在背根神经结等处是否具有相同的作用机制目前尚不清楚,还有待进一步深入研究。

