CK5/6、P63、TTF-1和napsinA在腺癌及鳞状细胞癌鉴别诊断中的应用
陈显文 罗爱华 曾洲红
广东省高州市人民医院病理科,广东高州 525200
肺癌为引发死亡的主要恶性肿瘤,小细胞癌以及非小细胞癌区分对于患者而言具有重要意义[1]。当新型靶向治疗药物问世后,临床需要对非小细胞肺癌进行分类,由于腺癌表皮生长因子受体发生变化,进而抑制剂治疗效果显著,同时贝伐单抗以及培美曲塞可有效治疗腺癌。然而因为肺癌具有较大的异质性,同时小活检具有较小的标本,取材时会因为人工挤压出现细胞变形,为此分类需要通过免疫组化以及组织化学染色[2]。本研究选取2019年1月至2020年6月我院收治患者,对其肺小活检中应用免疫组化检验对腺癌及鳞状细胞癌的鉴别诊断,现报道如下。
1 资料与方法
1.1 一般资料
选择2019年1月至2020年6月随机抽取我院收治的30例肺原发性鳞状细胞癌以及50例肺原发性腺癌作为本研究对象。30例肺原发性鳞状细胞癌中男19例,女11例,年龄45~76岁,平均(61.5±2.6)岁,50例肺原发性腺癌中男29例,女21例,年龄46~79岁,平均(63.6±3.5)岁。本研究通过医院伦理委员会批准。
1.2 纳入和排除标准
纳入标准:入选患者通过诊断均为腺癌及鳞状细胞癌;入选患者经过检查证实存在转移病灶;入选患者均具有完整资料。排除标准:排除意识障碍者;排除患有精神类疾病者;排除资料不完整者。
1.3 方法
通过支气管镜对患者活检标本进行采集,固定选择浓度10%甲醛,而后对其实施石蜡包埋,制作厚度为4 μm的切面5 张,对其实施免疫组织化学染色以及HE。免疫组化检测方法为EnViSion两步法,对切片予以脱蜡,而后通过酒精脱水后采用高温进行抗原修复,并按照试剂盒说明书进行。检查过程中采用的单克隆抗体为即用型抗体,均购自安必平公司。肺泡上皮组织进行napsinA阳性检测,甲状腺组织进行TTF-1阳性检测,乳腺组织进行P63阳性检测,扁桃体组织进行CK5/6阳性检测。
1.4 评估指标
CK5/6阳性通常在细胞浆中表达,TTF-1和P63均在细胞核中表达,napsinA在细胞质中表达阳性。阴性判断标准为肿瘤细胞表现为阴性结果,或者细胞表达小于10%[3]。
1.5 统计学处理
本研究数据选择SPSS 21.0统计学软件,计量资料以()表示,采用t检验,计数资料以百分数表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 形态学
入选患者中,高分化鳞状细胞癌以及中分化鳞状细胞癌特征表现为细胞间桥、角化珠以及角化,低分化鳞状细胞癌主要表现为生长成片,偶尔出现巢状生长,周边会出现基底细胞样排列,出现鳞状分化表现。癌细胞呈现椭圆形或者短梭,并且细胞界限并无清晰性,无规则核膜。腺癌生长为腺管状、贴壁状、乳头状、实性型以及微乳头状。见图1~2。
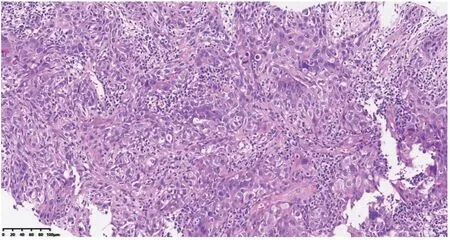
图1 低分化鳞状细胞癌

图2 低分化腺癌
2.2 标志物表达
通过分析后可知,鳞状细胞癌CK5/6阳性表达比例为80%,P63阳性表达比例为100%,而TTF-1以及napsinA阳性表达0%;腺癌细胞癌CK5/6阳性表达比例为10%,P63阳性表达比例为6%,TTF-1阳性表达为96%,napsinA阳性表达为100%,对比两种疾病4种标志物表达,差异有统计学意义(P<0.05),见表1。
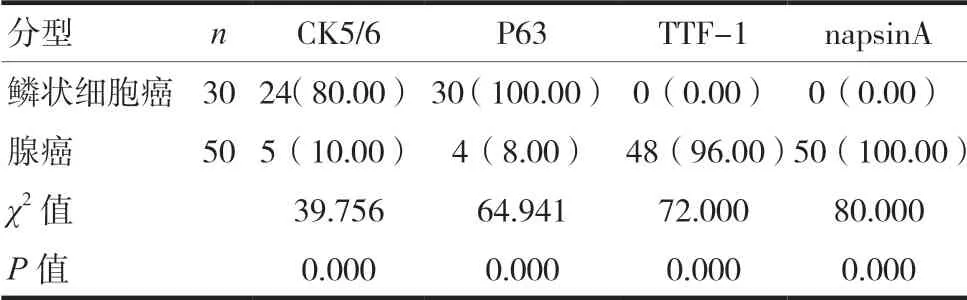
表1 分析4种标志物表达[n(%)]
3 讨论
肺癌占据国恶性肿瘤首位,目前由于污染加剧以及生活习惯发生的变化,肺癌趋于年轻化,此病对人们的健康产生严重威胁[4]。对于早期肺癌患者而言,并无显著表现,大部分患者诊断时已经为中晚期,进而错失了最佳手术治疗时机。伴随分子生物的完善发展,对于肺癌患病机制以及治疗加深了认识。肺癌患者进行化疗时应该按照病理分型实施,进而将治疗安全性提升[5]。目前临床研究学者选择免疫组织化学法鉴别肺癌病理,以此为患者后续治疗提供依据。本研究则对于肺小活检原发性中低分化鳞状细胞癌以及腺癌予以免疫组化染色,分析CK5/6、P63、TTF-1和napsinA四种标志物在临床鉴别诊断中的作用。
甲状腺转录因子1即TTF-1为临床诊断原发性肺癌标志物,有文献报道[6]TTF-1敏感性范围73%~94.6%。正常肺组织中TTF-1对表面活性蛋白表达进行控制,其表面活性蛋白可对肺部稳定性以及宿主防御进行维持。TFT-1不但在肺腺癌中表现阳性,在乳腺癌、肺小细胞癌和甲状腺癌中均表达阳性。napsinA属于天冬氨酸蛋白酶,属于肺腺癌标志物之一,有文献报道napsinA敏感性范围73.8%~93.6%[7-8]。napsinA在卵巢癌、肾细胞癌以及甲状腺癌中同样可表达阳性,并且肺泡细胞以及巨噬细胞中表现为点状胞质着色,TTF-1和napsinA可在肿瘤组织中,并且对于无经验的病理医生而言,可能将napsinA检测成为阳性。
有学者对90例腺癌患者进行分析,在进行肺癌手术病例切除后可知,60例患者TTF-1表现阳性,65例患者napsinA表现为阳性,然而对50例鳞状细胞癌患者进行分析后可知,其结果均呈现阴性[9-10],说明napsinA的敏感性和TTF-1相对比而言,前者好于后者。然而经过观察后可知,对于腺癌患者而言,napsinA的敏感和TTF-1相比,前者较差,并且其具有相同特异性,和中低分化腺癌存在一定的关系。此外临床对200例手术切除非小细胞肺癌患者进行分析后可知,TTF-1的敏感度为88%,napsinA的敏感度为74%,进而发现napsinA在形态学上具有确定腺癌分化表现患者阳性比例80%,缺少形态学分化腺癌患者的阳性比例为55%,TTF-1在缺少形态学分化的阳性比例仍为76%。与此同时,TTF-1属于核着色,在进行小活检中较为容易分辨[11]。
一般情况下,CK5/6和P63为鳞状细胞癌标志物,有文献报道P63敏感性在90%以上,与此次研究结果相似[12]。然而P63的特异性却产生异议,部分腺癌患者的P63经过检测同样出现阳性结果。本研究中鳞状细胞癌CK5/6阳性表达比例为80%,P63阳性表达比例为100%,而TTF-1以及napsinA阳性表达0%;腺癌细胞癌CK5/6阳性表达比例为10%,P63阳性表达比例为6%,TTF-1阳性表达为96%,napsinA阳性表达为100%,对比两种疾病4种标志物表达,差异具有统计学意义。鳞状细胞癌中P63具有较强的着色,并且分布弥漫,腺癌中具有较弱的着色并且分布局部病灶。即使肺腺癌P63检测出现阳性,但是其TTF-1结果则表现为阴性,为此当肿瘤TTF-1检测表现为阳性的基础上P63为阳性,可对腺癌诊断予以支持[13]。但是需要将腺鳞癌排除,为此需要与免疫组化染色以及形态进行对照。肺鳞状细胞癌CK5/6的敏感性范围53%~100%,然而CK5/6属于胞质着色,组织挤压较为严重不能进行相应的分辨,同时P63属于核着色,核结构完整可进行分辨,将CK5/6和P63联合应用后其检测结果好于单用一种标志物[14-15]。
联合检验CK5/6、P63、TTF-1和napsinA可对大多数的低分化非小细胞肺癌予以分类,并且经过分析后可知小活检免疫表型以及手术切除后出现病理不一致。就目前而言,临床需要深入分析为何部分肺鳞状细胞癌标志物会表达在腺癌中,此种情况基础上如TTF-1表现为阴性,会影响诊断[16]。然而以上几种表达并非鳞状分化,由于标志物表达具有独立性,同时并无鳞状细胞癌表现。为此对于肺腺癌患者而言,如果并未存在鳞状细胞癌形态学支持,仅对P63或者CK5/6进行检测,不能将其作为诊断根据。同时如果出现腺癌成分,肿瘤P63以及CK5/6检测阴性,并且对靶向治疗适应症无影响,可能为P63或者CK5/6阳性腺鳞癌或者肺癌[17-18]。当前的临床研究显示,腺癌和腺鳞癌EFGR突变谱系具有相似性。
综上所述,对于鳞状细胞癌进行检测过程中其P63以及CK5/6优势显著,而对于腺癌诊断而言TTF-1和napsinA具有较高的阳性率,临床对鳞状细胞癌以及腺癌进行鉴别诊断过程中可结合四项标志物进行检测,将诊断正确率提升。

