多发转移性前列腺癌患者新辅助治疗后行减瘤性前列腺根治性切除术的探讨
周 哲 晋连超 杨 冰 汪 磊 潘东亮 张志宏 贺利军 王 义 李宁忱
北京大学首钢医院泌尿外科,北京 100144
近年研究发现,对寡转移性前列腺癌患者行减瘤性前列腺根治性切除术(cytoreductive radical prostatectomy,CRP)在治疗中有着一定意义[1-3]。而对于多发转移性前列腺癌患者,国内外泌尿外科指南还是推荐采取内分泌药物、化疗或免疫治疗等保守治疗[4-5]。有的多发转移性前列腺癌患者在内分泌治疗等新辅助治疗后,患者的转移灶减少,甚至消失。对于这部分患者,身体状况良好的患者有时会寻求更为积极的治疗方案。对于多发转移性前列腺癌行新辅助治疗后转移灶减少或消失的患者,CRP手术的安全性和效果如何,目前这方面的研究报道较少。2017年5月至2018年7月本研究对新辅助治疗后转移灶减少或消失的6例多发转移性前列腺癌患者行腹腔镜下CRP手术,并进行术后随访至2020年6月,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年5月至2018年7月我院确诊的多发转移性前列腺癌行辅助治疗后转移灶减少或消失,且在之间行腹腔镜CRP手术的患者,共6例。
1.2 纳入及排除标准
纳入标准:所有患者均行前列腺穿刺活检病理确诊;身体状况良好,预期寿命>10年;初诊时行核磁、骨扫描、胸部CT和(或)正电子发射计算机断层显像(PET/CT)检查证实为多发转移;初诊后采用新辅助治疗,方案为全雄激素阻断治疗(maximal androgen blockade, MAB)和(或)多西他赛静脉化疗;新辅助治疗后,核磁提示前列腺病灶缩小,可见前列腺直肠间脂肪层,结合直肠指诊,预估前列腺可切除,见图1~2;新辅助治疗后,骨扫描、肺部CT和(或)PET/CT提示转移灶减少至5个或以下。排除标准:患者一般状况差,合并严重的心肺脑血管疾病,预期寿命<10年,核磁检查提示前列腺与周围组织关系密切、以及拒绝CRP手术治疗的患者。
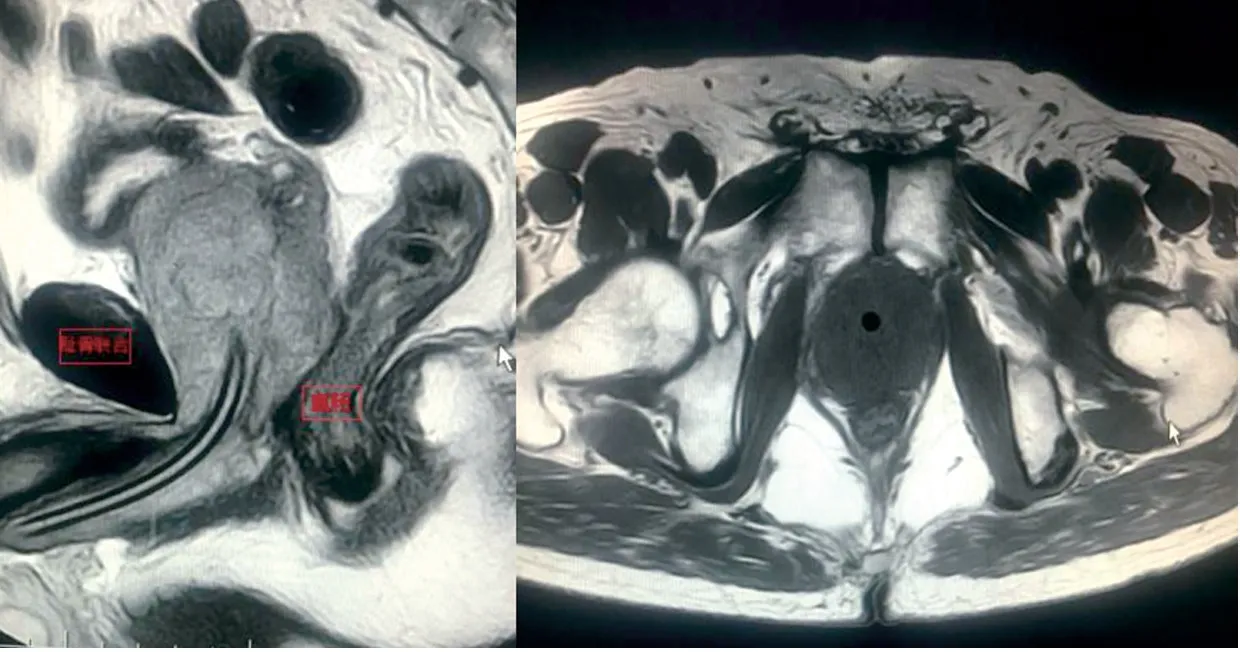
图1 穿刺前核磁检查提示前列腺与直肠、盆底筋膜关系密切

图2 新辅助治疗后核磁检查提示前列腺病灶缩小,可见前列腺直肠脂肪层以及前列腺与盆底筋膜间隙(箭头标识)
1.3 治疗方法
6例患者均行筋膜外途径腹腔镜根治性前列腺切除术。手术使用OLYMPUS电子腹腔镜系统(型号CLV-S190),患者全麻,脐下缘横行切口,手指钝性分离腹膜前间隙,球囊注入800 ml气体扩张,置入1个10 mm穿刺套管(trocar),直视下于双侧腹直肌旁、麦氏点置入另外3个trocar。切开盆底筋膜,2-0薇乔缝线缝扎背深静脉复合体。超声刀游离膀胱颈后切开,游离双侧输精管即精囊,离断并提起输精管,打开狄氏筋膜,游离直肠壁至前列腺尖部。游离并切断双侧前列腺侧韧带。离断背深静脉。分离前列腺尖部,游离尖部尿道并切断。完整切除前列腺。3-0单乔将膀胱颈与尿道连续缝合,缝合后壁后留置F20导尿管,缝合前壁。采用标准盆腔淋巴结清扫,即双侧髂外、闭孔、髂总至输尿管交叉处淋巴结。病理切缘阳性的患者于术后半年采用外放射治疗。
1.4 观察指标
记录患者的术中及术后的临床指标:包括手术时间、术中出血量、术后住院时间、留置尿管时间、引流时间、术后Gleason评分、术后T分期、淋巴结是否阳性、切缘是否阳性、术后1个月是否达到尿控、术后1年是否达到尿控、术后1个月前列腺抗原(PSA)值、术后辅助治疗方案、术后随访时间、目前PSA值、以及目前是否发展为去势抵抗性前列腺癌(CRPC)。出血量是麻醉表记录的患者术中出血量。Gleason评分系统是基于在相对较低的显微放大倍数辨别前列腺肿瘤类型的评分系统;结构模式的辨别并将分级归类到级别1~5;分数为最常见和最高级别的类型相加[6]。尿控的定义为每天不使用或只使用一个尿垫[7]。去势抵抗性前列腺癌(CRPC)的定义为持续内分泌治疗下,血清睾酮达到去势水平(<50 ng/dl),但间隔1周,连续3次PSA上升,较最低值升高50%以上[8]。目前PSA值和目前是否发展为CRPC是指最近一次随访为2020年6月时,患者的血清PSA值以及是否发展为CRPC。
1.5 统计学方法
运用SPSS 19.0统计学软件进行数据分析。计量资料采用四分位数M(Q1,Q3)表示。计数资料采用例数表示。采用Mann-Whitney U检验,比较术前PSA值和术后1个月PSA值有无显著性差异。P<0.05为差异有统计学意义。
2 结果
2.1 患者的术前临床指标
入组6例患者的中位年龄66.5岁,中位体重指数22.8 kg/m2,穿刺时中位PSA值22.8 ng/ml,中位Gleason评分9分。所有患者穿刺确诊时均为多发转移性前列腺癌,经中位时间15个月的辅助治疗后,术前中位PSA值降低为0.66 ng/ml,术前中位转移灶数量减少为1处。6例患者的具体资料见表1。
2.2 患者的术中及术后临床指标
6例患者由经验丰富的医生行腹腔镜前列腺根治性切除术,均顺利完成,无中转开放。从表2中可以看出,所有患者无1例大出血,均顺利拔管出院,手术具有安全性;术后病理局部晚期(≥T3b)患者达50%;33.3%的患者术后淋巴结阳性及切缘阳性;83.3%的患者术后1年达到尿控;平均随访29.5个月,有1例患者发展为CRPC。除病例3术前及术后PSA均为0外,其余5例患者术后1个月PSA均较术前有所下降(中位数分别为0.02 ng/ml和0.66 ng/ml),差异有统计学意义(Z=-2.019,P=0.043)。
3 讨论
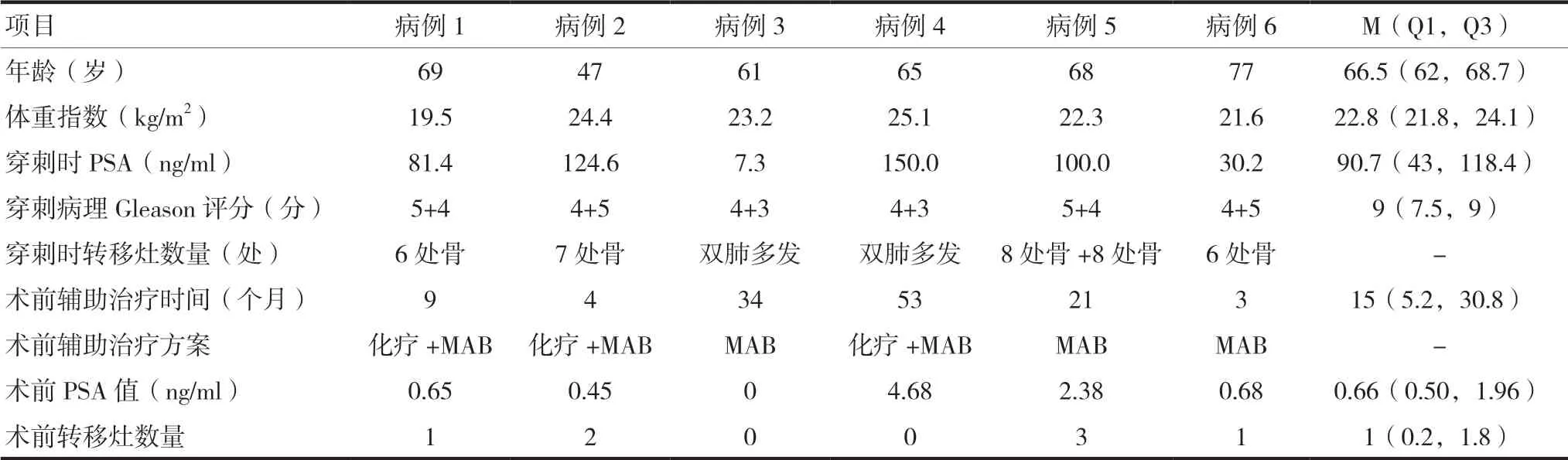
表1 患者的术前临床指标
前列腺癌是老年男性常见的泌尿系统肿瘤。2015年我国的城市男性中,前列腺癌的发病率和死亡率位于所有肿瘤的第6位和第9位[9]。虽然前列腺特异性抗原(PSA)已广泛应用于临床,但是我国的一项多中心研究显示多数患者初诊时已经是中晚期前列腺癌,总体预后远差于西方国家[10]。前列腺癌远处转移最常见的部位是骨骼,其次是肺、肝脏等。寡转移的概念最早由Hellman和Weichselbaum提出[11]。寡转移的数目和部位目前有所争议。有的学者认为转移灶≤5处属于寡转移,也有学者认为寡转移数目应≤3处[12]。2017年前列腺癌专家共识会议上,大多数学者认为寡转移指骨和淋巴结转移,也有学者认为内脏转移仍属于寡转移[13]。在前列腺癌转移灶诊断方面,前列腺特异膜抗原(PSMA)-PET/CT要更具有优势[14]。本研究纳入的病例第1例和第4例行骨扫描未提示多发转移,后行PET-CT证实。对于经济状况较好的患者,推荐行PET/CT检查,有助于更加准确的疾病分期。本研究中纳入的所有患者初诊时,通过骨扫描、CT和(或)PET/CT确诊为多发转移。经辅助治疗后,患者的转移灶减少或者消失,为寡转移前列腺癌或者局限性前列腺癌。
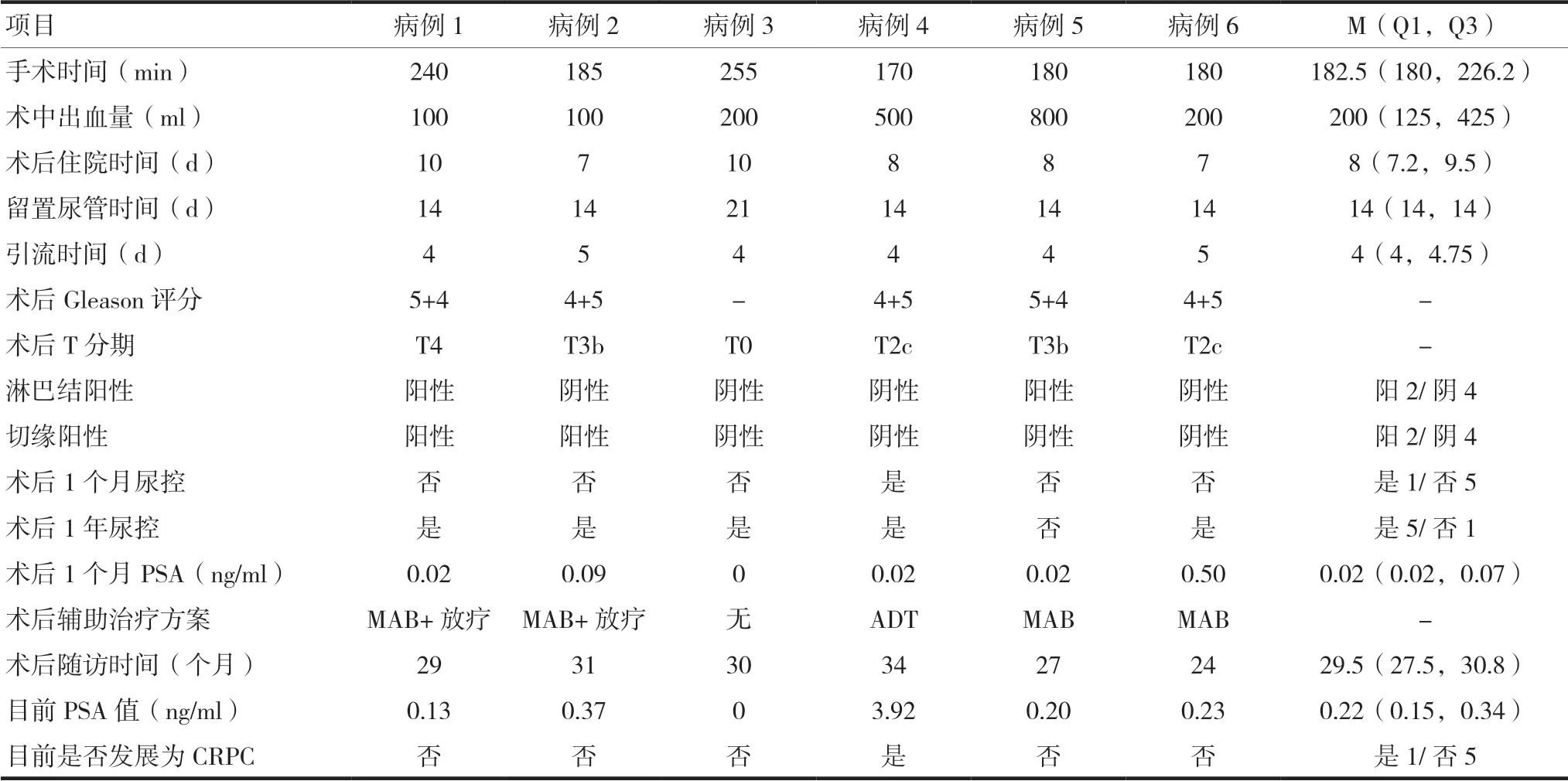
表2 患者的术中及术后的临床指标
近年来,一些前瞻性研究和大样本回顾性研究分析发现,对于寡转移性前列腺癌行局部治疗能给患者带来生存获益[15-17]。本研究患者预期寿命均大于10年以上,年纪最大的患者77岁,但是该患者无基础疾病,身体状况良好。对于预期寿命小于10年的患者,减瘤性手术不能给患者带来最大的收益;患者基础疾病多,身体状况差,麻醉和手术的风险也相应增大,给患者带来的风险小于收益,故对于这部分患者不推荐减瘤性手术。而且对于多发转移性前列腺癌,目前大多数学者的治疗方案还是采用内分泌治疗、化疗以及免疫药物保守治疗,术前需要和患者交代清楚,以减少不必要的医患纠纷。本研究是回顾性研究,术前新辅助治疗的时间跨度大,最短的3个月,最长的53个月。新辅助治疗一般有固定疗程,但在实行过程中需要检测病灶对治疗的反应,以便及时调整方案。第4例和第5例患者初诊时的治疗方案就是全雄激素阻断内分泌治疗,治疗效果满意,PSA逐渐下降<0.02 ng/ml,转移灶消失。但是,随着时间的延长,这2例患者PSA上升>2 ng/ml,此时患者才寻求更换治疗方案,进而行CRP手术治疗。新辅助治疗后,局部晚期的前列腺癌病灶可以缩小,降低了手术难度。本研究发现,部分局部晚期的患者前列腺直肠间隙消失,通过新辅助治疗,前列腺与直肠前壁的脂肪层可见。对身体良好的多发性转移性前列腺癌患者,减瘤性手术的时机应根据患者定期复查的结果来确定,即检查提示转移灶减少至5个以下或消失,并且核磁等检查预估前列腺病灶可切除时。
前列腺癌的局部病灶治疗,除了减瘤性手术,也可以考虑行经尿道前列腺电切(TURP)、125I粒子植入或外放疗。QI等比较了TURP联合内分泌治疗(ADT)激素敏感的转移性前列腺癌(mHSPC),患者的总体生存时间要显著优于单纯ADT治疗[18]。张晓光等报道125I粒子前列腺组织植入近距离放射治疗联合全雄激素阻断(MAB)治疗寡转移性前列腺癌患者的无进展生存,优于单纯全雄激素阻断治疗[19]。Parker等对2061例转移性前列腺癌患者3期临床研究发现,在患者的总生存(OS)方面,外放疗(RT)联合ADT治疗组要优于单纯ADT治疗组,提高了8%,并且外放疗相关的副作用发生率低[20]。本研究纳入的6例患者均采用腹膜外途径的腹腔镜前列腺全切术,均顺利完成手术,手术成功率基本等同于局限性前列腺癌的前列腺癌根治术。但是,由于肿瘤分期的原因,难度较大,手术需要均有经验丰富的医师操作。对于这部分患者的手术经验是,分离膀胱颈部时很难做到“樱桃小口”,也不必追求,可以早期打开膀胱,根据肿瘤的范围、前列腺突入膀胱的形态、以及输尿管口位置等,直视下切除,然后重建膀胱颈部;肿瘤与直肠关系密切时,从前列腺底部向尖部分离困难,则先游离尖部和两侧相对容易分离的地方,顺行逆行相结合,不断旋转暴露粘连,锐性分离将前列腺切除,手术结束时检查直肠有无破损。这类患者的手术是减瘤性手术,很难做到根治,如损伤周围重要脏器,给患者带来的是弊大于利。因此,对于肿瘤侵犯范围大的患者,术中宁可切缘阳性,也尽量避免损伤输尿管口、直肠等周围重要的器官。可能是病例数相对较少,本研究未出现直肠损伤的患者。崔波等报道了14例寡转移性前列腺癌行腹腔镜根治术的患者中,发生1例直肠损伤,术前常规清洁灌肠,术中一期修补,采用0号薇乔线连续缝合后再行浆肌层加固,留置肛管行直肠充气试验未见气泡,术后愈合良好[21]。研究发现,中高危前列腺癌发生淋巴结转移的风险为15%~40%,建议进行盆腔淋巴结清扫[22]。本研究纳入的6例患者为转移性前列腺癌,淋巴结转移的风险更高。有学者认为,对于中高危前列腺癌应行扩大盆腔淋巴结清扫(ePLND)[23]。考虑到手术时间和扩大清扫带来的副作用,本研究中采用标准的盆腔淋巴结清扫,淋巴结阳性率33.3%(2/6例)。本研究较高的切缘阳性率可能与肿瘤分期偏晚有关,与Sooriakumaran报道转移性前列腺癌手术并发症的Meta分析结果基本一致[24]。尿失禁是前列腺根治性手术术后常见的并发症。本研究的患者术后1个月尿控16.7%,1年的尿控达83.3%,和局限性前列腺癌根治手术基本相似[25]。
本研究中病例3术后至今随访了30个月,一直未使用任何辅助治疗,病情控制满意;其余患者术后继续使用内分泌治疗。病例1和病例2由于切缘阳性,术后即刻使用内分泌治疗,并且术后半年辅助外放射治疗。6例患者中,只有病例4于术后34个月发展为CRPC,其余5例患者截至目前PSA控制满意。而且,病例4患者CRP术前PSA为4.68 ng/ml,当时已经发展为CRPC。该患者行CRP术后1个月时PSA降至最低点,达0.02 ng/ml。术后34个月,该患者的PSA逐渐上升至3.92 ng/ml,但仍低于术前的4.68 ng/ml。因此,CRP手术将此患者的病程延长了至少34个月。有研究报道,转移性激素敏感性前列腺癌单纯ADT治疗,发展为CRPC的中位时间为17.5个月(3.0~30.7个月),多西他赛化疗联合ADT治疗后发展为CRPC的中位时间为24.4个月(7.5~31.3个月)[26]。本研究中的病例平均术后随访29.5个月,只有1例发展为CRPC,效果要优于单纯ADT治疗和化疗联合ADT治疗。Patrikidou等报道了约78%的转移性前列腺癌患者出现盆腔疼痛、血尿、尿潴留等局部症状[27]。对于转移性前列腺癌伴有局部症状的患者,也可以考虑行前列腺根治性切除术。本研究中病例1就是以盆腔疼痛、尿潴留为主要症状,留置尿管后盆腔疼痛没有任何缓解,行前列腺根治性切除后患者症状消失,生活质量明显改善。
本研究也存在一些不足。①虽然目前大多数学者认为寡转移前列腺癌的手术治疗能给患者带来获益,但是对于多发转移前列腺癌新辅助治疗后转移灶减少或者消失,是否可以认为是降期,成为寡转移性前列腺癌,目前没有明确的定义。因此,本研究纳入的病例数偏少,研究的目的是进行初步的探讨,以指导将来更大样本量病例的临床研究。②本研究的对照组应为多发转移性前列腺癌新辅助治疗后转移灶减少或消失、但未行手术治疗的患者。但是,和接受手术的患者相比,临床上不接受手术治疗的这部分患者往往预期寿命短,或者合并基础疾病多,容易导致病例选择偏倚。因此,本研究并未设立对照组,而是将结果在讨论中和其他学者的研究结果相比较。③本研究的随访时间偏短,无患者死亡,无法得到患者的总体生存率(OS),还需更长时间的随访。
对于新辅助治疗后转移灶减少或消失的转移性前列腺癌患者,选择合适的病例,由经验丰富的医生实施减瘤性根治性前列腺切除术,具有安全性;减瘤性根治性前列腺切除术能否给患者带来生存获益仍需进一步的研究。

