计算化学在基础教育的创新应用
苌青 刘健

摘要:采用实验探究和计算模拟相结合的教学模式,将“一种金属与多种盐溶液反应”或“多种金属与一种盐溶液反应”的体系模型化,浅显直观地展示了该过程中各种反应是同时进行的,只是由于活动性差异、离子扩散和原电池效应的共同作用产生了“优先性”的效果。模型真实地再现了微粒间相互作用的动态过程及体系的动态平衡,直接观察到充分反应后固体和溶质的微粒种类,生动形象地呈现了析出固体枝状结构的形成过程。
关键词:金属活动性;置换反应;计算模拟;初中化学
文章编号:1005-6629(2021)04-0093-05 中图分类号:G633.8 文献标识码:B
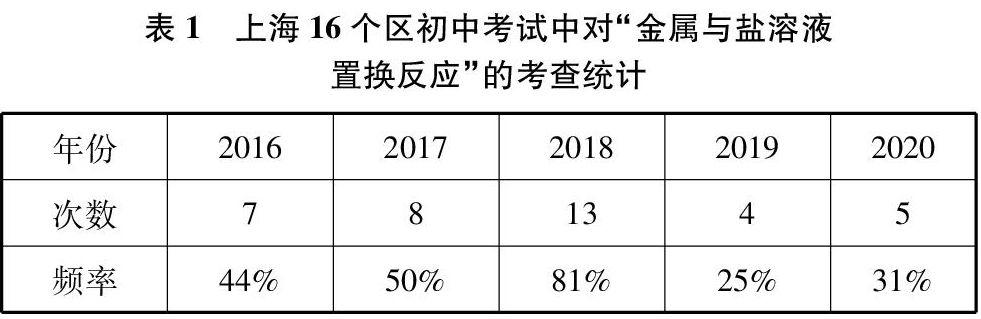
在金属活动性顺序的应用中,金属与金属盐溶液的置换反应是初中化学的重点及难点。对于简单的一种金属与一种金属盐溶液的反应体系,通过宏观的实验现象如“将锌片置于硫酸铜溶液中观察到有红色固体析出”,可得出活动性Zn>Cu。近年上海市初中考试中,关于“金属与盐溶液置换反应”会涉及到较复杂的两种题型:一种金属与多种盐溶液反应,或者多种金属与一种盐溶液反应,见表1。
这两类题型涉及的实际反应过程过于复杂,通常解决此类问题的方法为基于文字描述的简单逻辑推理,如“金属与盐溶液反应时,最活泼的金属优先与最不活泼的金属盐溶液进行反应,且该反应一定发生,生成物一定存在”。通过实际的教学过程发现,学生虽然掌握了这些解题方法和技巧,但对此类化学反应本质的理解还是模糊的。这些简化的分析方法也跟学生在实验室中观察到的宏观现象不完全一致。这是因为,虽然描述为“活动性A>B>C,所以A优先于B和C+发生反应,或A优先和C+而非B+反应”。但真实的情况是,所有反应是同时进行的,只是由于活动性差异(反应速率的快慢)、金属的量不同或电子的移动(原电池效应)的共同作用产生了“优先性”的效果。为了促进学生对化学反应本质的深入理解,更直观地获得关于化学反应宏观规律的认识,我们利用计算化学将“金属与盐溶液”的反应过程模型化,并同实验室中的宏观现象作比较,真实地再現了微粒间相互作用的动态过程。
计算化学是最近迅猛发展的前沿技术学科,已成为除实验和理论之外的第三大支柱。计算化学模拟不同于现在应用比较广泛的将计算机作为展示结构的工具,是指在计算机上搭建真实世界中的分子模型并进行特定的计算和演化,类似于在计算机上构造一个简化的真实世界。通过计算模拟将体系模型化,从微观和动态层面展现固体和溶液中微粒的排列方式和运动行为。我们将计算化学的模拟技术引入到初中化学课堂进行拓展性教学,设置教学环节从实验探究到计算模拟。这种教学模式以宏观反应现象指向微观粒子运动,又通过微观粒子运动加深对宏观反应规律的理解,不过多涉及分子结构但又从微观层面体现化学反应的本质是原子的重新组合,充分认识化学现象与模型之间的联系,深刻理解化学反应的本质。同时通过动态反应过程的呈现,使学生感受到化学体系一直处在动态平衡中,建立变化与平衡的思想。
2020年新冠疫情期间,全国各地中学校均延缓了学生返校,“停课不停学”以线上的方式开展教学。然而学生在家中无法进行往常只有在学校的实验室中才能完成的实验操作,难以对书本中一些抽象的化学概念和思维加以形象化的理解。本文提到的计算化学模拟技术,相当于在计算机上进行的化学实验,以其方便、安全、易操作的特性可以作为线上教学的补充。
1研究内容
我们将编写的一个计算模拟程序用于“金属与盐溶液”的拓展教学部分。程序中构建了一个溶液空间并放置一定数目的不同种类的金属固体和金属离子。根据微观的物理化学特性和计算模拟的原理,设定不同微粒的运动和转化方式,使各个离子可以做随机的热运动,并在离子接触到金属固体之后根据活动性顺序发生置换反应。程序可以设定金属和金属离子种类(活动性差异)、数量(少量或过量)、反应时间等,运行后就在模拟设定的算法中进行,重现真实的微观动力学规律,自动得到符合真实世界物理和化学规律的运动结果。因此可以按顺序进行拓展研究,使学生认识到“一种金属与多种盐溶液”或者“多种金属与一种盐溶液”的真实化学反应并没有先后顺序,其宏观现象是由微观粒子的运动所叠加而形成的统计效应。
下面是对比较典型的三类置换反应所进行的计算化学拓展教学的案例,采用的教学形式为:实验探究→计算模拟→归纳总结。
1.1案例1:一种金属与一种盐溶液反应
首先,在实验探究的教学环节中以趣味实验的形式让学生制作“美丽的铜树”。实验过程为将锌片置于滤纸上,再往滤纸上逐滴滴加硫酸铜,可以观察到锌片周围有红色固体析出,以枝状结构生长为美丽的“铜树”,见图1。进一步提出问题:“铜树”的生长原理是什么?为什么析出的固体是枝状结构?
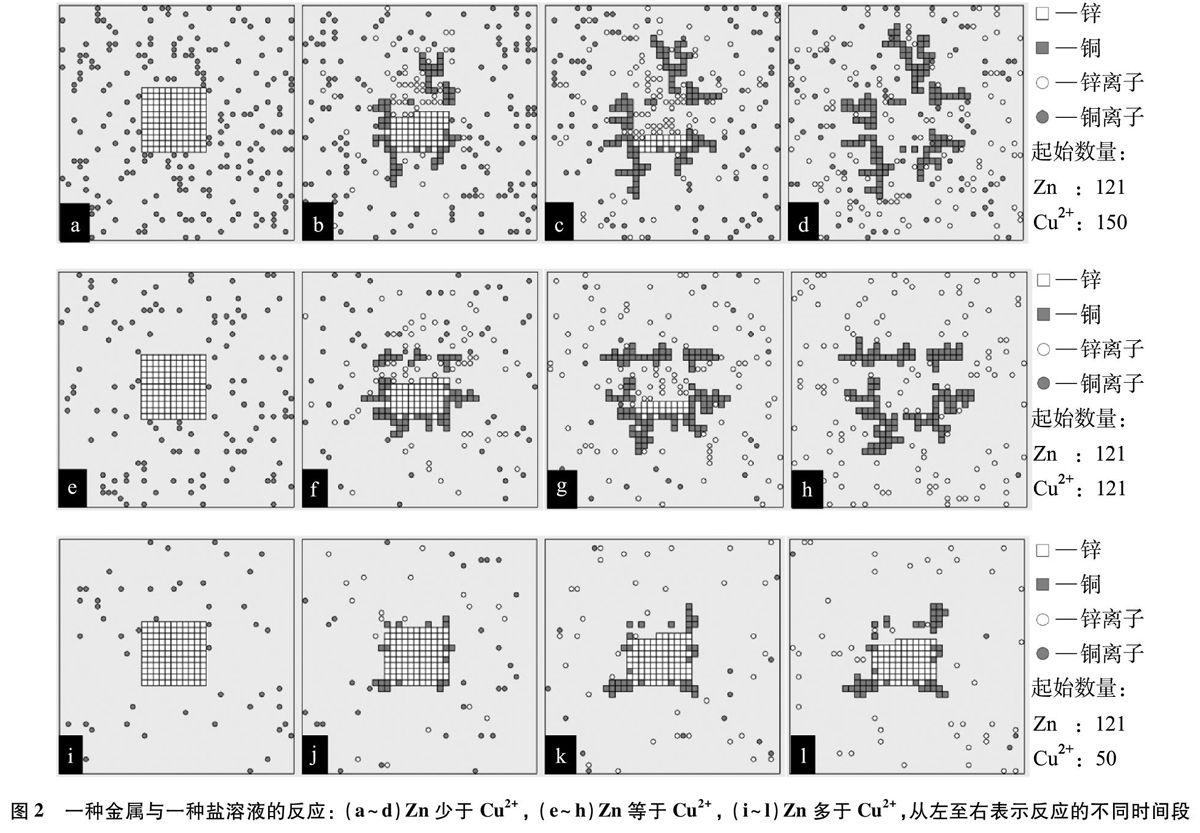
在本文涉及的计算化学模拟中,将溶液体系模型化,如图2所示。方形边框代表反应容器,图中方块“口”和“■”代表金属,圆圈“○”和“●”代表自由移动的金属离子,不同颜色代表不同的金属元素,略去了不参与反应的酸根离子。在这里基于此模型达到了对离子概念的简化,不涉及离子的具体形成而展示了微粒问的反应。这是计算模拟所实现的一个非常巧妙的过渡,符合初中学生的认知水平。
启动程序,开始时块状的金属锌口放置在容器中间,并在周围随机放置若干个铜离子●,见图2a。运行程序,铜离子不停地在溶液中作无规则运动。当铜离子接触到锌时,锌原子转变为自由移动的锌离子形态,铜离子转变为单质铜并停止运动。当铜离子间接碰到的是金属铜原子时,会由于金属中电子的自由移动(即“原电池效应”),一个金属锌原子也会变为自由移动的锌离子形态,铜离子转变为单质铜并停止运动。
本程序考察了铜离子数量不同,即活泼金属锌相对铜离子少量、适量、过量的不同情形:
(1)当锌少量时,一部分铜离子被置换出来。充分反应后过滤,滤渣中只有铜,滤液中有锌离子和铜离子(图2a~d)。通过动态的反应过程直观地呈现了图1b中宏观实验现象“铜树”的形成原因。
(2)当锌适量时,锌恰好将溶液中的铜离子完全置换出来。充分反应后过滤,滤渣中只有铜,滤液中只有锌离子(图2e~h)。
(3)当锌过量时,铜离子完全被置换出来。充分反应后过滤,滤渣中是锌和铜的混合物,滤液中只有锌离子(图2i~1)。
1.2案例2:一种金属与多种盐溶液反应
在实验探究的教学环节中,以趣味实验的形式学生先做了锌与硝酸铜、硝酸银混合溶液在滤纸上的反应,能观察到红色固体和银白色固体同时析出,见图3。然后提出问题:锌与硝酸铜和硝酸银的反应原理是怎样的?涉及到的反应是如何进行的?
实验中红色固体和银白色固体的同时析出表明各种反应都是同时进行的,通过我们模型化的体系可以直接观察到反应的动态过程和反应达到平衡时的微粒运动结果,深入理解金属与盐溶液的反应机理,见图4。
设置溶液是铜离子●和银离子●的混合溶液,加入固体锌口,见图4a。运行程序,动态反应过程中可观察到锌是同时和铜离子、银离子反应的,由于活动性差异(反应速率的快慢)、金属的量不同以及电子的移动(原电池效应)的共同作用,最终滤渣和滤液中的微粒种类和数量不同:
(1)当锌少量时,锌同时和铜离子、银离子反应(图4a~d),但锌置换银离子的反应速率比锌置换铜离子的反应速率快(图4b),且被锌置换出来的金属铜在接触到自由移动的银离子后继续反应,重新變成铜离子在溶液中作无规则运动(图4c)。充分反应后过滤,滤渣中只有银,滤液中有锌离子、铜离子(图4d)。
(2)当锌的量介于置换出所有银离子后还能置换一部分铜离子时,动态反应过程可以观察到铜和银同时析出,但由于铜和银离子不共存,会再次反应,直至银离子完全被置换,析出的铜才会稳定存在。充分反应后过滤,滤渣中是金属铜和银的混合物,滤液中有锌离子和铜离子(图4e~h)。
(3)当锌过量,锌同时和铜离子与银离子反应,在银离子以较快的速率被完全置换后,析出的铜才会稳定存在。充分反应后过滤,滤渣中是金属锌、铜、银的固体混合物,滤液中只有锌离子(图4i~1)。
1.3案例3:多种金属与一种盐溶液反应
如图5所示,实验探究环节将锌丝和铁丝放在滤纸上,在锌丝和铁丝中间的位置逐滴滴加硫酸铜溶液(图5a)。实验过程中,能明显观察到锌丝和铁丝周围都有红色固体析出,但锌和硫酸铜的反应速率要比铁和硫酸铜的反应速率快很多(图5b)。然后提出问题:锌和铁与硫酸铜溶液的反应原理是怎样的?涉及到的反应是如何进行的?
实验中红色固体同时析出的现象表明反应是同时发生的,只是速率不同。所涉及到的具体反应可以通过模型化的体系来动态展示。设置将锌□和铁▓同时放置到铜离子●的盐溶液中:
(1)当锌和铁的量都大于溶液中铜离子的量时,锌和铁同时与铜离子发生反应(图6b),但活动性较强的锌与铜离子的反应速率较快,铁与铜离子的反应速率较慢(图6c),基于此模型可以生动地观察这一动态反应过程。同时从充分反应后铁原子的位置变动也可以得出:即使较活泼的金属锌过量,铁也同时与铜离子反应,只是铁离子由于与锌不共存会重新析出。充分反应后过滤,滤渣中是固体锌、铁、铜的混合物,滤液中只有锌离子(图6d)。
(2)当锌和铁的混合物中锌的量恰好等于溶液中铜离子的量时,动态反应过程同上。充分反应后,锌恰好被完全反应,过滤,滤渣中是固体铁和铜的混合物,滤液中只有锌离子(图6e~h)。
(3)当锌和铁的总量与溶液中铜离子的量恰好相等时,动态反应过程同上。由于锌与铜离子的反应速率较快,锌优先被完全反应(图6k),然后铁继续和铜离子反应,此时铁离子可以稳定存在于溶液中。充分反应后,锌和铁恰好被完全反应,过滤,滤渣中只有固体铜,滤液中是锌离子和铁离子(图6i~1)。
(4)若锌和铁的总量小于溶液中铜离子的量时,动态反应过程同上。充分反应后过滤,滤渣中只有固体铜,滤液中是锌离子、铁离子和铜离子(图6m~p)。

