兰州百合病毒RT-PCR检测技术建立及应用
王红梅 王立光 刘新星 李淑洁 石有太 李忠旺
摘要:病毒病是引起兰州百合产量下降、品种退化的主要原因,准确、高效的病毒检测技术在百合脱毒种球生产和推广应用中十分重要。根据CMV、LSV和LMoV病毒外壳蛋白基因序列设计引物,以百合18S rRNA为内参照,建立兰州百合病毒RT-PCR、二重RT-PCR检测体系。对兰州百合主栽区病毒病的抽样调查发现,CMV、LSV带毒率分别达到98%、100%,LMoV检出率在不同时期样品中存在较大差异。
关键词:兰州百合;病毒检测;反转录-聚合酶链式反应;病毒病调查
Abstract:Virus disease is the main cause of yield decline and variety degradation of Lilium davidii Var. unicolor. It is very important to master efficient virus detection technologies in the production of virus-free bulb seedball and planting period. The PCR primers were designed according to the sequences of CMV, LSV and LMoV virus coat protein genes, and the virus detection system of RT-PCR and double RT-PCR was established with lily 18S rRNA as internal reference in this study. The results showed that sampling survey of Lilium davidii Var. unicolor. virus disease in main planting area, CMV and LSV were 98% and 100% respectively, and detection rates of LMoV were different in different periods samples.
Key words:Lilium davidii Var. unicolor; Virus detection; RT-PCR; Virus survey
蘭州百合(Lilium davidii Var. unicolor)属百合科(Liliaceae)百合属(Lilium)多年生球根类草本植物,是兰州市最具特色的名优特农产品之一,为中国国家地理标志保护产 品[1 ],2014年“兰州百合”被国家工商总局认定为“中国驰名商标”[2 ]。兰州百合因鳞茎瓣大肉厚,色泽洁白如玉,味醇香甜,营养丰富,药食同源,素有“兰州百合甲天下”之美誉[3 ]。与其他旱地农作物相比,兰州百合在经济效益上有着明显的优势,2016年仅兰州市七里河区西果园百合种植面积0.38万hm2,产量0.197万t,实现产值达8.36亿元。兰州百合多年来靠对自然生长的母籽进行繁育, 种球退化导致兰州百合产量下降,尤其病毒病是引起兰州百合产量下降、品种退化的主要原因[4 ],准确、高效的病毒检测技术在百合脱毒种球生产中十分重要。近年来兰州百合种植规模不断扩大,但由于种源退化问题引起百合产量不稳定、品质良莠不齐、价格大幅度波动、市场萎缩等现象,严重制约了兰州百合产业持续发展。生产用百合种球繁殖通过籽球、鳞片扦插等方式进行, 而长期的无性繁殖极易造成病毒病害的传播和积累, 一般发病率在65%~70%,二代种球的带病率在95%以上[5 ]。百合感染病毒后终身带毒,病毒侵入会破坏植株正常的生理机制,出现花叶、矮化、畸形、坏死等症状,致使生长衰弱、产量下降、品质变劣、种性退化,一般种植2 a后失去商品价值[6 ]。植物病毒分布广、繁殖快、防治难,有植物“癌症”之称。据统计,全世界每年因病毒病导致的粮食作物损失高达200亿美元,经济作物因病毒病造成的损失每年高达600亿美元[7 - 8 ]。据调查,浸染百合的病毒种类有20多种,危害兰州百合的主要病毒有黄瓜花叶病毒(Cucumber mosaic virus, CMV)、百合无症病毒(Lily symptomless virus, LSV)、百合斑驳病毒(Lily mottle virus, LMoV)3种[9 - 10 ]。目前,生产和应用脱毒种球是控制兰州百合病毒病的有效途径,而准确、高效的病毒检测手段是百合脱毒种球生产环节的核心技术。
植物病毒检测方法主要有生物学检测法、电子显微镜法、血清学检测法和分子生物学方法等,不同方法在时效性、可操作性、准确性、灵敏度等方面各有优缺点。RT-PCR技术因特异性强、灵敏度高、简便快速等优点,近年来在百合病毒检测方面得到了一定的应用[9 - 12 ]。由于研究材料来源和试验条件的不同,我们早期曾借鉴前人的研究成果用于兰州百合病毒检测,但出现PCR扩增片段大小与预期不符,或者无扩增产物等问题。我们又以兰州百合主栽区病毒病危害严重的植株为材料,根据CMV、LSV和LMoV病毒外壳蛋白基因保守序列设计并合成引物,以百合18S rRNA为参照,改进了兰州百合RT-PCR病毒检测技术体系,以期为百合脱毒种苗和种球的生产以及田间病毒病调查研究提供技术支持。
1 材料与方法
1.1 材料来源
供试兰州百合分别从主栽区七里河区西果园乡、榆中县园子岔乡和永靖县关山乡采集。田间调查发病情况,选取发病严重的植株采集新鲜叶片,保存于液氮中带回实验室用于RNA提取。
1.2 试验方法
1.2.1 总RNA的提取 称取0.15 g 百合叶片在液氮中研磨。RNA提取按照天根生化科技有限公司生产的DP441 RNAprep Pure 多糖多酚植物总RNA提取试剂盒说明进行,用1.2%琼脂糖凝胶电泳检测提取效果;RNA反转录参照天根 KR116 FastKing cDNA第一链合成试剂盒说明进行,RNA和cDNA浓度和质量检测在超微量分光光度计NanoDropTM ONE上进行。采用RNase-Free ddH2O将样品cDNA稀释到50 ng/uL,-20 ℃保存备用。
1.2.2 引物设计 根据NCBI Genbank登录的百合CMV、LSV、LMoV病毒外壳蛋白基因序列和百合18S rRNA基因序列保守区段,应用Primer premier 5.0 软件和Oligo 6.22软件设计引物,分别设计CMV引物4对、LSV引物3对、LMoV引物5对。百合18S rRNA引物参照张玉宝等[11 ]的方法,引物委托北京Invitrogen生物技术有限公司合成。
1.2.3 RT-PCR、多重RT-PCR扩增与产物检测 首先采用百合18S rRNA引物进行扩增,PCR扩增体系为15 μL:模板cDNA 0.5 μL(25 ng),2×Taq PCR MasterMix(中科瑞泰北京生物科技有限公司)7.5 μL,上下游引物各1 μL(10 μmoL/L),ddH2O 5 μL。PCR反应程序为:94 ℃预变性4 min,94 ℃变性30 s,42~60 ℃梯度退火30 s,72 ℃延伸40 s,34个循环;72 ℃延伸10 min,4℃保存。PCR反应在BIO-RAD T100TM型扩增仪中进行,PCR产物采用1%琼脂糖凝胶电泳检测,1×TAE缓冲液,100 V稳压电泳大约30 min,采用BIO-RAD ChemiDoc XRS+凝胶成像系统观察结果。
通过上述方法对PCR反应体系和反应程序优化,确定不同引物退火温度,筛选出特异性高、稳定性好、PCR產物电泳条带亮度强的引物。选择使用退火温度一致、扩增片段差别较大的引物建立多重PCR,PCR扩增体系为30 μL:模板cDNA 1 μL(50 ng),2×Taq PCR MasterMix(中科瑞泰北京生物科技有限公司)15 μL,第1组上下游引物各1 μL,第2组上下游引物各1 μL,ddH2O 10 μL。PCR反应程序、产物检测与成像方法同上。
1.2.4 RT-PCR产物回收和测序 采用天根Universal DNA 纯化回收试剂盒对百合病毒RT-PCR产物进行回收,回收产物与T载体连接、转化大肠杆菌感受态,挑取阳性克隆,送金唯智生物科技有限公司进行测序,测序结果采用NCBI Blast软件进行同源性比较分析。
1.2.5 田间病毒病调查 在兰州百合苗期(5月中旬)和植株停止生长期(9月上旬),从百合主栽区(西果园乡、园子岔乡、关山乡)不同田块,随机各选取50株百合采集叶片,保存于液氮中带回以备检测。
2 结果与分析
2.1 百合叶片总RNA提取
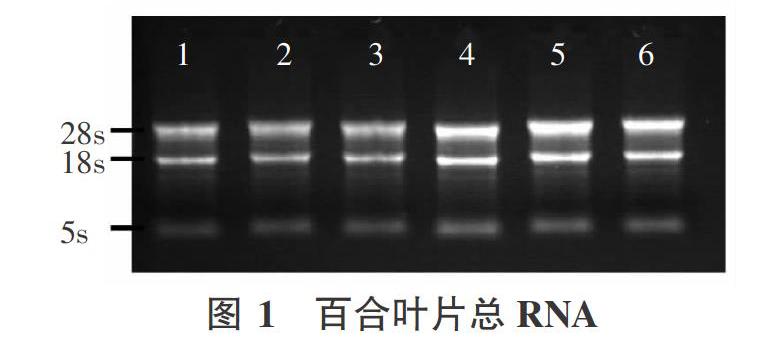
百合叶片总RNA提取后,采用超微量分光光度计测定了波长230、260、280 nm下的吸光度,吸光值OD260/OD280在1.8~ 2.1范围内,说明提取的RNA蛋白或其他有机溶剂基本去除干净;OD260/OD230>2.0,表明无异硫氰酸胍残留。琼脂糖凝胶电泳检测RNA结果显示,28S和18S条带清晰亮度强,5S条带较弱(图1),无拖尾现象,表明 RNA完整性较好,符合下一步RNA反转录试验要求。cDNA第一链合成后采用超微量分光光度计测定了浓度,浓度范围800~ 1 000 ng/uL内,完全能够满足PCR扩增需求。
2.2 百合病毒特异性引物筛选
以百合18S rRNA引物作为内参照,对cDNA进行扩增,产物出现了大约300 bp的目标片段(图2),证明提取的百合RNA质量可信。进一步通过采用梯度PCR和调整反应程序,从设计的百合CMV、LSV、LMoV三种病毒引物中,筛选到了5对目标条带清晰、重复性好的特异性引物可用于百合病毒检测(表1)。
2.3 百合病毒多重RT-PCR体系建立
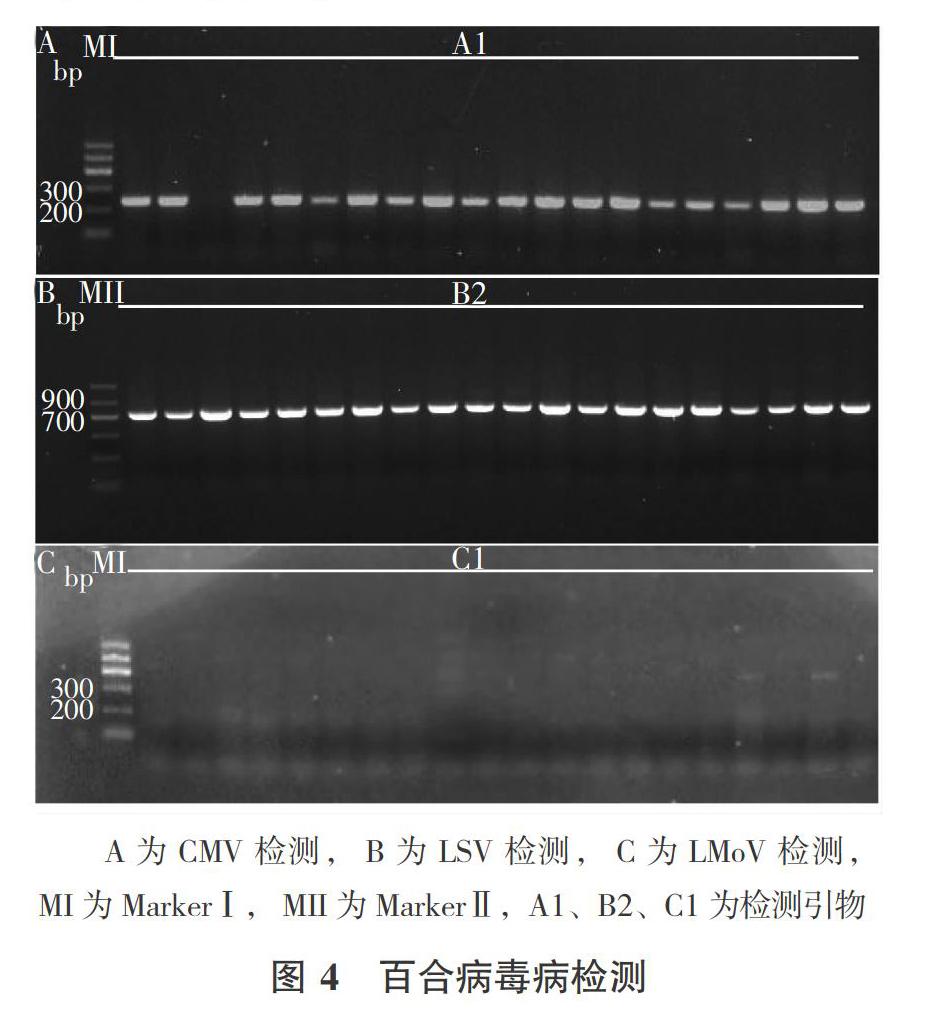
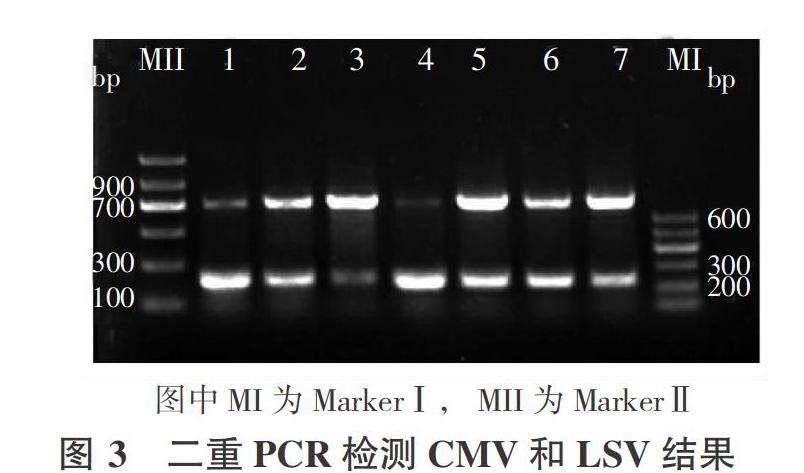
以前期建立的单重RT-PCR体系为基础,综合考虑各引物退火温度、目标片段大小和条带清晰度等因素组配多重PCR,扩大PCR反应体系到30 uL,在退火温度为58 ℃时引物A1和B2在同一反应体系中扩增,电泳检测显示两条清晰的扩增片段,与预期736 bp的LSV和248 bp 的CMV片段大小相相吻合(图3),说明该二重PCR具有较高的特异性,可用于兰州百合CMV、LSV病毒检测研究。LMoV引物C1扩增产物(252 bp)与CMV(248 bp)、18S rRNA(303 bp)的PCR产物片段大小接近,电泳条带难以区分,还需要设计更为理想的引物。
2.4 RT-PCR产物序列分析
对百合病毒CMV、LSV、LMoV PCR扩增片段测序,测得全长序列分别为248、736、252 bp,与预期长度一致。采用NCBI Blast软件进行基因序列比对分析,发现CMV序列与与已报道的11个百合病毒序列同源性达98%,LSV序列与已报道的14个百合病毒序列同源性达99%,LMoV序列与8个百合病毒序列同源性达97%。序列比对同源性很高,说明本研究设计合成的引物扩增得到的基因片段确为百合CMV、LSV 和LMoV,这些引物可用于百合病毒检测。
2.5 兰州百合病毒病田间发生情况
于5月中旬和9月上旬从兰州百合主栽区取样,分别以A1、B2和C1引物进行PCR扩增,结果显示,CMV、LSV检出率在两批样品之间没有明显差异,合计检出率分别为98%、100%,说明CMV和LSV感染率非常高,是浸染兰州百合的主要病毒。LMoV在5月中旬的样品中带毒率为80%,在9月初已停止生长、近乎枯萎的样品检出率为16%,LMoV检出率在不同时期样品中存在较大差异(图4)。
3 结论与讨论
根据genbank登录的百合病毒外壳蛋白基因序列设计新的引物,筛选出重复性好、能特异性检测CMV的引物2对、LSV引物2对、LMoV引物1對,可用于兰州百合病毒检测。优化的PCR反应体系和反应条件是保证RT-PCR扩增成功的关键。本研究采用2×Taq PCR MasterMix,通过试验确定模板cDNA和引物浓度,设置温度梯度筛选适宜的引物退火温度。在保证每一对单独引物与模板能够特异性地产生产物的基础上,根据退火温度接近、具有高度特异性的目标片段,且不同扩增片段能有效区分的原则建立多重PCR体系。最终CMV引物A1和LSV引物B2在同一PCR反应体系中得到了特异性扩增,取得了与预期片段大小一致的扩增产物。二重RT-PCR技术的建立,可提高兰州百合CMV和LSV检测效率、降低试验成本,具有一定的实际应用价值。
研究结果表明,兰州百合田间病毒病CMV、LSV检测结果在2批样品之间没有明显差异,检出率分别为98%、100%,说明兰州百合主要感染病毒为CMV和LSV,这与王发林等[13 ]的研究一致。LMoV检出率在不同时期样品中存在较大差异,5月中旬苗期样品检出率为80%,9月初已停止生长的样品检出率为16%,说明LoMV检出率与植株发育时期有关。百合病毒病发病程度与寄主生长周期呈正相关,其发生受多种条件影响,如温度、生长发育时期、传毒介体等,如温度是百合病害病发生有重要影响的环境因素之一[14 - 16 ]。有研究认为,气温在20 ℃以下时,百合发病程度较轻,但随气温升高百合发病程度不断加重,当气温达到35 ℃以上时病情开始减轻,并随着持续高温出现隐症现象[16 - 17 ]。百合苗期很容易感染病毒病,发病率和病情指数不断升高,在显蕾期发病率最高,病情指数也较高,在花期出现隐症现象[14 ]。一般植物病毒只有在寄主活体内才具有活性,仅少数植物病毒可在病株残体中保持活性几天或几个月,病毒入侵与植物调控生长发育进程以及生物和非生物应激反应的抗病毒机制有关[18 ]。因此,百合病毒检测率高低与病毒活性及对寄主入侵机制相关。
病毒病是无性繁殖植物的常见病害,其分布广、危害大, 且多为复合感染,主要通过蚜虫等昆虫媒介和土壤、机械损伤传播,传播速度快,有日益严重的趋势。植物病毒病防治方法主要有抗病毒育种、使用化学农药和推广应用脱毒种苗,但抗病育种存在基因资源匮乏、育种周期长、效率低下,使用化学药剂或生物制剂对植物病毒病尚不能进行直接有效防治[19 ]。因此,生产和种植脱毒种苗,进行“无毒化”栽培成为控制植物病毒病的主要措施,而准确、高效的病毒检测是把好种源关、实现“无毒化”栽培必不可少的首要环节。
参考文献:
[1] 国家质量监督检验检疫总局. 2004年第137号[EB/OL]. (2004-09-27)[2020-08-29]. https://law.lawtime.cn/d362330367424.html.
[2] 白贺兰, 乔德华. 兰州百合产业发展现状及优化升级对策[J]. 甘肃农业科技,2017(12):79-82.
[3] 新华网. “兰州百合”——坚持绿色发展. 打造地方品牌 [EB/OL]. (2017-09-27) [2020-08-29]. http://m.xinhuanet.com/gs/2017-10/25/c_112185321 3.htm.
[4] 周清泉. 兰州百合产业发展现状及对策[J]. 甘肃农业科技,2016(1):64-66.
[5] 张元英. 浅议兰州百合产量和品质下降问题[J]. 农民致富之友,2016(20):96.
[6] 赵祥云,王文和. 百合品种退化原因及国产种球繁殖与复壮技术[J]. 中国花卉园艺,2008(6):14-17.
[7] 迟惠荣,毛碧增. 植物病毒检测及脱毒方法的研究进展[J]. 生物技术通报,2017,33(8):26-33.
[8] BEL?魪N PIC?魷, MAR?魱A JOS?魪 D?魱EZ,FERNANDO NUEZ. Viral diseases causing the greatest economic losses to the tomato crop. I. -the tomato yellow leaf curl virus - a review[J]. Scientia Horticulturae,1996,67(3):117-150.
[9] 邹迎春,杨朝柱,覃大吉,等. 百合病毒的多重RT-PCR检测技术[J]. 湖北农业科学, 2013,52(20):5051-5053.
[10] 李 瑛,黄惠英,张金文,等. 兰州百合病毒多重PCR和ELISA检测体系的比较与应用[J]. 甘肃农业大学学报,2011,46(3):59-64.
[11] 张玉宝,谢忠奎,王亚军,等. RT-PCR方法同步检测兰州百合(Lilium davidii var. unicolor)两种主要病毒[J]. 武汉植物学研究,2010,28(6):744-749.
[12] 陳 进,李晓昕,袁 雪,等. 百合三种主要病毒的RT-PCR检测及脱毒技术研究[J]. 农业生物技术学报,2013,21(4):489-497.
[13] 王发林,古勤生,刘 芬,等. 兰州百合病毒病原的DAS-ELISA检测[J]. 云南农业大学学报,2003,18(4):106-107.
[14] 王仙芝,张延龙,牛立新,等. 秦巴山区六种野生百合感染3种病毒病鉴定及其田间抗病性初步评价[J]. 中国农业科学,2008(11):3618-3625.
[15] SZITTYA G,SILHAVY D,MLLNAR A,et al. Low temperature inhibits RNA silencing mediated defence by the control of siRNA generation[J]. The European Molecular Biology Organization Journal,2003,22(3):633-640.
[16]王小青,赵 志,蒋士君,等. 接种TMV的烟草高温胁迫后防御酶活性的变化[J]. 烟草科技,2006(12):51-54.
[17] 石延霞. 黄瓜霜霉病菌侵染模拟、致病机理和高温诱导抗病性的研究[D]. 哈尔滨:东北农业大学,2002.
[18] 钱礼超,刘玉乐. 植物抗病毒分子机制[J]. 中国科学:生命科学,2014,44(10):999-1009.
[19] 娄 虎,徐 熔,王海竹,等. 植物病毒病检测及防治的研究进展[J]. 江苏农业科学, 2017,45(24):25-31.
(本文责编:杨 杰)

