月桂酸单甘油酯对小鼠肠道菌群调节作用的时间依赖效应
莫秋芬,邓伶俐,李 杨,赵敏洁,冯凤琴*
(1 浙江大学生物系统工程与食品科学学院 智能食品加工技术与装备国家(地方)联合实验室农业部农产品产后处理重点实验室 农业部农产品营养功能评价实验室浙江省农产品加工技术研究重点实验室 杭州310058 2 湖北民族大学生物科学与技术学院 湖北恩施445000 3 青岛农业大学食品科学与工程学院 山东青岛266109)
月桂酸单甘油酯(Glycerol Monolaurate,GML)是由月桂酸和甘油酯化形成的单甘油酯,是一种兼具优良的抑菌、抗炎和抗病毒性能[1-4]的食品乳化剂(GB 2760-2014),在食品工业、化妆品和生物医药等领域得到广泛应用[5]。GML 被美国食品药品监督管理局认证为一般公认安全类(GRAS)食品添加剂。2005年,我国批准GML 应用于食品领域,使用者可按需要量无限量添加。GML 天然存在于母乳、牛乳、椰子油和美洲蒲葵中。最新的研究指出,母乳中约含有3 000 μg/mL GML,是牛乳中GML 含量的20 倍左右,并且GML 有助于母乳发挥良好的抑菌和抗炎活性,为母乳喂养的优势提供有力的证据[6]。此外,GML 可以改善断奶仔猪和育肥猪的生长性能和猪肉的品质[7],GML 与丁酸甘油酯复配显著增加了肉鸡的体重和饲料转化率[8]。
近几年来,陆续有研究报道乳化剂在动物上引起的不良效果。例如,常见的乳化剂羧甲基纤维素和聚山梨醇酯80,通过影响小鼠肠道菌群参与代谢综合征和低度炎症的发生和发展[9-10]。研究表明,肠道菌群与宿主之间的互利共存关系是宿主健康和营养的基础,并且肠道菌群对于宿主免疫系统的发育和功能是必不可少的[11]。鉴于GML 在食品等领域的广泛应用和其它乳化剂的不良报道,本课题组前期开展大量基于肠道菌群探讨GML 对正常小鼠和高脂膳食饲喂小鼠的糖脂代谢和炎症反应的影响研究,结果表明,GML 对糖、脂代谢、炎症反应和肠道菌群的调节作用具有剂量依赖关系[5,7,12],并且较高剂量的GML(800~1 600 mg/kg)可以显著促进有益菌的生长,优化小鼠的肠道菌群结构[12]。更高剂量的GML(1 200~1 600 mg/kg)通过靶向肠道菌群,显著改善高脂膳食饲喂小鼠的低度炎症、胰岛素抵抗和脂代谢失衡等现象[5]。
在先前的研究中,肠道菌群的组成和变化趋势并不一致,甚至是相反的,推测不仅剂量会对肠道菌群产生影响,不同的处理时间也会对菌群产生不同的调节作用。有研究证实肠道菌群是高度可变的,可在短的时间内做出快速的响应[13],仅在试验终点进行测序,难以将肠道菌群组成的变化视为好或者不好。鉴于此,深入探讨GML 对肠道菌群的影响是否存在时间依赖效应具有重要的意义。本试验以正常雄性C57BL/6 小鼠为研究对象,探讨GML 对糖、脂代谢和系统性炎症的影响以及GML 对小鼠对肠道菌群调节作用的时间依赖效应,确定GML 对菌群的调节作用是否与小鼠生理生化相关指标的改变相关,旨在为GML 在食品、养殖业以及生物医药等领域的应用提供更多的参考依据。基于前期研究所采用的剂量范围[5,12],本试验所用GML 剂量为1 200 mg/kg。
1 材料与方法
1.1 动物、材料与试剂
4~5 周龄的雄性C57BL/6 小鼠(生产许可证号:SCXK(沪)2013-0018)购于上海斯莱克实验动物有限公司。
月桂酸单甘油酯,杭州康源食品科技有限公司;总甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、谷草转氨酶、谷丙转氨酶、碱性磷酸酶,南京建成生物工程研究所;葡萄糖、胰岛素、游离脂肪酸、脂联素、瘦素、脂多糖、脂多糖结合蛋白,武汉基因美生物科技有限公司;肿瘤坏死因子、白介素6、白介素1β、白介素10、白介素22、白介素12/P70、干扰素γ、转化生长因子β1试剂盒,赛默飞世尔科技有限公司;粪便基因组DNA 提取试剂盒,QIAGEN 公司;TRIzol 试剂、逆转录试剂、荧光定量PCR 试剂,南京诺唯赞生物科技有限公司。
1.2 仪器与设备
气相色谱仪,日本岛津公司;短链脂肪酸分析柱DB-FFAP,安捷伦科技(中国)有限公司;酶标仪,瑞士帝肯集团公司。
1.3 方法
1.3.1 动物饲养与分组 小鼠饲养于浙江中医药大学无特定病原菌(SPF 级)动物房,环境温度为(22 ±2)℃,湿度为50%左右。小鼠预饲养2 周后开展实验。30 只小鼠随机分成2 组,每组5 笼,每笼3 只小鼠。具体的分组设计为:对照组(NCD):饲喂基础繁殖料(no.M01-F25);GML 处理组(G1200):饲喂预混了1 200 mg/kg GML 的定制繁殖料。饲养周期为17 周,小鼠自由饮水和采食。每周记录小鼠的体质量和采食量。
1.3.2 试验样品采集分别在第5 周和第17 周时收集小鼠新鲜粪便,冻存于-80℃。17 周后,小鼠过夜禁食,眼眶静脉丛取血,室温静置2 h 后,于4℃,3 000 r/min 离心15 min 收集血清,冻存于-80℃。小鼠颈椎脱臼处死,解剖收集肝脏、肾、脾、棕色脂肪和附睾脂肪,迅速称重并记录,收集空肠和回肠组织冻存于-80℃,取部分附睾脂肪和空肠段放入10%中性福尔马林中进行固定。本研究得到浙江中医药大学实验动物管理与伦理委员会批准(伦理报告编码:ZSLL-2016-155),所有实验流程均符合浙江中医药大学动物福利规定。
1.3.3 血清指标的检测取1.3.2 节中血清样品,按照相应的试剂盒说明书分别测定血清四项、生理生化相关指标、糖、脂代谢相关指标、脂多糖和细胞因子含量等。
近几年发生照护人员虐待老人的事件中,虽然都有安装摄像头,对照护人员也有一定的警示作用,但监控总有死角,子女也不可能24小时守在屏幕前,等发现家人被虐待时,身体伤害和心理伤害往往已难以弥补,子女也因此非常内疚和痛心。所以子女要经常回家看看,并多和父母沟通,其实老人可能并不需要多么好的物质条件,只需要子女们的陪伴!
1.3.4 目的基因mRNA 转录水平分析 根据相应的试剂盒说明书进行试验,具体的操作流程参考文献[5,12],引物序列见表1。

表1 目的基因的引物序列Table 1 Primer sequences used in the qRT-PCR assays
1.3.5 细菌DNA 的提取及测序取1.3.2 节中收集的粪便样品,每只小鼠称取500 mg 粪便于2 mL 离心管中,按试剂盒说明书进行DNA 提取。菌群测序与分析方法参考文献[12]。
1.3.6 组织切片分析 取固定于10%中性福尔马林的附睾脂肪样品和空肠组织,送至浙江大学医学院公共技术平台-组织形态学平台分别进行苏木精曙红染色(Hematoxylin-eosin staining,H&E)和阿尔辛蓝-过碘酸雪夫氏(Alcian-Blue/Periodic acid-Schiff,AB/PAS)染色,脱水封片后,于光学显微镜下对组织切片进行观察,用Image J 软件对附睾脂肪细胞的数量和面积以及空肠中AB/PAS阳性细胞的数量进行统计分析。
1.3.7 粪便短链脂肪酸含量测定 参考先前的研究进行样品的制备和气相色谱分析[5,12]。
1.4 数据统计与分析
试验数据用GraphPad Prism 6.0 软件进行作图与分析,数据结果表示为平均值±标准差。利用unpaired two-tailed Student's t test 分析相同时间点不同组或者相同组不同时间点之间的差异显著性;利用SPSS 22.0 软件统计的Spearman 相关性系数对两两指标之间进行相关性分析和显著性检验。P<0.05 代表具有统计学意义。
2 结果与分析
2.1 GML 对小鼠体质量、采食量、脏器质量及脂肪细胞大小的影响
如图1a 和图1b所示,G1200 组小鼠的体质量和采食量均显著高于NCD 对照组,而肝、脾、肾、附睾脂肪垫以及棕色脂肪垫的质量与NCD 组无显著差异(图1c)。与附睾脂肪垫的质量结果一致,附睾脂肪细胞的大小在G1200 组和NCD 组之间无显著差异(图1d)。

图1 GML 对小鼠体质量、采食量、脏器质量及脂肪细胞面积的影响Fig.1 Effects of GML on the body weight,feed consumption,organs weight and adipocyte size
2.2 GML 对血清生化指标的影响
由表2所知,与NCD 组相比,G1200 组的低密度脂蛋白胆固醇的水平(P=0.091)以及低/高密度脂蛋白胆固醇的比值(P=0.053)呈下降趋势,但是均未达到显著性水平;然而其它生理生化指标均无明显变化。

表2 GML 对小鼠血清生化相关指标的影响Table 2 Effects of GML on the metabolic-related biochemical parameters
2.3 GML 对血清细胞因子和脂多糖质量浓度的影响
由表3可知,与NCD 组相比,G1200 组的干扰素γ含量呈上升趋势(P=0.087),白介素10 含量呈下降趋势(P=0.095),不具有统计学显著性;其它的炎症性细胞因子、脂多糖和脂多糖结合蛋白的含量无明显变化。

表3 GML 对小鼠血清抑炎因子和促炎指标的影响Table 3 Effect of GML on the serum anti-inflammatory and pro-inflammatory factors
2.4 GML 对肠道屏障功能的影响
研究表明,肠道杯状细胞分泌黏蛋白形成黏液层,黏液层及其包含的黏蛋白2(MUC2)、溶菌酶、α-防御素(α-defensin)和免疫球蛋白A 等抗菌物质[14]共同维持肠道的化学屏障功能[15]。由图2a可知,G1200 组小鼠空肠中AB/PAS 阳性的杯状细胞数目与NCD 组相当。与AB/PAS 染色结果相类似,小肠muc2 基因的表达水平在NCD 组和G1200 组之间无显著性差异(图2b)。值得注意的是,与NCD 组相比,G1200 组α-防御素基因的表达水平显著高于NCD 组(图2b)。
紧密连接蛋白(Zonula occluden 1,ZO1)和闭合蛋白Occludin 是维持肠道物理屏障的重要组成蛋白[16-17]。由图2b 可知,与NCD 组相比,G1200 组小肠zo1 基因的表达水平无显着性变化,但是闭合蛋白基因的表达水平呈升高趋势。
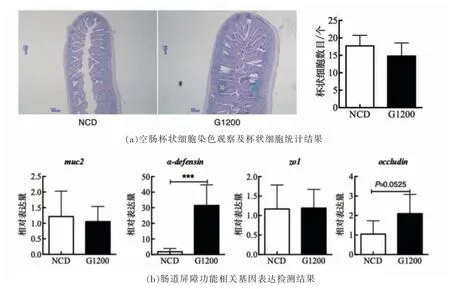
图2 GML 对肠道屏障功能的影响Fig.2 Effects of GML on the intestinal barrier function
上述结果表明,GML 对小鼠肠道的组织学特征无显著影响,但是显著提高了小肠α-防御素和闭合蛋白的表达水平,增强了肠道屏障功能。
2.5 GML 对小鼠菌群多样性的影响
小鼠粪便菌群alpha 多样性指数见图3a。在第5周和第17周时,Chao1 指数、Observed species 指数、PD_whole_tree 指数 和Goods_coverage 指数在NCD 组和G1200 组之间均无显著差异。随着饲养时间的延长,Chao1 指数、Observed species 指数和PD_whole_tree 指数均显著升高,而Goods_coverage 指数显著下降,提示这几个指数未受到GML 处理的影响,而是受到时间变化的影响。另一方面,在第5 周和第17 周时,G1200 组的Shannon 指数和Simpson 指数均显著低于NCD组。然而,这2 个指数不会随着时间的变化而变化。上述结果提示,GML 主要对小鼠粪便菌群的Shannon 指数和Simpson 指数产生影响。
小鼠粪便菌群Beta 多样性指数见图3b。基于非加权UniFrac 距离,用主坐标分析(Principle coordination analysis,PCOA)组间的物种差异性发现,在第5 周和第17 周时,NCD 组和G1200 组的肠道菌群均出现组内聚集、组间离散的现象。在时间维度上进行对比发现,NCD 组的菌群在第5 周和第17 周时发生了明显的分离,然而,G1200 组的菌群在第5 周和第17 周时的离散程度不显著。

图3 GML 对肠道菌群多样性的影响Fig.3 Effects of GML on the diversity of the gut microbiota
2.6 门水平上GML 对小鼠菌群组成的影响
由图4a 和图5可知,NCD 组和G1200 组的肠道菌群主要由拟杆菌门、厚壁菌门、软壁菌门、变形菌门、疣微菌门和放线菌门组成。其中,拟杆菌门和厚壁菌门的相对丰度均达到90%以上,这与先前的报道一致[18]。

图5 基于门水平的差异菌群的相对丰度Fig.5 Relative abundance of the differential microbial taxa at the phylum level
从门水平上分析菌群组成的变化可知,第5周时,与NCD 组相比,G1200 组的拟杆菌门和软壁菌门显著下降(P<0.05),变形菌门呈下降趋势(P=0.087),厚壁菌门和疣微菌门显著上升(分别为P<0.01 和P<0.05)。然而,在第17 周时,G1200组的软壁菌门丰度显著低于NCD 组(P<0.001),NCD 组和G1200 组的另外5 种优势菌群的组成无显著差异。此外,在门水平上,时间因素对菌群组成没有显著的影响。
2.7 属水平上GML 对小鼠菌群组成的影响
由图4b 和图6可知,在属水平上,在第5 周时,与NCD 组相比,G1200 组的拟杆菌属、副拟杆菌属、颤杆菌属、假黄杆菌属、梭菌属XIVb 族、梭菌属XI 族和阿克曼菌属显著升高;巴恩斯氏属、厌氧支原体属、乳杆菌属和未分类的毛螺菌属显著下降。

图4 GML 对肠道菌群门水平和属水平分类群的影响Fig.4 Effects of GML on the compositions of the gut microbiota at the phylum and genus level
第17 周时,部分菌属,例如颤杆菌属、厌氧支原体属、阿克曼菌属、乳杆菌属和梭菌属XIVb 族,在NCD 组和G1200 组的变化趋势与第5 周的趋势相类似。然而,另一部分菌属,如拟杆菌属和巴恩斯氏属,则表现出相反的变化趋势。
从时间的维度分析发现,NCD 组的拟杆菌属、副拟杆菌属、巴恩斯氏属、另枝菌属、颤杆菌属、假黄杆菌属、阿克曼菌属以及梭菌属XIVb 族随着时间的增加而显著增加。然而,G1200 组只有巴恩斯氏属、颤杆菌属以及梭菌属XIVb 族随着时间的增加而显著增加。
上述结果提示,在属水平上,菌群组成不仅受到GML 干预的影响,而且也受到时间因素的影响。虽然时间因素对NCD 组菌群的影响程度大于对G1200 组菌群的影响,但是GML 对部分有益菌,例如巴恩斯氏属、颤杆菌属以及梭菌属XIVb族的促进作用大于时间的影响效应,另一方面GML 对乳杆菌属和厌氧支原体属的抑制作用不会随着时间的变化而变化。
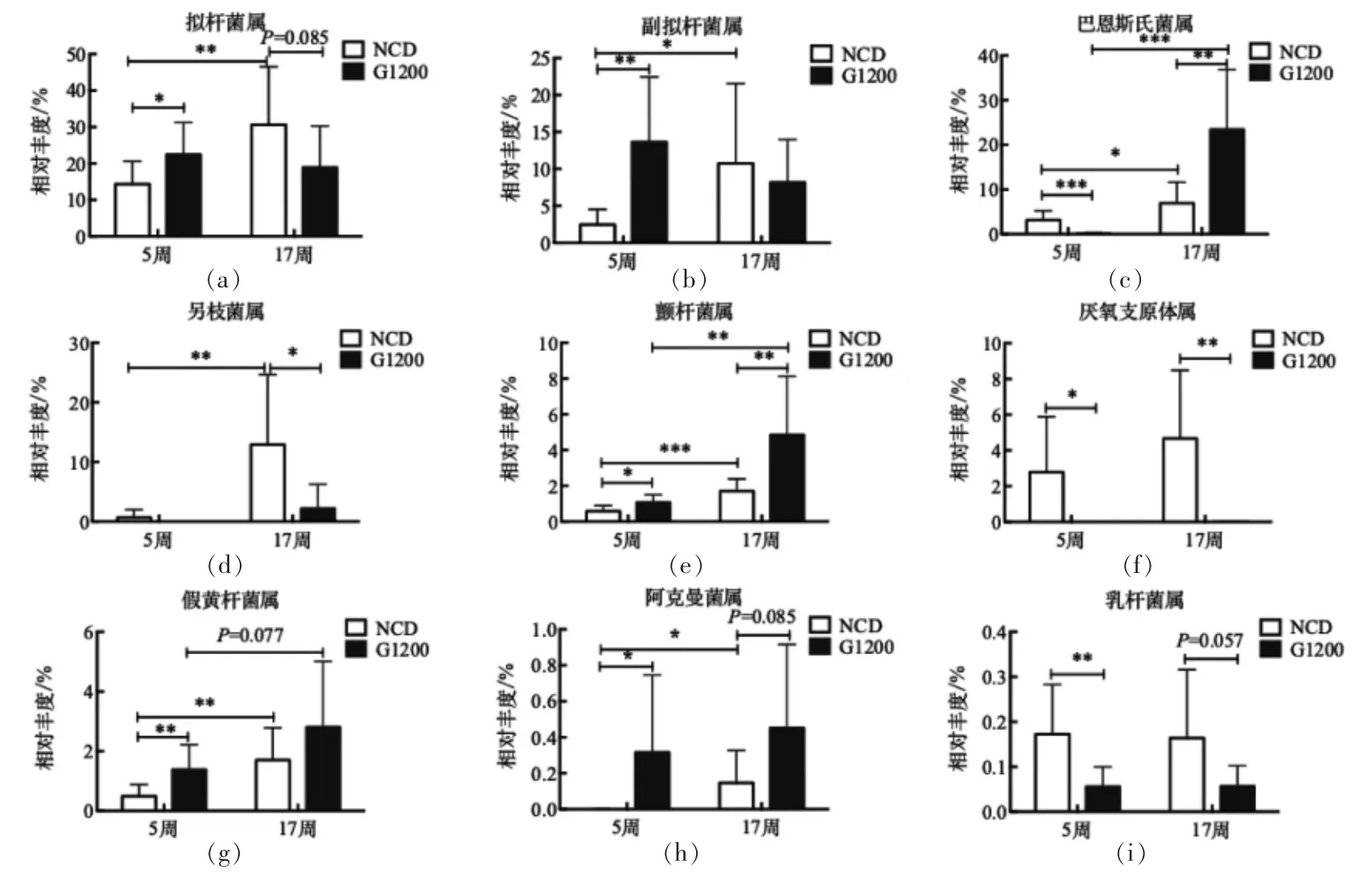

图6 基于属水平的差异菌群的相对丰度Fig.6 Relative abundance of the differential microbial taxa at the genus level
2.8 GML 对小鼠粪便中短链脂肪酸含量的影响
由图7可知,在第5 周和第17 周时,G1200组的乙酸和总短链脂肪酸的含量均显著低于NCD组。在第5 周时,G1200 组的丙酸含量呈下降趋势,无统计学差异。从时间的维度分析发现,随着时间的增加,NCD 组的乙酸和总短链脂肪酸的含量显著减少,丁酸、戊酸和己酸的含量呈下降趋势。然而,随着时间的延长,G1200 组的丙酸水平显著增加,丁酸和异戊酸水平显著下降。

图7 GML 对小鼠粪便短链脂肪酸含量的影响Fig.7 Effects of GML on the content of short-chain fatty acids in feces of mice
2.9 显著差异的细菌分类群和显著变化指标的相关性分析
为了确认GML 引起的细菌分类群的变化与小鼠生理生化指标之间的关联,对GML 特异性调节的特征差异菌(排除时间因素)与变化的生理生化指标进行了Spearman 相关性分析,由图8可知,分别有3 个分类群与小鼠与体质量百分比和采食量存在相关性,其中巴恩斯氏属丰度与体质量百分比呈正相关(P<0.05),厌氧支原体属丰度与体质量百分比呈显著负相关(P<0.05);颤杆菌属和梭菌属XIVb 族丰度与采食量呈显著正相关(P<0.05),厌氧支原体属丰度与采食量呈负相关(P=0.056)。在所测试的8 个细菌分类群中,有5个与α-defensin 的表达水平存在相关性,其中,巴恩斯氏属和颤杆菌属丰度与α-defensin 表达水平呈显著正相关,另枝菌属和厌氧支原体属则相反。另外,巴恩斯氏属和闭合蛋白的表达水平密切相关。阿克曼菌属和乳杆菌属与所研究的生理生化指标均无相关性,乙酸和低/高密度脂蛋白胆固醇比值也与菌群组成没有显著的相关性。上述结果表明,GML 引起的肠道菌属的变化和GML 对小鼠的促生长作用和对肠道屏障功能的增强作用密切相关。

图8 特征差异菌与变化的生理生化指标关联分析热图Fig.8 The Spearman correlation between the differential taxa and the changed indicators
3 讨论
GML 作为一种具有优良抑菌性能的食品乳化剂,在抗炎、抗病毒和免疫调节方面也发挥了良好的作用[2-3,19]。先前的研究报道了GML 对肠道菌群的影响存在剂量依赖关系[4],本研究旨在探究GML对肠道菌群调节的时间依赖关系和GML 对小鼠血脂水平、糖、脂代谢和系统性炎症反应的影响。
研究表明,常用的膳食乳化剂,如羧甲基纤维素钠和聚山梨醇酯-80 显著促进小鼠体质量和脂肪垫质量的增加[9],GML 也能促进小鼠体重的增加,但是对脂肪垫的影响存在剂量依赖效应[12,20]。本研究中,1 200 mg/kg GML 对小鼠体质量和采食量有显著的促进作用,但是并未显著改变小鼠附睾脂肪垫和棕色脂肪垫的质量,提示小鼠体质量的增长可能与采食量的增加以及其它的指标的变化相关。
先前的研究认为,羧甲基纤维素钠和聚山梨醇酯-80 等在正常小鼠中引起低度炎症、胰岛素抵抗和增加空腹血糖的浓度[10],而GML 对正常小鼠血脂水平和系统性炎症的影响与其添加的剂量密切相关[5,7,12]。在本研究中,1 200 mg/kg GML 添加到小鼠的饲料中,不会引起小鼠血脂水平、脂多糖含量和炎症细胞因子的显著变化,反而在一定程度上降低了低/高密度脂蛋白胆固醇的比值。1 200 mg/kg GML 对血清葡萄糖、胰岛素、脂肪因子瘦素和脂联素的分泌水平没有显著影响。
在肠道菌群方面,GML 导致菌群alpha 多样性中的Simpson 指数和Shannon 指数显著下降。虽然有研究表明,肠道菌群多样性的下降会对机体产生不利影响[21],但是也有研究表明,具有抑菌活性的化合物在对机体产生有益作用的同时也会导致菌群多样性下降,如芥子酸胆碱作为益生元在防止肥胖相关的胰岛素抵抗和非酒精性脂肪肝等病理发生的同时显著下调肠道菌群的多样性[22]。另外,儿茶素作为一种具有抑菌性能的多酚类化合物,可以控制高脂膳食引起的体重增长,同时也显著下调了菌群的多样性[23]。先前的研究提示,较低剂量的GML 对菌群发挥一定的调节作用,然而较高剂量的GML 可以在体内发挥抑菌作用,导致菌群多样性的降低[12]。因此,在本研究中,1 200 mg/kg GML 引起的菌群alpha 多样性的下降与其抑菌活性相关。
在菌群组成方面,在第5 周时,1 200 mg/kg GML 显著改变了菌群的组成,例如厚壁菌门和拟杆菌门的相对丰度及其比值显著改变。第17 周时,肠道菌群的差异消失,只有个别细菌分类群具有显著差异,表明GML 在处理早期引起的菌群组成的变化可能是肠道菌群整体对GML 这一饮食组分作出的快速响应。本研究的结果与先前的研究结论一致,即肠道菌群的结构被认为是高度动态变化的,并且极易受到饮食因素的影响[24]。然而,部分菌群的丰度具有弹性,在发生变化后可自行恢复[25]。
本研究还发现,细菌组成的变化不仅受到GML 的干预调节,还会受到时间因素的影响。在属水平上,NCD 组有8 个菌属的丰度随着时间的延长而显著增加,而G1200 组只有3 个,并且NCD 组的8 个变化的菌属包含G1200 组的3 个,提示GML 有助于维持肠道菌群的稳定性。GML对另枝菌属、厌氧支原体属、乳酸杆菌属和阿克曼菌属的丰度产生显著影响,并且不会随着时间的变化而变化。GML 对巴恩斯氏属、颤杆菌属和梭菌属XIVb 族不仅有显著的促进作用,并且GML的促进效应大于时间的调节效应,随着处理时间的延长,GML 的促进作用更明显。研究表明,巴恩斯氏属和颤杆菌属均与宿主的健康状态密切相关,并且与脂多糖的水平呈负相关的关系[26-29]。其中,颤杆菌属有助于维持肠道屏障功能的完整性[30],并且与体重增加呈正相关[31]。与先前的研究结论一致。在本研究中,GML 显著上调的巴恩斯氏属和颤杆菌属均与肠道的α-防御素表达水平呈正相关关系,而α-防御素有助于机体抵抗产生脂多糖的革兰氏阴性菌的感染[32]。此外,巴恩斯氏属和颤杆菌属分别与体重和采食量呈正相关的关系。先前的研究发现,从绞股蓝分离的三萜皂苷促进了α-防御素的表达水平,却显著抑制了厌氧支原体属的生长[33]。在本研究中也发现了类似的现象,厌氧支原体属与α-防御素的表达水平呈显著负相关。
虽然乳杆菌属被认为是内源性的可产生短链脂肪酸的有益菌群[34-35],但是在本研究中GML 显著降低了乳杆菌属的丰度和乙酸以及总短链脂肪酸的含量。有研究认为,乳酸杆菌属与血清低密度脂蛋白胆固醇浓度呈正相关的关系[31],并且某些有益的化合物提取物在改善高脂诱导的代谢性疾病的同时,也会引起乳杆菌属丰度的下降[27]。因此在本研究中,乳酸杆菌的下降可能与低密度脂蛋白胆固醇的下降趋势相关联,乙酸含量的下降可能与体质量和采食量的增加相关。先前的研究表明,乙酸或乙酸盐被肠道上皮细胞吸收,通过血液循环可以穿透血脑屏障激活副交感神经系统影响食欲,进而调节采食量[36]。
4 结论
综上所述,1 200 mg/kg GML 不会引起小鼠的血脂水平异常、糖、脂代谢紊乱和系统性炎症反应等不良的后果。本研究结果提示,肠道菌群组成的变化是对GML 干预的一种快速响应,门水平上的菌群组成差异随着时间的延长而消失。然而在属水平上,GML 既可以维持肠道菌群的稳定性,又可以特异性地下调部分潜在的病原菌的丰度,显著提高了有益菌群的比例,优化肠道菌群的结构。GML 上调的有益菌属与小鼠体质量增加、α-防御素和闭合蛋白的表达水平密切相关,可以发挥促生长和增强黏膜屏障功能的作用。本研究阐述了GML 对肠道菌群调节作用的时间依赖效应,也为乳化剂相关研究的开展或者其它的科研工作提供了一定的参考价值。

