果胶对多酚氧化酶活性及热稳定性的影响
廖 滔,周 磊,2*,刘军平,邹立强,刘成梅,刘 伟,3
(1 南昌大学食品科学与技术国家重点实验室 南昌330047 2 南昌大学生命科学学院 南昌330031 3 江西师范大学国家淡水鱼加工技术研发专业中心 南昌330022)
多酚氧化酶(Polyphenoloxidase,PPO)广泛分布于植物细胞内[1],因果蔬内部组织的暴露而激活,可催化单酚羟基转化为邻二酚或将邻酚氧化成醌,而醌类物质极易受到蛋白质或氨基酸的亲核攻击生成黑色素,导致果蔬褐变[2]。发生褐变的果蔬感官品质急剧下降,营养成分被破坏,难以被消费者接受。近年来的研究发现,高压、热、脉冲电场及化学抑制剂等处理手段在模型体系中对PPO活性展现出较好的抑制效果[3-5]。然而,与模型体系相比,相同处理手段在食品体系中的钝酶效果具有较大差异,PPO 在食品体系中对热和高压钝化的抵抗性普遍强于模型体系。本课题组先前的研究发现梨(cv.Packham)PPO 在模型体系(50 mmol/L,pH 6.0,McIlvaine 缓冲液)中经70℃加热10 min 后相对活性为16.7%[6];在梨泥食品体系中经90℃加热10 min 后,其活性仍高达37.8%[7]。此外,Dalmadi 等[8]发现草莓(Fragaria ananassa)PPO在模型体系(100 mmol/L,pH 5.0,PBS)经500~700 MPa 高压处理15 min 后活性急剧下降,而Terefe等[9]报道PPO 在草莓泥食品体系中经相同条件处理后活性无显著变化。与食品体系相比,模型体系成分相对单一,食品体系中复杂的食品组分可能是这种差异形成的重要原因。
果蔬富含多种营养物质,其中果胶是一类由半乳糖醛酸及其衍生物组成的酸性杂多糖,广泛分布于植物细胞的初生壁和中胶层中,构成果蔬坚硬的质地[10-11]。果蔬在鲜切、榨汁和制作果蔬泥等加工过程中,由于机械损伤作用果胶可与PPO发生自然接触,同时果胶作为食品添加剂也被广泛应用于果蔬制品。另一方面,在果蔬贮藏及澄清果蔬汁的制作过程中果胶又常被降解或除去,因此果胶是果蔬加工过程中的一个可控制因素。近年来针对食品中生物大分子间相互作用的研究逐渐兴起,其中以蛋白质与多糖二元复合物为典型代表。有研究报道果胶可通过静电相互作用、范德华力以及氢键等非共价作用力与蛋白质结合,从而使蛋白质性质发生改变[12-14]。因此,果胶作为一种果蔬加工过程中常被添加或去除的物质,它与PPO 之间的相互作用很可能影响果蔬制品中PPO活性、稳定性及酶促褐变的发生。研究果胶对PPO活性及稳定性的影响,不仅有助于控制果蔬制品酶促褐变,也为探讨食品组分影响酶促褐变的机理提供理论参考。
本文以蘑菇PPO 为主要研究对象,使用紫外分光光度计、荧光分光光度计等考察果胶对PPO酶促反应活性、热钝化动力学、热失活构象变化以及抗坏血酸、柠檬酸、阿魏酸和水杨酸等有机酸抑制PPO 活性的影响,以期从食品组分角度解释PPO 在模型体系和食品体系中出现稳定性差异的原因,为果蔬实际生产应用及褐变控制方法的选择提供理论基础。
1 材料与方法
1.1 材料与试剂
双孢蘑菇PPO(T3824-250 ku,2 687 U/mg)、橘皮果胶(半乳糖醛酸≥74.0%),美国Sigma-Aldrich 公司;磷酸二氢钠、磷酸氢二钠、柠檬酸,上海西陇科学股份有限公司;水杨酸,天津市永大化学试剂有限公司;抗坏血酸、阿魏酸、左旋多巴(L-DOPA),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
UV-1600PC 型紫外-可见分光光度计,上海美谱达仪器有限公司;超纯水系统,法国Millipore公司;HH-4 型数显恒温水浴锅,江苏省荣华有限公司;F-4500 型荧光分光光度计,日本日立仪器有限公司;pH 计,上海精密科学仪器有限公司。
1.3 方法
1.3.1 果胶-PPO 溶液的制备 参考果胶在饮料及鲜果中所占的比重,以50 mmol/L pH 6.8 的磷酸缓冲液为溶剂配制不同质量浓度的果胶溶液和0.35 mg/mL 的PPO 溶液以确保PPO 活性在合适范围内,将果胶与PPO 等体积混合使果胶质量浓度最终分别为0,0.5,1,2,3,4,5,10 和20 mg/mL,PPO 终质量浓度为0.175 mg/mL 并置于25℃恒温孵育30 min。
1.3.2 PPO 活性的测定PPO 活性的测定参照Liu 等[15]的方法,将0.1 mL 混合酶液加入到2.9 mL 2 mmol/L L-DOPA 溶液中开启反应,使用紫外-可见分光光度计于25℃监测其在波长475 nm 处1 min 内吸光度的变化值,通过斜率可计算PPO 氧化L-DOPA 的活性,以未添加果胶的PPO样品为空白对照。
1.3.3 热稳定性与热钝化动力学分析 参照Terefe 等[16]和周磊等[17]的方法,分别将PPO 与不同质量浓度果胶的混合溶液置于45~60℃水浴锅中处理不同时间,以样品中心温度达到既定温度时开始计时,加热结束后立即置于冰水浴中迅速冷却[18]。其钝化过程可用式(1)描述,通过线性回归拟合可得到其钝化动力学曲线。

式中,A0——初始酶活,U;At——t 时间的相对酶活性,U;k——钝化速率,min-1;t——时间,min。
1.3.4 荧光光谱分析参考Liu 等[19]的方法略作修改。使用F-4500 型荧光分光光度计于25℃测定样品的内源荧光光谱,发射与激发狭缝宽均5 nm,激发波长280 nm,扫描波长范围300~420 nm,扫描速度1 200 nm/min,所有光谱均通过不含PPO 的样品光谱作为空白进行修正。
1.3.5 抑制剂对PPO 的抑制作用 选用抗坏血酸、柠檬酸、阿魏酸和水杨酸4 种常见的有机酸,用浓度分别为0.6,1.2,1.8,2.4 mmol/L 的抗坏血酸溶液,浓度分别为5,10,15,20 mmol/L 的柠檬酸溶液,浓度分别为5,7.5,10,12.5 mmol/L 的阿魏酸溶液和浓度分别为1,4,7,11 mmol/L 的水杨酸溶液处理含5 mg/mL 果胶的PPO 溶液,30 min后测定其相对活性。
1.4 数据处理与分析
所有试验均重复3 次,结果表示为平均值±标准偏差。利用SPSS 17.0 和Origin 8.0 软件进行统计分析,显著性水平为0.05。
2 结果与分析
2.1 果胶对PPO 酶促反应活性的影响
果胶对PPO 酶促反应活性的影响如图1所示。从图中可以看出PPO 活性随果胶质量浓度的增加而略微下降,2 mg/mL 果胶使PPO 活性降低11.2%。随着果胶质量浓度增加至10 mg/mL,PPO相对活性进一步降低至79.0%,此后增加果胶质量浓度,PPO 活性不再发生明显变化,说明果胶对PPO 活性具有一定的抑制作用,但抑制效果较弱,果胶对PPO 分子的包埋作用可能是导致其活性变化的原因之一。陈芳等[20]总结了近年来果胶作为包埋载体荷载生物活性成分的研究进展,认为果胶具有包埋功能性成分的潜能。Mashingaidze等[12]通过计算机模拟分子对接技术发现果胶能通过氢键和静电相互作用与黏蛋白结合。Girard 等[21]研究报道果胶可与β-乳球蛋白形成复合物,且低酯果胶与蛋白的结合作用较高酯果胶强。果胶分子中游离的羧基可能与PPO 活性中心的铜离子形成配合物,球状的PPO 分子被链状的果胶分子包埋,从而使PPO 与底物的特异性结合受阻,催化活性降低。此外,有文献报道蘑菇PPO 的最适pH 值在6.8 附近,所处环境低于其最适pH 值范围的PPO 活性显著下降[22]。果胶作为一种弱酸性多糖(pKa=3.5),果胶分子中大量羧基的电离使体系pH 值略微下降,如表1所示,20 mg/mL 果胶使体系pH 值降低0.68。虽然果胶对PPO 反应体系pH 值的影响较小,但是许多研究表明PPO 对体系pH 值的变化十分敏感[23]。果胶对PPO 分子的包埋作用与其弱酸化作用都可能影响PPO 的酶促反应活性。
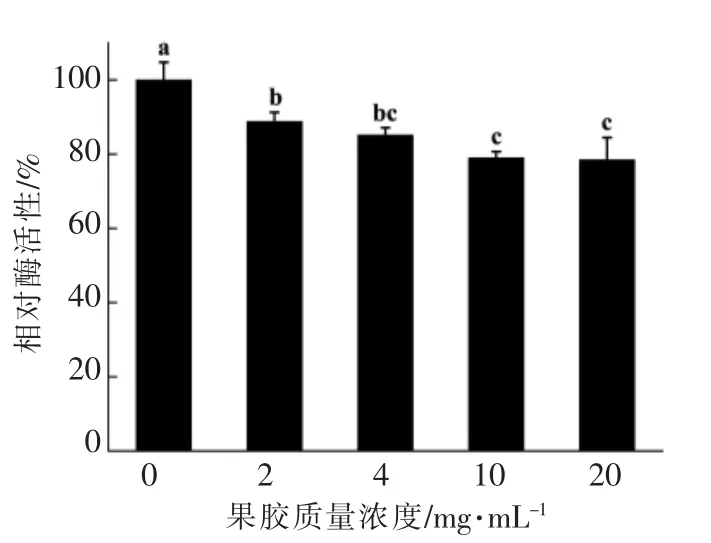
图1 果胶对PPO 酶促反应活性的影响Fig.1 Effects of pectin on PPO enzyme activity

表1 果胶对PPO 反应体系pH 值的影响Table 1 Effects of pectin on pH value of PPO reaction system with
2.2 果胶对PPO 热钝化动力学的影响
热钝化温度范围为45~60℃时,果胶对PPO热钝化动力学的影响如图2所示,其热钝化速率如表2所示。由图2a 可知,在不含果胶的情况下,经45℃热处理后PPO 发生轻微钝化,热处理20 min 后PPO 活性仍保持在50%以上,其钝化速率为0.0308 min-1。随着处理温度的升高,PPO 热钝化速率逐渐加快,经55℃热处理3 min 后PPO 相对活性仅为33.5%;当温度升高至60℃时,热处理1 min 可使PPO 活性降低50%以上,2 min 后PPO 基本失活,钝化速率为0.8665 min-1。果胶的加入使PPO 对热钝化的敏感性降低。在相对温和的热处理条件下(50℃),PPO 热钝化速率为0.0502 min-1,而5 mg/mL 果胶使PPO 热钝化速率降低至0.0322 min-1(图2b)。随着果胶质量浓度的增加,PPO 热钝化速率逐渐下降,当果胶质量浓度升高至10 mg/mL 时,PPO 热钝化速率下降至0.0254 min-1。热处理温度升高至55℃时,PPO 的热钝化速率具有相同的趋势(图2c),5,10,20 mg/mL 果胶使PPO 热钝化速率由0.2636 min-1分别下降至0.1733,0.1180,0.0865 min-1。从图2d 可以看出,随着热处理温度继续升高,60℃热处理2 min 使PPO 活性下降至19.7%,而5 mg/mL 和10 mg/mL 果胶能使PPO 活性分别保持为56.2%和58.0%,其热钝化速率分别降低了0.5804 min-1和0.6214 min-1。课题组前期研究报道蘑菇PPO 对热十分敏感,高温短时或低温长时热处理均能有效钝化其活性[24]。本试验结果表明果胶能增强PPO在50~60℃范围内的热稳定性,且这种增强作用呈现一定的质量浓度依赖性。有研究报道称蛋白质与果胶间的相互作用会改变蛋白质的热稳定性,这可能与果胶在蛋白表面形成紧密的网络结构密切相关[25]。热处理通过诱导PPO 分子发生聚集或去折叠变化使其活性降低,链状果胶对PPO分子的缠绕或包埋作用很可能保护PPO 结构免受热钝化的影响,同时果胶分子中羧基基团的氧原子可与PPO 分子中的氢原子形成氢键从而增强PPO 稳定性,降低其热钝化速率。因此,果蔬制品如果蔬汁、果蔬泥及果酱等食品体系中果胶的存在可能使PPO 表现出更强的热稳定性,也是PPO 在不同体系中热钝化动力学差异的原因之一。
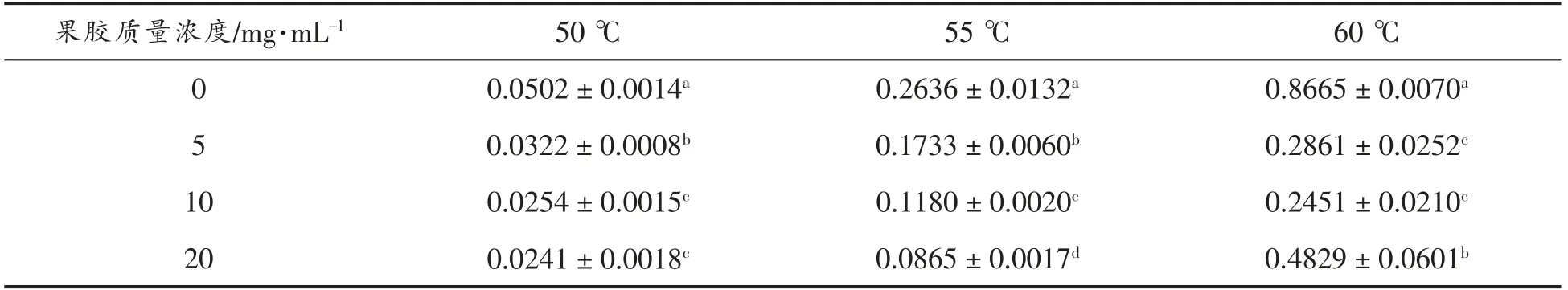
表2 PPO 热钝化速率k(min-1)Table 2 Inactivation rate constants of thermal processed PPO(min-1)
2.3 果胶对PPO 热失活构象变化的影响
荧光光谱是一种通过测定蛋白质酪氨酸和色氨酸残基附近的极性环境反映蛋白质构象变化的技术方法[26]。图3a 为室温25℃下未经热处理的PPO 荧光光谱。从图3a 中可以看出,PPO 最大荧光发射峰出现在335.2 nm 处,而果胶能促使PPO荧光强度下降且荧光强度随果胶质量浓度的增加而急剧下降。当果胶质量浓度分别为0.5,1,2,3 mg/mL 时,PPO 相对荧光强度分别下降至81.5%、65.9%、44.3%和29.2%,说明果胶能影响PPO 附近的极性环境,使PPO 构象发生一定程度的改变,且PPO 三级结构的变化与图1果胶对PPO 酶促反应活性的影响相对应。与相同条件下未经热处理的PPO 样品相比,55℃热处理诱导PPO 内源荧光发生轻微的猝灭,同时PPO 最大荧光发射峰发生一定程度的红移且红移程度随加热时间的增加而增加(图3b)。在无果胶存在的情况下,经55℃热处理9 min 后PPO 最大荧光发射波长发生2.6 nm 的红移。随着果胶质量浓度的增加,热处理对PPO 结构的影响越不明显。果胶质量浓度为0.5 mg/mL 时,55℃、9 min 的热处理使PPO 最大荧光发射波长发生2.2 nm 的红移,随着果胶质量浓度增加至3 mg/mL,PPO 最大荧光发射波长仅发生0.4 nm 的红移。以上结果表明热处理能使PPO 三级结构发生明显的改变,果胶的存在增强了PPO 在热钝化条件下构象的稳定,从而提高其热稳定性。
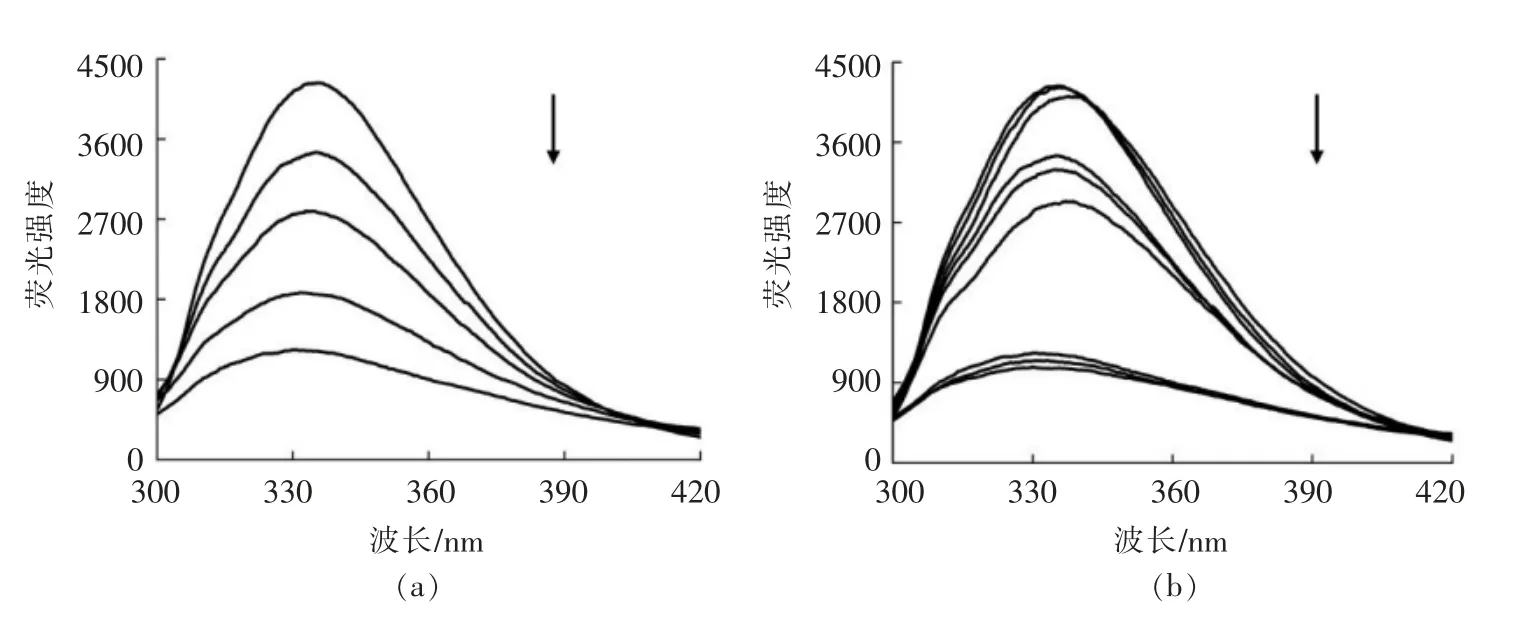
图3 PPO 荧光光谱变化Fig.3 Changes of fluorescence emission spectra of PPO
2.4 果胶对PPO 抑制剂作用的影响
抗坏血酸、柠檬酸、阿魏酸和水杨酸4 种有机酸是应用最为广泛且高效的PPO 抑制剂。4 种有机酸均能显著抑制PPO 活性且抑制作用表现出明显的浓度依赖性(图4)。4 种有机酸中,抗坏血酸的抑制作用最强,其次是水杨酸和阿魏酸,柠檬酸的抑制效果最弱。1.2 mmol/L 抗坏血酸处理使PPO活性降低至53.1%,而要达到相同的抑制效果,水杨酸处理浓度需达到4 mmol/L,阿魏酸处理浓度需达到7.5 mmol/L 以上,柠檬酸处理浓度则需达到15 mmol/L。当果胶质量浓度为5 mg/mL 时,4 种有机酸对PPO 活性的抑制作用略有增强。1.8 mmol/L 抗坏血酸处理后,PPO 活性的抑制率从56.9%增加至82.6%;15 mmol/L 柠檬酸处理后,PPO 活性的抑制率从52.6%增加至69.3%;7.5 mmol/L 阿魏酸处理后,PPO 活性的抑制率从32.2%增加至43.0%;1 mmol/L 水杨酸处理后,PPO 活性的抑制率从16.9%增加至26.1%。抗坏血酸、柠檬酸、阿魏酸和水杨酸普遍具有酸性且其中柠檬酸的酸性最强。如表3所示,5 mmol/L 柠檬酸处理后体系pH 值低于6.0,而15 mmol/L 柠檬酸处理后体系pH 值低于5.0。有研究报道柠檬酸的酸化作用是其对PPO 活性产生抑制作用的主要原因[27-28];而抗坏血酸主要是因为其强还原性,能将PPO 催化氧化形成的中间产物醌及时还原从而阻碍黑色素的生成[29];阿魏酸和水杨酸2 种芳香族羧酸因具有与底物结构相似的特点,能够与底物竞争PPO 结合位点而产生抑制作用[30-31]。链状果胶虽然可能对PPO 分子产生缠绕或包埋作用,然而抗坏血酸、柠檬酸、阿魏酸和水杨酸均为小分子,其简单的结构使其容易与PPO 分子发生接触。此外,果胶的弱酸性可降低体系pH 值,从而增强有机酸对PPO 活性的抑制作用。
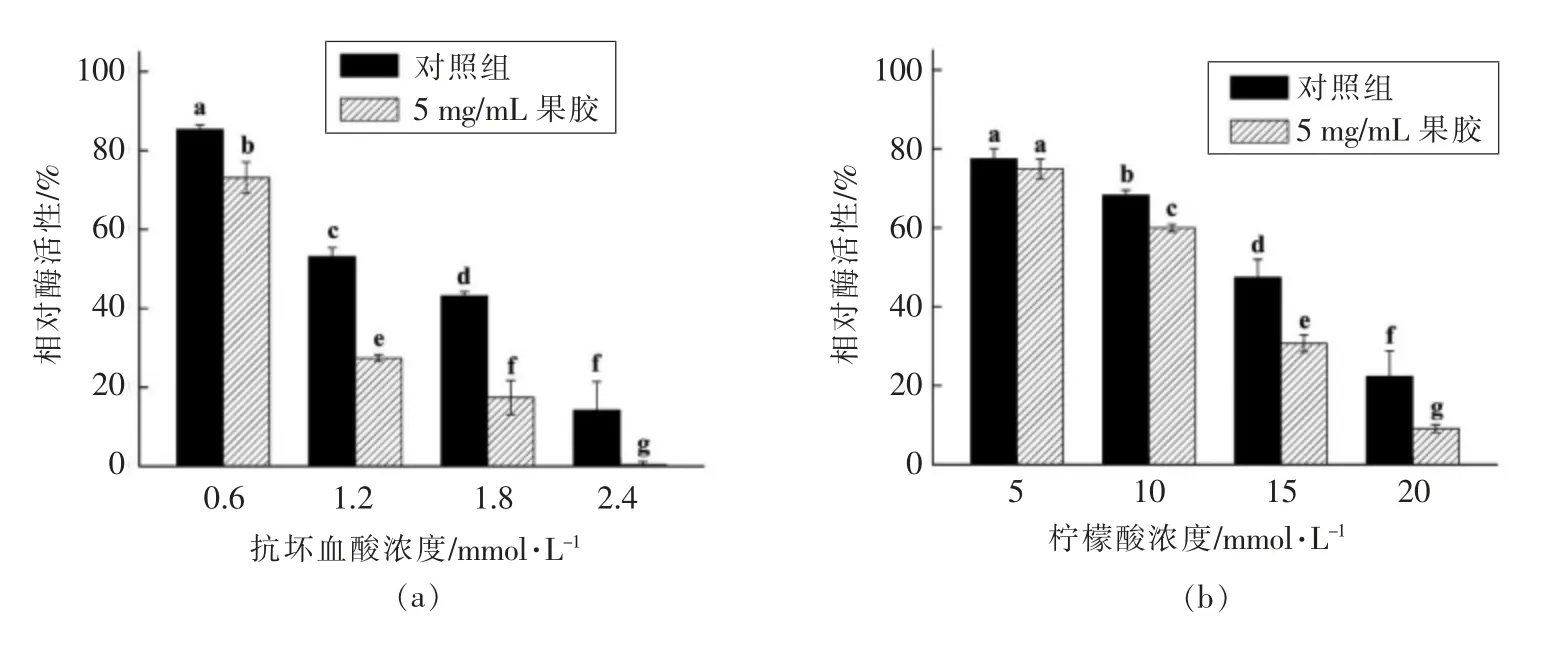
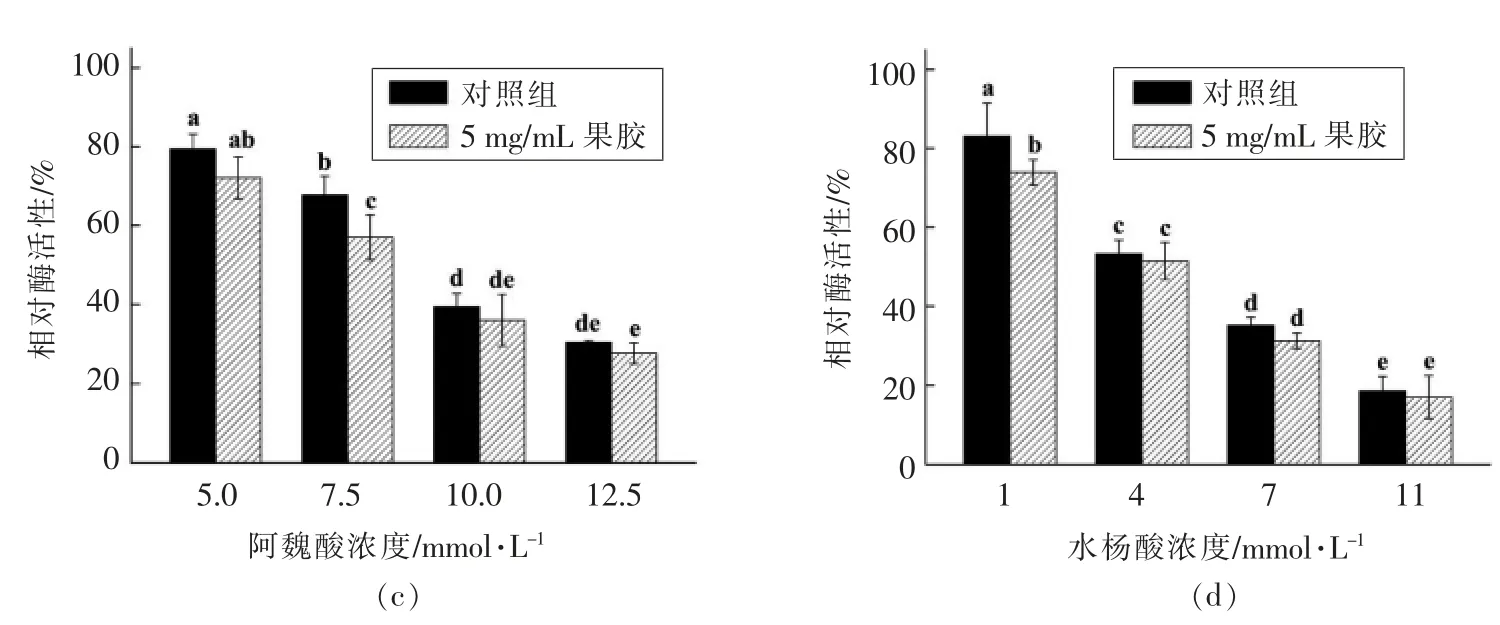
图4 果胶对有机酸抑制PPO 活性的影响Fig.4 Effects of pectin on the inhibition of organic acids on PPO activity

表3 柠檬酸对PPO-果胶体系pH 值的影响Table 3 Effects on pH value of PPO-pectin mixture after treated with citric acid
3 结论
PPO 活性随果胶质量浓度的增加而逐渐下降,但其相对活性始终保持在75%以上。热钝化动力学结果显示:PPO 钝化速率随热处理温度的升高而逐渐加快,但果胶的存在能显著降低PPO 对热钝化的敏感性,从而增强PPO 热稳定性。热处理使PPO 三级结构发生明显改变,然而果胶能增强PPO 在热钝化下构象的稳定性。因此,食品体系中果胶的去除将有助于热处理对PPO 的钝化及果蔬酶促褐变的抑制。本研究从食品组分的角度出发探究果胶对PPO 活性及稳定性的影响,为果蔬制品酶促褐变的控制应用于生产实践中提供理论参考。

