无毒干蟾对流感病毒H1N1感染小鼠炎症反应的影响研究∗
刘 畅 曹鸿云 刘国星 程 淼 徐红日 李 猛秦欣欣 郭雨菲 周鸿威 李雅莉 于会勇△ 王成祥△
(1.北京中医药大学第三附属医院,北京 100029;2.北京中医药大学东直门医院,北京 100700;3.陕西省中医院,陕西 西安 710003)
流行性感冒(以下简称流感)是流感病毒引起的一种急性呼吸道传染病,起病急,部分患者出现肺炎甚至加重发展为重症病例而死亡[1]。严重流感病毒感染所致的“细胞因子风暴”与组织损伤和不良预后直接相关[2]。我国已筛选出多种具有抗流感作用的单味中药,包括黄芩、板蓝根、金银花等[3]。研究发现,蟾蜍及其制剂对乙肝病毒[4]、艾滋病病毒[5]、柯萨奇病毒、腺病毒[6]、流感病毒[7]等感染有着良好的疗效,但由于毒性较大[8],限制了其临床应用。无毒干蟾是在传统干蟾基础上研发的新型专利中药,在临床中对多种病毒感染性疾病有良好的疗效,且未发现明显毒副作用。本研究以流感病毒H1N1感染C57BL/6J小鼠为模型,观察在感染急性期,无毒干蟾对小鼠血清和肺部细胞因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)及趋化因子CCL2、CXCL10表达的影响。
1 材料与方法
1.1 实验动物 SPF级雌性C57BL/6J小鼠,6~8周龄,体质量14~15 g,共32只。购自北京维通利华实验技术有限公司,合格证号SCXK(京)2016-0006,批号110011201108435131,于中国疾病预防控制中心动物房[合格证号SYXK(京)2017-0021]饲养。所有实验符合中国疾病预防控制中心动物实验伦理学规定。
1.2 病毒株 流感病毒亚洲甲型鼠肺适应株A/PR/8/34(H1N1),由中国疾病预防控制中心病毒病预防控制所惠赠,传染病所免疫室保存,MDCK细胞培养传代后,血凝效价为1∶128,小鼠病毒半数致死量(LD50)为1×10-2.625,噬斑试验浓度为4.5×106PFU/mL,-80 ℃保存备用。正式实验前用磷酸盐缓冲液(PBS)稀释成1.8×104PFU/mL病毒液,置于冰浴中备用。
1.3 试药与仪器 1)药物。无毒干蟾(货号x1802901,批号600282972)购自北京同仁堂(亳州)饮片有限责任公司。磷酸奥司他韦胶囊(75mg,国药准字H20065415,批号0221901015,宜昌东阳光长江药业股份有限公司分装)购自北京中医药大学第三附属医院门诊药房。以上实验用药4℃避光保存备用。2)试剂。QIAamp Viral RNA Mini Kit(QIAGEN GmbH公司,货号52904,批号163014099),甲型流感病毒核酸检测试剂盒(实时荧光PCR法)(江苏和创生物科技有限公司,货号CN10-4C-100,批号19100801),TRIzol Reagen[t赛默飞世尔科技(中国)有限公司,货号15596018,批号94204],PrimeScriptTMRT reagent Kit(Perfect Real Time)[宝日医生物技术(北京)有限公司,货号RR037A,批号 AJ91586A],TB GreenTM Premix Ex TaqTMⅡ(Tli RNaseH Plus)[宝日医生物技术(北京)有限公司,货号RR820A,批号AJG1873A],PCR引物由上海生工生物工程有限公司合成。Mouse Magnetic Luminex Assay(10 Plex)(R&D Systems公司,货号 LXSAMSM-10,批 号L136156)。3)主要仪器。生物安全柜(Ⅱ级B2型)(美国NUAIRE公司,型号NU-425-600E),电子天平(瑞士METTLER公司,型号PB153-S/FACT),高通量组织研磨仪(德国Qiagen公司,型号TissuelyserⅡ),小型台式高速冷冻离心机(德国Eppendorf公司,型号5424R),正置白光拍照显微镜(中国尼康公司,型号Eclipse Ci-L),扫描仪[3DHISTECH(Hungary)公司,型号Pannoram⁃ic250],分光光度计(美国Thermo Nanodrop公司,型号ND-1000),实时荧光定量PCR仪(新加坡Applied Bio⁃systems B.V公司,型号7500FAST),Luminex液相芯片分析系统(Luminex公司,型号X-200)。
1.4 分组与造模 实验设空白组、模型组、奥司他韦组、无毒干蟾组,每组8只小鼠。实验动物适应性饲养7 d后称定体质量。除空白组动物外,其余动物按照文献中方法建立甲型流感病毒肺部感染模型[9]。腹腔注射10%水合氯醛(0.1 mL/10 g体质量)轻度麻醉小鼠后,每只小鼠鼻孔内均匀滴入流感病毒液0.02 mL,建立模型。空白组动物隔离饲养在同等条件下的房间,并按同样方法鼻腔接种PBS溶液0.02 mL。
1.5 干预方法 参考文献[10]按直接折算法计算小鼠与人的临床等效剂量。磷酸奥司他韦的给药剂量为19.19 mg/(kg·d),无毒干蟾的给药剂量为感染后第1~3日予2.08 g/(kg·d),感染后第4~7日予1.04 g/(kg·d),模型组给予等量PBS。于感染后2 h开始灌胃给药,每天1次,每次0.3 mL,连续给药7 d。
1.6 标本采集 流感病毒感染后第7日,每组小鼠称体质量,轻度麻醉小鼠后取血,4℃12 000r/min离心10 min分离血清。称取小鼠肺脏质量,收集部分肺组织置于4%多聚甲醛中固定,剩余肺组织-80℃冻存。
1.7 检测指标 1)小鼠一般情况比较:观察各组小鼠体质量、活动、皮毛、呼吸、饮食、大小便等情况。体质量变化百分比(%)=第X天体质量(g)/第0天体质量(g)×100%。2)肺指数:称小鼠体质量后,取肺脏称定质量,计算肺指数。肺指数=肺脏质量(g)/体质量(g)×100%。3)肺组织中病毒载量:取出-80℃保存的肺组织,按照病毒RNA提取试剂盒说明书提取各组样品的流感病毒RNA。PCR反应为20 μL体系,含RNA 2 μL,PCR 反应混合液17.2 μL,酶混合液 0.8 μL。反应条件:42 ℃ 10 min,94 ℃ 10 s,94 ℃ 5 s,50 ℃ 20 s,72 ℃ 20 s,5个循环;94 ℃ 5 s,56 ℃ 50 s,72 ℃ 15 s,40个循环。3)结肠长度:分离回结肠交界处至肛门的结直肠,测量结肠长度(cm)。4)肺组织病理变化:用4%的多聚甲醛固定肺和结肠组织、石蜡包埋、切片(4~5 μm)、苏木素-伊红(HE)染色后,在200倍光学显微镜下观察组织病理变化。参照文献中病理学评分标准[11],每张载玻片随机选取3个视野,利用双盲法对肺组织进行病理学评分。0分:肺泡壁完好无增厚,无炎性浸润,无充血;1分:肺泡壁轻微弥散性炎性细胞浸润(中性粒细胞),肺泡壁无明显增厚;2分:明显和广泛的炎性细胞浸润(中性粒细胞和单核细胞),肺泡壁轻微增厚(1~2倍);3分:严重的炎性细胞浸润,个别区域肺泡壁增厚至3~5倍;4分:严重的炎性细胞浸润,肺泡壁明显增厚,25%~50%肺组织实质化;5分:严重的炎性细胞浸润,肺泡壁明显增厚,>50%肺组织实质化。5)RT-qPCR法检测肺匀浆中细胞因子mRNA表达情况:取出-80℃保存的肺组织,用Trizol法提取各组样品的总RNA。逆转录成cDNA,以cDNA为模板,按TB GreenTMPremix试剂说明,分别加入βactin、TNF-α、IL-1β、IL-6引物进行扩增,见表1。PCR反应为20 μL体系,含cDNA 2 μL,TB Green Premix Ex TaqTMⅡ(2×)10 μL,上下游引物(10 μmol/L)各0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,以RNase Free H2O补足至20 μL。反应条件:95 ℃ 30s,95 ℃ 3 s,60 ℃ 30 s,40个循环,60~95 ℃绘制熔解曲线。采用2-ΔΔCt法计算目的基因相对表达量。6)液相芯片技术检测血清和肺细胞因子表达:采用Luminex液相芯片技术检测小鼠血清和肺细胞因子TNF-α、IL-6、IL-10、IFN-γ及趋化因子CCL2、CXCL10的表达,Luminex X-200仪器读数,绘制标准曲线计算相应浓度。
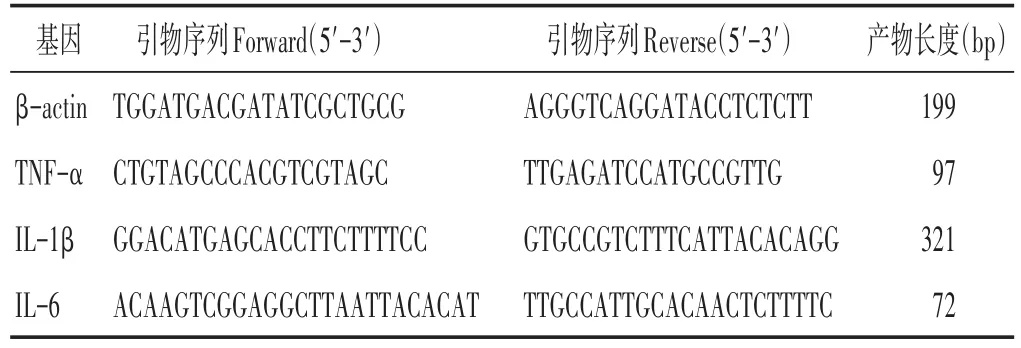
表1 RT-PCR引物序列
1.8 统计学处理 应用SPSS20.0统计软件。计量资料以(±s)表示,多组样本间比较采用单因素方差分析,方差齐时,用LSD进行多重比较,方差不齐采用非参数因子Kruskal-Wallis秩和检验。两组间比较,对于满足正态性时,采用t检验,不满足正态性时用Mann-Whitney秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况及体质量比较 见表2。空白组小鼠皮毛干爽光滑,精神状态良好,活泼,体质量渐增。奥司他韦组和无毒干蟾组小鼠感染初期出现不活泼、食欲不振、挠鼻、喷嚏、排便减少,体质量在流感病毒滴鼻后呈先下降、后回升、再下降趋势,但比模型组体质量下降缓慢,并且活动量稍多,皮毛蓬松及弓背程度较轻,奥司他韦组比无毒干蟾组小鼠症状稍轻,体质量下降更缓慢。
表2 各组小鼠体质量变化百分比比较(%,±s)

表2 各组小鼠体质量变化百分比比较(%,±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗P<0.05,∗∗P<0.01;与奥司他韦组比较,△P<0.05,△△P<0.01。下同。
组别空白组模型组奥司他韦组无毒干蟾组n 8 8 8 8第0天100±0.00 100±0.00 100±0.00 100±0.00第1天97.78±1.28 96.90±0.90 97.74±0.94 96.18±1.79#△第2天100.69±2.11 98.56±2.78#98.42±2.38 99.52±1.80第3天102.15±2.05 98.56±2.71##100.97±1.21 99.78±4.25第4天102.34±2.54 94.04±4.56##98.70±2.08*97.82±3.86#*第5天100.71±2.55 89.35±5.57##96.24±2.88##**95.00±5.96#*第6天100.82±2.87 85.12±5.91##94.50±2.98#**91.21±7.29##*第7天102.91±2.30 77.81±4.05##89.95±5.99##**82.49±5.87##*△△
2.2 各组小鼠肺指数比较 见表3。流感病毒感染后第7日,模型组的肺指数高于空白组(P<0.01);奥司他韦组和无毒干蟾组的肺指数均较模型组降低,差异有统计学意义(P<0.05或P<0.01);无毒干蟾组的肺指数高于奥司他韦组,差异有统计学意义(P<0.05)。
2.3 各组小鼠肺组织病毒载量比较 见表3。模型组小鼠肺组病毒载量较正常组明显升高(P<0.01)。与模型组比较,奥司他韦组和无毒干蟾组小鼠肺组织病毒载量明显降低(P<0.01),奥司他韦组和无毒干蟾组小鼠肺组织病毒载量比较差异无统计学意义(P>0.05)。
表3 各组小鼠肺指数、肺组织病毒载量比较(±s)

表3 各组小鼠肺指数、肺组织病毒载量比较(±s)
组别空白组模型组奥司他韦组无毒干蟾组n 8 8 8 8肺指数(%)0.59±0.04 1.87±0.28##1.11±0.31##**1.48±0.30##*△病毒载量(PFU)0.19±0.08 17 343.64±2328.67##3 807.44±2902.38#**6 274.80±2008.52##**
2.4 各组小鼠肺组织大体解剖观察和病理损伤程度比较 流感病毒感染后第7日,大体解剖发现,正常组小鼠肺组织颜色粉嫩。模型组小鼠肺组织明显变大,呈水肿样肿胀,肺部一叶至多叶甚至整个肺部颜色暗红。奥司他韦组和无毒干蟾组小鼠大体解剖发现,其肺组织水肿样病变较模型组轻,颜色浅,奥司他韦组较无毒干蟾组病变稍轻。见图1。

图1 各组小鼠肺大体解剖观察
流感病毒感染后第7日,观察HE染色肺组织病理变化。正常组:肺组织未见异常,气管和肺泡结构清晰,管腔内无渗出物,血管无扩张充血,基本无明显的炎性细胞浸润。模型组:小鼠肺泡组织结构不清,部分肺泡融合扩张,部分肺泡萎陷不张,肺泡间隔明显增宽,肺间质和肺泡内有蛋白质水肿液及大量炎症细胞浸润,肺微血管充血、出血。奥司他韦组:肺泡萎陷、融合明显改善,肺间质和肺泡水肿不明显,肺泡间隔见少量纤维性渗出,肺间隔内炎细胞渗出有一定好转。无毒干蟾组:肺泡结构较模型组有改善,肺泡萎陷、融合,较模型组有一定好转,炎症细胞浸润较少。见图2。

图2 各组小鼠肺组织病理损伤比较(HE染色,200倍)
2.5 各组小鼠肺组织病理学评分及结肠长度比较见表4。1)肺组织病理学评分:模型组、奥司他韦组和无毒干蟾组的病理评分较空白组不同程度升高(P<0.01)。经药物治疗后,奥司他韦组和无毒干蟾组的病理评分较模型组不同程度下降(P<0.05或P<0.01),奥司他韦组与无毒干蟾组无显著差异(P>0.05)。2)结肠长度:模型组、奥司他韦组和无毒干蟾组的结肠长度较空白组不同程度短缩。其中模型组与无毒干蟾组较空白组明显缩短(P<0.05或P<0.01),而奥司他韦组的差异不明显(P>0.05)。与模型组比较,奥司他韦组和无毒干蟾组的结肠长度较长,差异有统计学意义(均P<0.01)。奥司他韦组和无毒干蟾组的结肠长度无明显差异(P>0.05)。
表4 各组小鼠肺组织病理学评分及结肠长度比较(±s)

表4 各组小鼠肺组织病理学评分及结肠长度比较(±s)
组别空白组模型组奥司他韦组无毒干蟾组n 8 8 8 8结肠长度(cm)6.74±0.18 5.30±0.49##6.38±0.23**6.05±0.53##**肺损伤病理评分(分)0.00±0.00 2.88±0.83##1.75±0.71##**1.88±0.64##*
2.6 各组小鼠肺组织细胞因子基因表达量比较 见表5。流感病毒感染后第7日,模型组小鼠肺组织的TNF-α、IL-1β、IL-6 mRNA相对表达量水平较正常对照组明显升高(P<0.01)。经过干预治疗,无毒干蟾组的促炎性细胞因子TNF-α、IL-1β、IL-6 mRNA相对表达量水平均出现不同程度地下降(P<0.01)。
表5 各组小鼠肺组织细胞因子mRNA相对表达量比较(±s)

表5 各组小鼠肺组织细胞因子mRNA相对表达量比较(±s)
组别空白组模型组奥司他韦组无毒干蟾组n 8 8 8 8 TNF-α mRNA 1.88±0.41 128.39±22.22##96.23±18.69##**75.85±12.37##**IL-1β mRNA 0.87±0.20 600.99±145.33##62.37±18.39##**18.00±5.57**IL-6 mRNA 5.39±2.00 52.70±11.50##26.88±5.23##**8.36±3.13**
2.7 各组小鼠血清和肺组织中细胞因子含量比较见表6。流感病毒感染后第7天,模型组小鼠血清中TNF-α、IL-6、IL-10、IFN-γ、CCL2、CXCL10的水平较空白组明显升高(P<0.01或P<0.05)。奥司他韦组和无毒干蟾组血清中细胞因子TNF-α、IL-6、IL-10和趋化因子CCL2、CXCL10的水平较模型组显著降低(P<0.05或P<0.01),无毒干蟾组血清IFN-γ的含量与模型组差异无统计学意义(P>0.05)。模型组小鼠肺组织的TNF-α、IL-6、IL-10、CCL2、CXCL10的表达量较空白组明显升高(P<0.01)。经过干预治疗,奥司他韦组和无毒干蟾组肺组织的促炎性细胞因子TNF-α、IL-6和趋化因子CCL2、CXCL10的浓度均显著下降(P<0.05或P<0.01),无毒干蟾组细胞因子IL-10和IFN-γ的水平均较模型组显著降低(P<0.05或P<0.01)。
表6 各组小鼠血清和肺组织细胞因子水平比较(pg/mL,±s)

表6 各组小鼠血清和肺组织细胞因子水平比较(pg/mL,±s)
组别空白组(n=8)模型组(n=8)奥司他韦组(n=8)无毒干蟾组(n=8)部位血清肺组织血清肺组织血清肺组织血清肺组织TNF-α 1.24±0.47 0.71±0.12 5.54±1.71##19.13±4.30##3.43±1.32##*13.60±2.41##*1.69±0.60**7.40±3.96#**IL-6 7.40±5.75 63.65±17.78 236.99±68.77##610.04±96.79##73.10±58.42**222.68±133.94#**25.47±16.82**426.23±30.16##*△IL-10 4.91±1.91 20.86±15.62 17.69±4.13##73.19±27.54##12.90±2.06##*62.48±13.33##11.29±0.93##*18.14±3.87**△IFN-γ 3.55±1.48 15.54±4.19 114.08±59.55#290.15±125.06##242.86±90.32##*441.28±171.49##77.44±59.31△△82.81±35.82*△△CCL2 117.39±21.25 150.69±10.10 223.12±39.31##8 572.67±2 084.47##162.82±46.12#**4 828.70±1 518.41##**130.50±15.64**3 103.33±362.69#**CXCL10 26.84±10.43 22.99±7.08 569.78±146.64##8 089.89±2 938.30##322.07±95.07##**5 127.50±4 437.46##*151.45±96.23**△2 201.67±402.21##**△
3 讨 论
流感病毒肺炎属于中医学“温病”范畴,中医药防治流感已有数千年历史。蟾蜍是一种药用价值很高的动物,蟾酥、干蟾皮、蟾衣等均是药材。研究发现,蟾酥注射液对疑似甲型H1N1流感高热患者具有良好的退热效果,显效率达90%[9]。蟾苷提取物能明显降低流感病毒感染小鼠肺指数、抑制肺内病毒繁殖[12]。蟾毒内酯对流感病毒FM1具有直接灭活作用,对流感病毒感染小鼠肺组织具有修复和保护作用[13]。本课题组前期对含有蟾酥的六神丸进行了体外抗病毒实验研究,发现六神丸可减轻病毒感染HEp-2细胞病变反应。
预实验中,无毒干蟾组的给药剂量为1.04 g/(kg·d),连续给药7 d,发现与模型组比较,无毒干蟾组小鼠体质量、肺指数和结肠长度均有保护作用的趋势,但差异尚无统计学意义。根据本文通信作者王成祥教授的临床经验,急性感染期,邪气较剧时,应当加大给药剂量才可阻断进展,因此本研究将前3 d的给药剂量增加一倍,即2.08 g/(kg·d),后4 d仍为1.04 g/(kg·d),观察发现与模型组比较,无毒干蟾组的小鼠体质量、肺指数和结肠长度均有明显保护作用。
本实验研究证实,流感病毒感染急性期,模型组小鼠体质量明显下降,肺指数和肺病毒载量明显升高,肺组织炎症反应严重程度达到高峰,肺组织中出现黏膜水肿、充血、炎症细胞浸润明显等。肺组织高表达促炎因子TNF-α mRNA、IL-1β mRNA和IL-6 mRNA升高,血清和肺组织高表达促炎性细胞因子TNF-α、IL-6及趋化因子CCL2、CXCL10升高,同时抗炎性细胞因子IL-10水平也升高,且肺部炎症病变程度与TNF-α mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α、IL-6、CCL2、CXCL10的水平相一致。TNF-α促进微静脉的黏附分子表达,导致细胞外渗进入肺部,同时招募细胞到炎症和正常组织,促进产生趋化因子,是反映肺部感染及病变程度的良好指标[14]。IL-1β是主要的快速反应促炎介质,在肺部炎性疾病早期有重要的作用[15]。IL-6在急性炎症反应中参与急性期反应蛋白的合成,是参与病毒感染过程的关键细胞因子。CCL2可趋化单核-巨噬细胞、记忆性T淋巴细胞和树突状细胞聚集,促进初始T细胞增殖和TNF-α产生[16]。CXCL10可趋化T淋巴细胞、自然杀伤细胞和单核细胞聚集,促进IFN-γ、IL-6、IL-8等多种细胞因子分泌[17]。CCL2和CXCL10与流感病毒感染引起的肺部损伤的严重程度密切相关。IFN-γ主要介导与细胞毒和局部炎症有关的免疫应答。以上实验结果表明,流感病毒感染后,小鼠体内过度的因子释放会引起剧烈的炎性反应,产生组织病理变化,因此药物干预使免疫状态达到平衡是非常重要的。
本实验研究证实,无毒干蟾能够降低流感病毒感染后血清和肺组织中促炎性细胞因子TNF-α mRNA、IL-1β mRNA、IL-6 mRNA,血清和肺组织中促炎性细胞因子TNF-α、IL-6和趋化因子CCL2、CXCL10的过度表达,减少肺组织充血、水肿和炎性细胞浸润,减轻肺组织的病理变化,抵抗流感病毒感染导致的急性肺损伤。无毒干蟾下调了流感病毒感染后小鼠血清和肺组织中IL-10和IFN-γ的过表达,在一定程度上抑制机体过度的抗炎反应,有助于免疫细胞清除流感病毒的同时不使免疫系统受抑制,从而使机体的免疫状态达到平衡,有利于流感病毒感染后靶器官病理损伤的修复[18]。
同时,实验还发现,流感病毒感染后的小鼠排便减少、结肠变细、结肠长度缩短,磷酸奥司他韦和无毒干蟾干预后的小鼠较模型组排便增多、结肠变粗、结肠变长,提示流感病毒感染引起肺部损伤的同时,对于结肠的生理状况也有一定的影响,而无毒干蟾可以改善结肠的不良状况。中医有颇多肺与大肠相表里的相关记载。《黄帝内经》言“肺合大肠”。“肺手太阴之脉,起于中焦,下络大肠,还循胃口……大肠手阳明之脉……络肺,下膈属大肠”。肺“主气,司呼吸”“主宣发肃降”“大肠者,传导之官,变化出焉”。大肠的主要功能是传导糟粕,排泄大便,肺的肃降功能促成了糟粕在大肠的传导,一旦肺系疾病产生,肃降功能受到影响,大肠即传导失司。
综上所述,本研究发现,无毒干蟾对于流感病毒H1N1感染后的急性肺损伤有一定的保护和修复作用,同时对结肠也有一定的保护作用。无毒干蟾的抗流感效果值得进一步研究。

