吸入激素联合奥马珠单抗治疗中重度儿童过敏性哮喘合并过敏性鼻炎自身前后对照试验
彭俊争 樊慧峰 张彩凤 陈容珊 赵斯静 何春卉
奥马珠单抗为重组人源免疫球蛋白E(IgE)单克隆抗体,在国外临床应用于儿童哮喘已有10余年,研究表明其对于6岁以上儿童及成人中重度过敏性哮喘的疗效肯定[1-3]。由于费用昂贵等原因,未能同步应用于国内,关于中国哮喘儿童应用奥马珠单抗的有效性和安全性临床报告不多。本文报告中重度过敏性哮喘合并过敏性鼻炎儿童接受吸入激素联合奥马珠单抗治疗的自身前后对照试验的结果。
1 方法
1.1 伦理 本研究已获得广州医科大学附属广州市妇女儿童医疗中心(我院)伦理委员会审批通过,伦理号:穗妇儿GCP(IEC)批字[2020]第21号。
1.2 纳入标准 ①2019年1月至2020年7月在我院呼吸专科门诊符合中重度过敏性哮喘合并过敏性鼻炎诊断的年龄6~18岁儿童[4,5],②征得患儿及其监护人同意愿意接受吸入激素+奥马珠单抗治疗,并签署知情同意书;③能够负担16周疗程费用;④使用奥马珠单抗前血清IgE 75~1 500 IU·mL-1,且排除其他疾病引起的高IgE血症;⑤生命体征平稳;⑥哮喘非急性期发作状态。
1.3 治疗方案 吸入激素分级治疗方案如下。①第三级治疗:吸入布地奈德/福莫特罗80 μg/4.5 μg,q 12 h;②第四级治疗:吸入布地奈德/福莫特罗80 μg/4.5 μg,q 6~8 h;③第五级治疗:吸入布地奈德/福莫特罗80 μg/4.5 μg,q 6 h,口服强的松。过敏性鼻炎治疗药物:每日每侧鼻孔糠酸莫米松鼻喷雾剂 50 μg。
奥马珠单抗治疗方案:①注射用奥马珠单抗为诺华公司产品(批号:SCN79),保存于2~8℃专柜冰箱。②依据《奥马珠单抗治疗过敏性哮喘的中国专家共识》[6],规律皮下注射16周。③剂量≤150 mg可同一个部位(双上臂三角肌区),剂量>150 mg分2~4个部位,分别于双上臂三角肌区和双大腿外侧中段皮下注射。④根据患儿体重及血清总IgE水平,对照奥马珠单抗药物说明书上的剂量表选择相应的治疗剂量,每次75~600 mg,间隔2~4周。⑤注射护士接受专门培训。⑥不良事件观察处置:治疗室配备抢救药物及相关设备,如出现不良反应,按照反应类型及严重程度处理,立即停止给予药;予吸氧、肌注肾上腺皮质、激素等救治处理;首次注射后在院观察2 h,以后注射后在院观察0.5 h。每次注射前护士均询问最近2~4周的不良事件,第1次注射后的第3 d电话随访不良事件。
1.4 观察指标
1.4.1 主要观察指标 支气管哮喘控制:①4~11岁采用儿童哮喘控制测试(C-ACT)进行评分,评估过去4周内哮喘妨碍日常活动、影响运动、喘息致夜间觉醒等,1~4题由儿童独立完成(每题4个选项,0~3分),5~7题由家长独立完成(每题6个选项,0~5分),得分范围0~47分,≥20分为哮喘得到控制,<20分为哮喘未控制。②≥12岁儿童采用ACT评分,评估过去4周内哮喘控制程度,共5个问题,均由患儿独立完成(每题5个选项,0~5分),得分范围0~25分,<20分为哮喘未控制,~24分为部分控制,25分为完全控制。C-ACT/ACT评分在治疗前后增长≥3分定义为治疗有效。于注射后在院观察时间内,由接受相关培训的专科护士开展问卷调查。
1.4.2 次要观察指标 ①鼻炎和咳嗽症状情况:均采用视觉模拟评分法(VAS),患儿根据自身感受在标记0~100 mm的直线上划记相应刻度表示鼻炎和咳嗽症状的程度,其中0代表无症状,100代表症状最严重。②哮喘儿童生活质量(PAQLQ)评估:适用7~16岁哮喘患儿,症状维度10题、活动受限维度5题、情感维度8题,得分越高提示生活质量越佳,由患儿独立完成。③儿童生存质量量表pedsQLTM3.0 哮喘模块[7]用于评估2~6岁儿童,4个维度(哮喘的症状、治疗相关问题、忧虑、沟通)28个问题。每个问题的回答选项分为0(0分)、1(25分)、2(50分)、3(75分)、4(100分) 5个等级。 总表的分数为各问题分数的总和除以全量表应答问题数,满分为100分,分数越高,说明生存质量越好,由患儿家长独立完成。④肺功能:第1 s用力呼气容量(FEV1) 、FEV1占预计值百分比(FEV1% Pred) 、1 s率(FEV1/ FVC) 、小气道参数等肺功能指标及呼出气一氧化氮浓度(FeNO)等。⑤身高及体重增长情况:采用同一身高体重测量仪进行测量,被测试者赤足,身着轻装立正姿势站在身高体重测量仪的底板上(上肢自然下垂,足跟并拢,足尖分开呈60度),记录身高、体重,并对应中国儿童生长曲线百分位[8]。
1.4.3 评估时点 C-ACT、ACT、VAS评分以及PAQLQ/pedsQLTM3.0哮喘模块于每次奥马珠单抗注射前和治疗16周进行评分,在接受过相关培训的专科护士陪同下完成;肺功能、身高和体重于奥马珠单抗治疗开始前和完成16周时评估。
1.5 统计学方法 采用统计学软件GraphPad Prism 8.0分析处理数据,符合正态分布的计量资料采用xˉ±s表示,多组间比较采用重复测量资料的方差分析(多组间两两比较采用LSZ法), 2组间比较采用配对t检验,非正态分布资料采用M(IQR) 表示,比较采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 符合本文纳入标准的35例中重度过敏性哮喘伴过敏性鼻炎患儿进入分析,其中男22名,女13名,年龄(9.3±2.6)岁,体重(31±9.6)kg;身高(134.8±13.8)cm;屋尘螨过敏23例,粉尘螨过敏22例,牛奶过敏5例,全蛋过敏6例;哮喘3和4级治疗方案共32例,5级治疗方案3例;WBC(7.5±1.6)×109·L-1,嗜酸性粒细胞比例(5.7±2.5)%,平均IgE水平340(168~583) IU·mL-1。
2.2 奥马珠单抗治疗前后临床疗效比较 表1显示,奥马珠单抗治疗4周后C-ACT/ACT评分、鼻炎和咳嗽VAS评分、PAQLQ/pedsQLTM3.0哮喘模块评估好转,差异均有统计学意义(P<0.05)。其中1例奥马珠单抗治疗4周后出现C-ACT评分下降,回顾病史,因治疗期间剧烈运动后出现喘息,继续治疗后C-ACT评分逐步改善。35例患儿治疗16周后较治疗前C-ACT/ACT评分改善均>3分,治疗16周后鼻炎和咳嗽VAS评分、PAQLQ/pedsQLTM3.0哮喘模块评估均较治疗4周后进一步改善。其中4例对于吸入激素抵触,要求激素总量尽量少,相关评分也均有改善。

表1 过敏性哮喘合并过敏性鼻炎患儿吸入激素联合奥马珠单抗治疗前后临床评估(xˉ±s)
2.3 治疗前后肺功能及FeNO评估比较 表2显示,奥马珠单抗治疗16周后,肺功能和FeNO评估指标均较治疗前明显改善,差异有统计学意义(P<0.05)。

表2 吸入激素联合奥马珠单抗治疗前后肺功能及FeNO评估比较(xˉ±s)
2.4 治疗前后身高、体重增长情况评估 表3显示,35例患儿治疗16周后,身高均较治疗前增高,平均增长(3.8±4.0)cm,差异有统计学意义(P<0.000 1),身高百分位数增长差异有统计学意义(P<0.05);32例患儿治疗16周后体重较治疗前增加,平均增加(2.9±3.3)kg,差异有统计学意义(P<0.000 1),体重百分位数增长差异无统计学意义(P>0.05)。
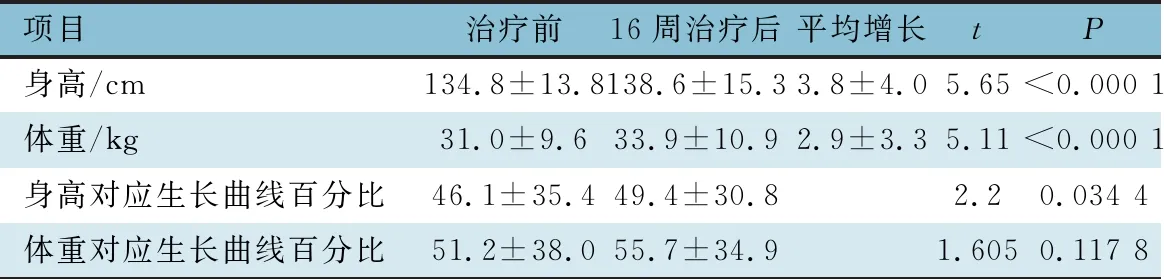
表3 吸入激素联合奥马珠单抗治疗前后身高、体重评估比较(xˉ±s)
2.5 治疗期间不良反应评估 35例患儿均顺利完成16周治疗,治疗期间1例出现注射部位皮肤瘙痒。
3 讨论
奥马珠单抗是首个治疗哮喘的靶向药物,对儿童哮喘疗效肯定[9],但其应用于哮喘合并其他过敏性疾病的儿童研究相对少见。本研究中35例中重度过敏性哮喘合并过敏性鼻炎患儿在接受吸入激素联合奥马珠单抗治疗4周后C-ACT/ACT评分、咳嗽VAS评分、PAQLQ/pedsQLTM3.0哮喘模块评估均有改善,只有1例患儿因剧烈运动后出现喘息导致C-ACT评分暂时降低,后继续治疗症状逐步改善,提示奥马珠单抗不仅有助于过敏性哮喘控制,同时可减少哮喘急性发作所需缓解药物的剂量,减少病情恶化到急诊就诊及住院可能,与国外研究[10]一致。
奥马珠单抗对其他过敏性疾病如过敏性鼻炎、变应性真菌性鼻窦炎、变应性皮炎、慢性自发性荨麻疹等均有疗效[11-14]。本研究中35例患儿全部合并过敏性鼻炎,在接受奥马珠单抗治疗4周后,所有患儿鼻炎VAS评分改善,提示奥马珠单抗对哮喘儿童合并的过敏性鼻炎治疗有效而且起效时间较快。
有资料显示奥马珠单抗可改善肺功能FEV1[15-17],本研究中FEV1/FVC%预计值治疗前后差异有统计学意义,MEF25%和MEF50%预计值提高,提示对小气道通气功能的改善较明显,同时FeNO明显降低可能与嗜酸性气道炎症缓解相关[18]。本研究显示奥马珠单抗治疗过敏性哮喘合并过敏性鼻炎儿童可明显减轻气道炎症,改善肺功能特别是小气道通气功能。
吸入激素对身高生长可能有一定的影响[19-20],不少患儿家庭对激素治疗存在顾虑。本研究中,奥马珠单抗治疗16周后患儿身高均增长,体重亦有相应增幅,其原因可能在于:疗程中减少了糖皮质激素的使用剂量,日间症状缓解、运动耐受力增加,夜间症状改善、睡眠质量好转促进生长激素释放等。
本研究中1例患儿接受注射后数分钟内肌注处出现红色皮疹伴瘙痒,未经特殊处理后自行缓解,后续治疗中未再出现,原因不明确,不排除与其辅剂诱发过敏反应相关。严重者可出现全身过敏反应[6],故注射后需严格按照指南进行足够时间的观察,而不良事件诸如血栓形成[21-22]等未在本研究中观察到。
综上所述,奥马珠单抗应用于过敏性哮喘合并过敏性鼻炎儿童中,可早期缓解呼吸道症状,改善肺功能,提高生活质量,且不影响生长发育,安全性良好。
本文不足和局限在于,样本量小,研究对象的观察时长较短,对奥马珠单抗的确切疗程暂未确定,包括停药观察的时机及停药后相应指标的变化未纳入研究范围。

