Xpert MTB/RIF与传统PCR在低载量结核病诊断中的应用价值
刘永霞 王慧 刘喜德 蔡龙
结核病是一种传染病,不良健康状况的主要原因,也是全世界十大致死因素之一[1]。2020 年世界卫生组织最新报告分析,全世界总数的三分之二分布在8 个国家,其中中国占比8.4%。根据世界卫生组织指南,需要对结核病进行细菌学确诊,并使用快速分子检测、培养法或测序技术进行耐药性检测[2]。世界卫生组织推荐结核分枝杆菌rpoB 基因和突变检测试剂盒(以下简称Xpert MTB/RIF)技术作为快速分子检测的方法之一[3]。目前对低载量结核病研究较少,因此本次研究旨在探究Xpert MTB/RIF 技术检测与传统聚合酶链反应(polymerase chain reaction,PCR)在低载量结核病诊断中的应用价值。现报道如下。
1 资料与方法
1.1 一般资料 选择2020 年1 月至2020 年12 月在浙江大学医学院附属杭州市胸科医院同时利用Xpert MTB/RIF 和传统PCR-荧光探针法检测结核病且有罗氏培养或BACTEC MGIT 960(以下简称MGIT 960)培养的2 149 例临床患者。截止写稿前仍有85 例尚在培养,因此共纳入2 064 例,其中男性1 295 例、女性769 例;年龄4~97 岁,平均年龄(48.39±20.75)岁。本次研究经医院伦理委员会审批,且所有患者均签署知情同意书。
1.2 方法
1.2.1 标本留取 每份标本分为3 份,分别用于培养、Xpert MTB/RIF 和传统PCR-荧光探针法。
1.2.2 罗氏培养 每例患者标本首先采用4%的氢氧化钠溶液对痰标本进行充分液化,静置15 min 后用无菌滴管取100 μl 接种到2 管酸性罗氏培养基(由杭州创新生物检控技术有限公司生产),同时将剩余的液化标本送至分子生物检测室。每周观察1 次培养基,发现菌落生长后,经分子检测确诊报告培养阳性;2 个月未见菌落生长报告为培养阴性。同1 例患者的2 管接种标本中,任何一管发现抗酸杆菌生长即判定为培养阳性。
1.2.2 MGIT 960 培养 挑取标本至50 ml 已标记的离心试管中,加等量的前处理液(不超过10 ml),强力旋涡振荡20 s。室温静置15~20 min;加无菌磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 6.8)至约45 ml,盖紧盖子,离心3 000 g,15 min,倒掉上清夜,留取沉淀,添加1~2 ml PBS 混匀,接种前,在MGIT 培养管(由美国BD 公司生产)中先加入0.8 ml以MGIT营养添加剂溶解后的MGIT杂菌抑制剂,接种0.5 ml 处理后的标本至MGIT 培养管中,菌株经分子检测确诊报告培养阳性。
1.2.3 Xpert MTB/RIF 技术检测 样本加入2 ml 样本处理液,如是灌洗液,穿刺液等液体,<2 ml 则可加入等量处理液,若>2 ml 则离心后再加入2 ml 处理液,剧烈震荡20 次,或涡旋振荡10 s,室温孵育10 min;再重复振荡步骤,室温孵育5 min,将2 ml加入试剂匣(由美国Cepheid 公司生产)。CT 值<40判定为阳性。CT 值28~40 判定为检测值非常低或极低,则认为结核分枝杆菌低载量样本,5 条荧光探针CT值导出,计算均值。
1.2.4 PCR-荧光探针法 标本加入等量4%氢氧化钠溶液,震荡混匀放置30 min,取1 ml 液化标本装入1.5 ml 无菌离心管,12 000 r/min,5 min,弃上清。加入1 ml 洗液12 000 r/min,5 min,弃上清。加入50 μ l 核酸提取液(由北京博奥医学检验所有限公司生产),充分涡旋后转入核酸提取管放入核酸提取仪,最大转速震荡5 min。95 ℃放置5 min,5 000 r/min,1 min。取2 μl 样本加入扩增反应管中,上机。CT 值<40 判定阳性,扩增曲线不是S 型或CT值为40(或无任何数值)判定为阴性。
1.3 统计学方法 采用SPSS 21.0 软件对数据进行统计分析。非正态分布的计量资料以中位数(四分位数)表示,采用秩和检验;计数资料采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
2.1 两种检测方法对结核病的诊断效能比较见表1
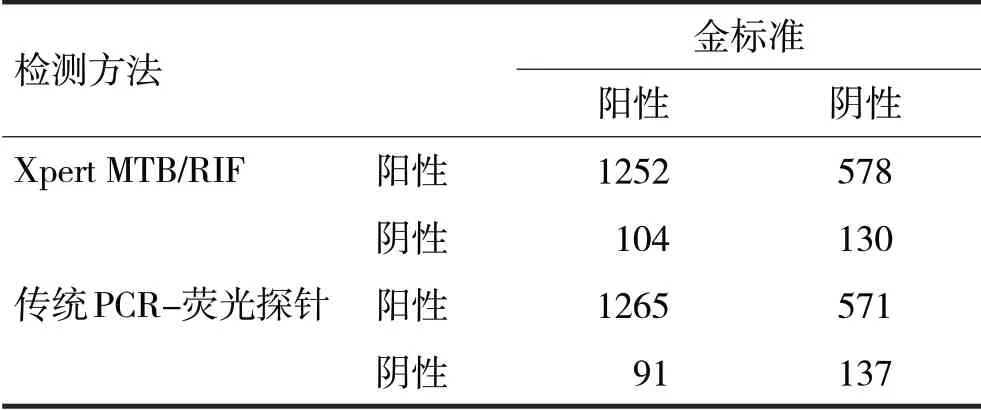
表1 两种检测方法对结核病的诊断效能比较/例
由表1可见,Xpert MTB/RIF 检测和传统PCR 荧光探针两种方法对结核病的灵敏度分别为92.33%、93.29%,差异无统计学意义(χ2=0.09,P>0.05)。
2.2 CT 值 515 例Xpert MTB/RIF 低载量样本中,两种方法检出CT 值<40 的各有364 例,其中有151 例PCR荧光探针法未检出。
Xpert MTB/RIF 对结核分枝杆菌低载量样本检测的CT 值为30.38(29.55,31.68),小于传统PCR-荧光探针法检出的CT 值32.00(28.00,35.00),差异有统计学意义(Z=2.68,P<0.05)。
2.3 低载量样本类型 515 例低载量样本,其中Xpert MTB/RIF检出CT值28~40有387 例,PCR荧光探针法检出CT值28~40有128 例。两种检测方法在结核分枝杆菌低载量的标本类型分布表见表2。
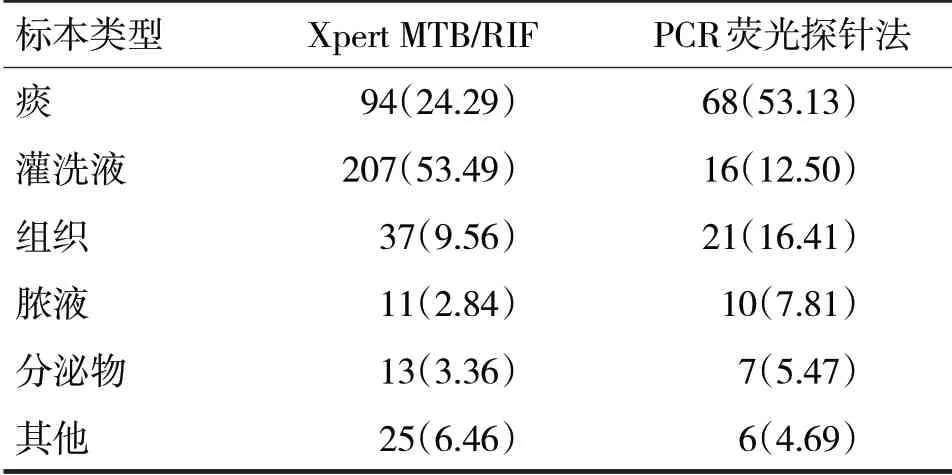
表2 两种检测方法在结核分枝杆菌低载量的标本类型分布/例(%)
由表2 可见,在结核分枝杆菌低载量样本中,Xpert MTB/RIF 和PCR 荧光探针法两种方法检测的标本类型分布比较,差异有统计学意义(χ2=74.18,P<0.05)。
3 讨论
及早准确地发现结核病是结核病控制的关键。为了在短时间内得到结果,核酸扩增试验在世界范围内被越来越多地用于结核病的快速诊断[4]。目前常用的是Xpert MTB/RIF 检测方法和PCR 荧光探针法[5]。本次研究主要评估传统PCR 荧光探针和Xpert MTB/RIF 检测诊断结核病的性能。两种分子诊断的方法已广泛应用于临床结核病的诊断。本实验前期对非呼吸道标本做过一些分析,发现Xpert MTB/RIF 检测方法存在一定的优势[6],但在低载量结核分枝杆菌的样本中并未见研究。Xpert MTB/RIF 检测方法是世界卫生组织推荐的检测结核分枝杆菌的快速方法,公认的高灵敏度和特异性。
本次研究结果显示,两种分子诊断方法在结核病诊断效能并无明显差异(P>0.05)。在结核分枝杆菌低载量情况下,Xpert MTB/RIF 检测的CT 值小于传统PCR-荧光探针法(P<0.05)。可见结核分枝杆菌低载量的情况下,Xpert MTB/RIF 检测方法存在一定的优势。
呼吸道标本中,Xpert MTB/RIF 在灌洗液标本中检测存在明显优势,而传统的PCR 荧光探针法则在痰液标本中存在一定优势。分析其原因,可能是灌洗液是下呼吸道标本,干扰物质较少,检测灵敏度占优势。而痰液含有杂质较多,Xpert MTB/RIF 检测前处理简单,直接处理加样,受杂质干扰较大,而传统的PCR 荧光探针法则手工提取痰液结核分枝杆菌核酸,经过洗液清洗离心步骤去除一定的抑制物干扰[7]。
非呼吸道标本中,Xpert MTB/RIF 检测灵敏度存在较大差异,尽管特异度较高[8]。本次研究结果显示,两组均是组织占比例较大。也曾有研究者发现在肺外标本的检测,传统的PCR 荧光探针灵敏度更高[9]。分析原因可能是组织块较大,含血、油脂等抑制物较多,前处理如没有经过组织研磨,以及去油脂处理,Xpert MTB/RIF 检测则受极大影响。
综上所述,在结核分枝杆菌低载量的情况下,Xpert MTB/RIF 检测具有一定优势,但亦受标本类型影响。传统PCR 荧光探针法可同时检测非结核分枝杆菌的感染情况,也为临床鉴别诊断和治疗提供很大帮助。Xpert MTB/RIF 检测和传统PCR 荧光探针法优势互补,同时检测提高灵敏度,为临床提供更多有价值的信息。但本次研究因标本量有限,后期需扩大分析样本量,多方面多角度同时分析,减少分析误差。

