PCB 酸性蚀刻液中不同缓蚀剂对铜蚀刻的影响及模拟计算研究
向枫,吴道新,匡尹杰,肖忠良,蒋峥瑾,聂国勇
(1.长沙理工大学 化学与食品工程学院,长沙 410014;2.长沙利洁环保科技有限公司,长沙 410006)
印制电路板(简称PCB)作为组装电子元器件的支撑载体,在电子信息产业中发挥着十分重要的作用。随着电子产品不断朝着小型化、轻量化、高速化、多功能化的方向发展,PCB 行业对于高精度、高密度电路板的关注度越来越高[1-2]。在其线路制作工艺中,蚀刻是进行图形转移后,实现线路图形至关重要的一道工序,直接决定了产品的质量水平和成品率,控制好蚀刻过程是确保整个PCB 质量和性能的关键。
自20 世纪60 年代以来,蚀刻液经过了多种类型的更新与改进,主要包括氯化铁蚀刻液、过硫酸铵蚀刻液、硫酸/铬酸蚀刻液、硫酸/过氧化氢蚀刻液、碱性氯化铜蚀刻液、酸性氯化铜蚀刻液等。由于酸性氯化铜蚀刻体系具有蚀刻速度快、稳定性好、蚀刻均匀、侧蚀小、易再生等优点,适合加工高精密印制电路板,是目前应用最广泛的蚀刻液,其主要成分包含CuCl2、HCl 和NH4Cl[3-6]。在蚀刻过程中,蚀刻药液经过喷头均匀地喷淋到铜箔表面,药水中的Cu2+与没有蚀刻阻剂保护的铜箔发生氧化还原反应,从而将不需要的铜反应掉,露出的基材再经过剥膜处理后,使线路成型。
水平蚀刻时,蚀刻液不仅在垂直方向与铜箔发生反应,产生纵向腐蚀,也会在铜箔的横向方向与其接触,产生横向腐蚀。随着蚀刻时间的增加,侧蚀就会越加严重,线路的蚀刻因子也会随之减小,信号传输的可靠性就会变差[7-8]。针对此问题,已有不少学者在文献中提到了相关的解决方案。如钟忆青等[9]通过加入蚀刻添加剂提高纵向蚀刻速度,同时也起到了减缓侧蚀的作用。李高升等[10]采用2-MBT 与2-苯氧基乙醇(MSDS)协同提高酸性蚀刻液的蚀刻因子。对于缓蚀剂在蚀刻过程中的作用机理探讨方面,研究较少。因此,为进一步探讨缓蚀剂在蚀刻过程中的作用机理,本文通过静态挂片失重法和塔菲尔极化曲线,研究BTA、BZI 和2-MBT 对酸性蚀刻液蚀刻因子的影响,并利用密度泛函理论以及分子动力学来探讨缓蚀剂在Cu(111)面的作用机理[11-12]。
1 实验
1.1 静态挂片实验
碱液成分:NaOH 15 g/L,Na2CO320 g/L,Na3PO450 g/L,Na2SiO35 g/L,OP-10 1 mL/L。酸性蚀刻液:CuCl2·2H2O 295.354 g/L,HCl(36-38%)166.67 mL/L,NH4Cl 25 g/L,KNO31.0 g/L,柠檬酸三铵1.0 g/L,十二烷基苯磺酸钠0.04 g/L,缓蚀剂(BTA、BZI、2-MBT)0.04 g/L。所有药品均为分析纯。
实验流程:取板(20 mm×20 mm×1.3 mm 的覆铜板试片)→除油(碱液)→流动水洗→去离子水洗2次→热风干燥→分析天平称量→蚀刻(酸性蚀刻液)→流动水洗→去离子水洗2 次→热风干燥→称量。
采用静态全浸法,在50 ℃、15 min 的条件下,测试覆铜板铜箔的蚀刻速率,探究不同浓度的缓蚀剂(BTA、BZI、2-MBT)对酸性蚀刻液缓蚀效率的影响。试验采用失重法计算蚀刻速率[13],计算公式如式(1)所示:

式中:v为蚀刻速率,μm/min;∆m为蚀刻质量,mg;A为蚀刻面积,cm2;ρ为铜的密度(8.96 g/cm3);t为蚀刻时间,min。
缓蚀效率η表示酸性蚀刻液缓蚀剂对铜箔蚀刻速率的抑制能力,定义为式(2):

式中:v、v0分别为在不含和不含缓蚀剂的酸性蚀刻液中铜箔的蚀刻速率。
1.2 蚀刻因子的测试
选取相应的线路部位,将蚀刻后的覆铜板裁切成5 mm×10 mm 的小试片,用镶嵌样品夹固定试片的位置,待磨面朝上。将其水平放入橡胶模具中后,再倒入填料(m环氧树脂∶m固化剂=3∶1),静置一段时间凝固硬化即可。将制好的样品在研抛机上进行研磨、抛光,然后再利用金相显微镜(日本尼康 NiKon LV101)观察试片上线路的横截面,最后依据式(3)来计算蚀刻因子F[14]。

式中:H为铜箔厚度,μm;a为上底宽,μm;b为下底宽,μm。
1.3 Tafel 极化测试
极化曲线测试由电化学工作站(CHI660D,上海辰华仪器公司)完成,采用三电极体系,以10 mm×10 mm 的铜箔试片作为工作电极,饱和甘汞电极(SCE)作为参比电极,铂电极作为辅助电极。以开路电位为中心,进行Tafel 极化,初始电压设置为–0.33 V,终止电压设置为 0.22 V,扫描速率为0.005 V/s。本实验测试液为基础液、基础液+BTA、基础液+BZI、基础液+2-MBT,实验温度为50 ℃,由恒温水浴锅控制。
1.4 量子化学计算
量子化学方法计算运用Material Studio 软件中基于密度泛函理论的DMol3 模块,使用B3LYP 方法以及在DND 基组水平上对缓蚀剂分子BTA、BZI、2-MBT 以及H2O 分子进行几何优化[15-18]。通过计算模拟得到缓蚀剂分子的前线轨道分布、化学势μ、软度S、硬度η和亲电指数ω等化学参数,用于分析缓蚀剂分子的全局反应活性。通过计算得到的局部参量福井(Fukui)指数用于分析缓蚀剂分子的局部反应活性,获得最佳反应位点[19-21]。酸性蚀刻液的3 种缓蚀剂分子BTA、BZI、2-MBT 以及H2O 分子的优化几何构型如图1 所示。
图1 3 种缓蚀剂分子及H2O 分子的优化构型Fig.1 Optimization configuration of the molecule of three corrosion inhibitor and H2O
1.5 分子动力学计算
首先导入MS 软件中已有的纯Cu 晶胞模型,然后在 Build|Surface|Cleave Surface 模式中进行Cu(111)面的切割。设置Fractional 中Top 值为1.0,Thinckness 值为3.0,基于切割的Cu 晶面通过Build|Symmetry|Supercell,建立成U=15、V=15 的超晶胞。为了更好地模拟Cu 表面的吸附,确保周期性结构间无相互作用,在Build|Crystals|Build Vacuum 中将真空度设置为0,建立Cu(111)面无定型盒子。几何优化后Cu(111)面的超晶胞构型如图2 所示。

图2 Cu(111)面的几何构型Fig.2 Geometrical configuration of Cu(111)
将优化好的缓蚀剂分子BTA、BZI、2-MBT 使用Build|Crystals|Build Crystals 进行无定形盒子的构建,为保证缓蚀剂分子无定形盒子后续能够成功叠加,需调整其长与宽尺寸与Cu(111)超晶胞尺寸一致。水分子无定形盒子的建立则使用Amorphous Cell 模块|Calculation,并在计算参数设置页面上选取200个 H2O 分子进行无定形盒子的构建,其大小也与Cu(111)超晶胞的尺寸一致。随后,将构建获得的缓蚀剂和H2O 分子无定形盒子模型在Forcite 模块中采用COMPASS 力场进行几何结构优化,优化后的缓蚀剂与H2O 分子无定形盒子如图3 所示。设置模拟温度为323 K、时间为200 ps、步长为1 fs、系综为NVT,计算后通过Forcite|Analysis 模式得出缓蚀剂分子以及H2O 分子的能量。
采用Build|Build Layers 将Cu(111)超晶胞、缓蚀剂分子以及H2O 分子无定形盒子进行叠加,建立缓蚀剂分子吸附模型。其中Cu(111)作为Layer1,缓蚀剂作为Layer2,H2O 分子作为Layer3,并在Layer上设置1 nm 厚度的真空层作为隔绝盒子上方干扰的边界条件。将构建好的吸附模型通过Forcite 模块进几何结构优化,优化后的吸附模型如图 4 所示。吸附模型的吸附动力学计算也在Forcite 模块中的COMPASS 力场下进行,设置模拟温度为323 K,时间为200 ps,步长为1 fs,系综为NVT。计算后,通过Forcite|Analysis 模式得出吸附能量。
缓蚀剂分子在Cu 表面的吸附能可通过式(4)进行计算:
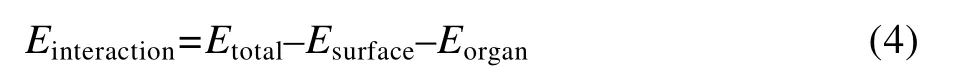
式中:Etotal为解除固定原子后的体系总势能;Esurface为铜表面的总能量,固定铜面后,其值可以忽略不计;Eorgan为删除铜原子后缓蚀剂与水分子的总能量;Einteraction为单个缓蚀剂分子在铜表面上的作用能,即吸附能(kJ/mol),其定义为缓蚀剂分子吸附在铜表面后释放出的能量,其数值越大,吸附剂分子与铜表面相互作用越强,越不容易脱附[22-26]。

图3 3 种缓蚀剂分子及H2O 分子无定形盒子Fig.3 Amorphous boxes of three corrosion inhibitor and H2O

图4 Cu(111)面上三种缓蚀剂的吸附模型Fig.4 Adsorption model of three corrosion inhibitor on Cu(111)
2 结果与讨论
2.1 缓蚀剂对蚀刻速度、缓蚀效率、蚀刻因子的影响
0.04 g/L 的缓蚀剂BTA、BZI、2-MBT 对酸性蚀刻液蚀刻速度、缓蚀效率、蚀刻因子的影响结果见表1。从表1 可看出,缓蚀剂BTA、BZI、2-MBT 的加入减缓了铜的腐蚀,降低了酸性蚀刻液对铜的蚀刻速度,3 种缓蚀剂对铜的缓蚀效率顺序为2-MBT>BZI>BTA。图5 为基础液以及分别加入缓蚀剂BTA、BZI、2-MBT 后蚀刻液的蚀刻因子切片图,由图5 中数据,依据式(3)计算得到蚀刻因子。蚀刻液的蚀刻因子随着蚀刻速度的减小而增大,其中基础液的蚀刻因子最小。加入缓蚀剂后,蚀刻液的蚀刻因子都超过了3.0,加入2-MBT 的蚀刻因子最大。缓蚀剂的加入在抑制蚀刻液对铜正面腐蚀的同时,也降低了侧蚀影响,明显改善了蚀刻因子的大小。
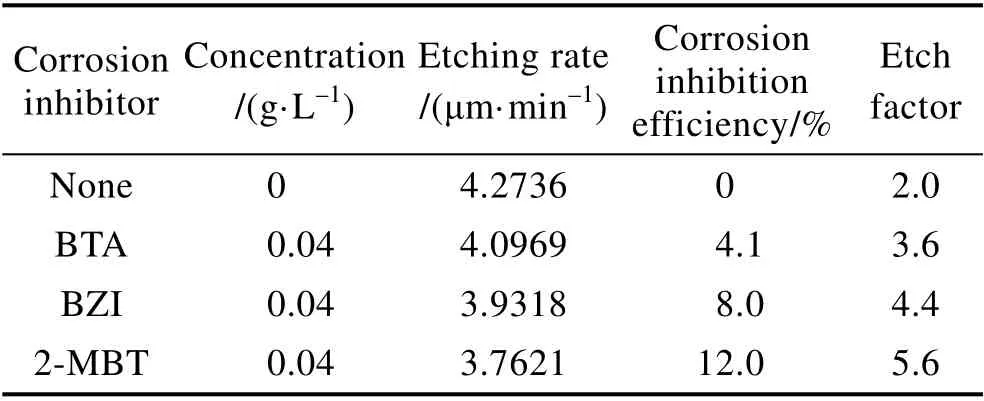
表1 不同缓蚀剂对蚀刻液性能的影响Tab.1 Effect of various corrosion inhibitors on the performance of the etching solution
不同缓蚀剂作用下,蚀刻速度随时间的变化曲线如图6 所示。由图6 可以看出,前3 min 时,铜的蚀刻速度很快,随后逐渐降低。这是由于初始阶段Cu+含量较少,主反应为Cu+CuCl2→2CuCl,腐蚀速度较快。随着反应的进行,生成的不溶性CuCl 在铜表面形成一层薄膜,减缓蚀刻速率。随后溶液中的Cu+含量继续升高,蚀刻速率下降严重,直至酸性蚀刻液难以满足生产需要。由图6 可知,缓蚀剂的加入在一定程度上会起到降低蚀刻速度的作用,且2-MBT 对蚀刻速度的影响最为明显。
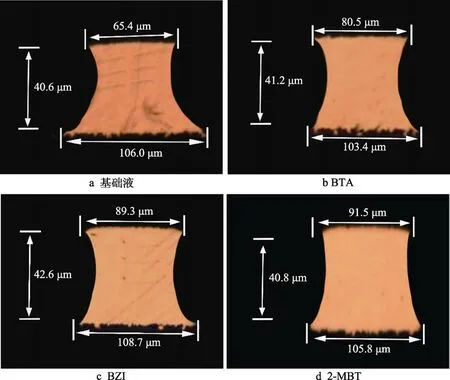
图5 不同缓蚀剂作用下的蚀刻因子切片图(200×)Fig.5 Etching factor slices underthe action of different corrosion inhibitors (200×): a) base fluid; b) BTA; c) BZI; d) 2-MBT
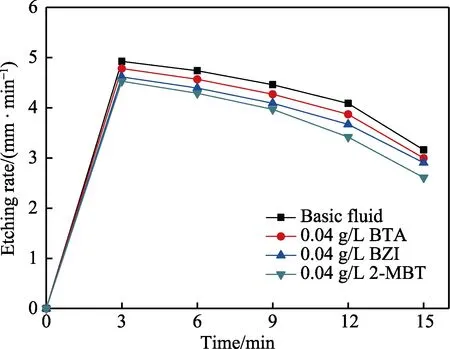
图6 不同缓蚀剂作用下蚀刻速率随时间的变化曲线Fig.6 The curve of etching rate with time under the action of different corrosion inhibitors
2.2 酸性蚀刻液缓蚀剂的Tafel 极化曲线
铜箔在含不同缓蚀剂的酸性蚀刻液中的Tafel 曲线如图7 所示。与基础液相比,加入BTA、BZI、2-MBT后,溶液的极化曲线有依次向下偏移的趋势,且铜的腐蚀电流Icorr逐渐降低(见表2)。这说明铜箔的溶解反应均得到了有效的抑制,这与静态失重法得到的结果一致。从表2 中还观察到,与未添加缓蚀剂时腐蚀体系的阳极和阴极塔菲尔常数βa、βc等参数相比,加入缓蚀剂后,测试得到βa、βc值的变化不大。另外,一般认为加入缓蚀剂后,开路电位偏移在85 mV 以上,才能认定该缓蚀剂为阴极型或阳极型[10]。加入BTA、BZI、2-MBT 后,ΔEcorr<[22-26]20 mV,可以判定它们均为混合型缓蚀剂,作用方式为几何覆盖效应。缓蚀剂分子吸附在铜层表面,起着保护层的作用,抑制了蚀刻过程的阴极和阳极反应,从而达到缓蚀效果。

图7 不同缓蚀剂对酸性蚀刻液Tafel 极化曲线的影响Fig.7 Effect of different corrosion inhibitors on the Tafel polarization curve of acid etching solution
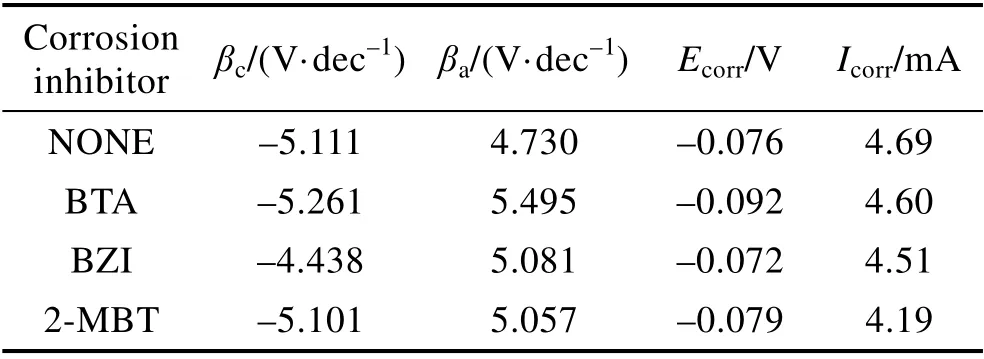
表2 铜箔在不同缓蚀剂下的Tafel 极化参数Tab.2 Tafel polarization parameters of copper foil under different corrosion inhibitors
2.3 缓蚀剂分子的全局反应活性分析
前线轨道包括最高占据轨道(HOMO)和最低非占据轨道(LUMO)2 种,前线轨道理论是基于分子轨道理论,认为分子是否能够发生化学反应与HOMO和LUMO 轨道密切相关。EHOMO表示分子的给电子能力,其值越大,说明该分子越容易提供电子吸附在铜表面;ELUMO则表示分子接受电子的能力,其值越小,表明该分子越容易接受铜面的反馈电子,从而促进吸附;HOMO 和LUMO 轨道能量之间的差值(ΔE)表征有机物在金属铜表面的结合能力,其差值越大,说明该物质越稳定,难以分解。通过对分子的最高占据轨道HOMO 和最低非占据轨道LUMO 进行研究来分析缓蚀剂分子在铜面的吸附行为。BTA、BZI、2-MBT 分子的软度(S)、硬度(η)、化学势(μ)、亲电指数(ω)和轨道能隙差值等化学参数可通过密度泛函理论计算方法得出,如式(5)—(8)所示:
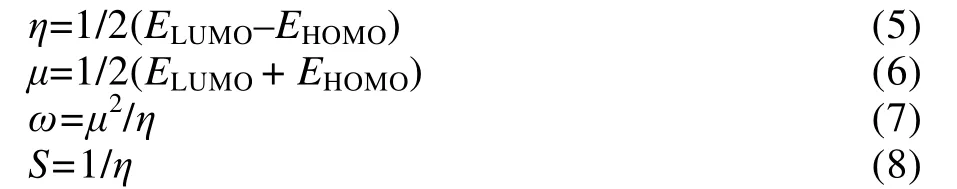
根据表3 可知,缓蚀剂分子的硬度大小关系为ηBTA>ηBZI>η2-MBT,软度及化学势的绝对值大小正好相反。说明2-MBT 得到或给电子能力最强,因此判断该分子的反应活性最强。由上述全局活性参数可得到3 种缓蚀剂分子的缓蚀效率关系为:2-MBT>BZI>BTA。
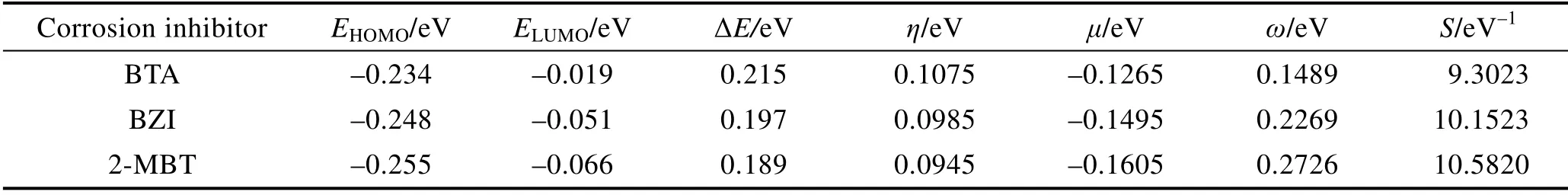
表3 3 种缓蚀剂分子的全局反应活性参数Tab.3 Global reactivity parameters of three corrosion inhibitor molecules
2.4 缓蚀剂分子的局部反应活性分析
福井函数在化学反应活性与选择性的研究中起着重要作用,能够预测有机化合物中亲核或亲电进攻的取向以及描述分子的局部反应活性。Fukui 指数(f+,f–)被定义为空间中某一点的自由能对电子数的偏微分结果。f+值越大,表示分子中各原子的得电子能力越强,该处越容易发生亲核反应;f –值越大,则表明分子中各原子的给电子能力越强,该处越容易发生亲电反应。依据式(9)、(10)对缓蚀剂BTA、BZI、2-MBT 分子中各原子的电子得失能力进行评估:

式中:q为分子中原子所带的静电量;N为电子数。基于此定量计算,可以充分地描述缓蚀剂分子局部各个化学反应位点发生亲核或亲电反应的难易程度,BTA、BZI、2-MBT 中各原子的Fukui 指数见表4—6。

表4 BTA 中原子的Fukui 指数Tab.4 Fukui index of atoms in BTA

表5 BZI 中原子的Fukui 指数Tab.5 Fukui index of atoms in BZI
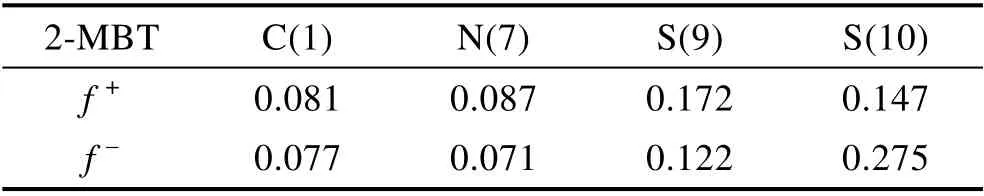
表6 2-MBT 中原子的Fukui 指数Tab.6 Fukui index of atoms in 2-MBT
缓蚀剂分子的局部反应活性表明,BTA、BZI、2-MBT 的活性吸附位点主要集中在N 或S 原子上,有多个吸附点,因此缓蚀剂分子与铜表面相互作用时,分子几乎是平行吸附在其表面。根据比较分子中原子的Fukui 指数来判定BTA、BZI、2-MBT 的反应活性,BTA、BZI 分子中N 原子的f+>f–,表明上述原子具有亲核特性,易于得到电子从而参与亲核反应。2-MBT 中S(9)的f+数值最大,说明该原子是分子的亲电中心,可接受来自铜层表面的电子形成反馈键;而S(10)的f –最大,是分子的亲核中心,易于提供电子形成配位键,S 原子不仅可以提供电子形成配位键,还可以接受电子形成反馈键。因此3 种缓蚀剂分子中,2-MBT 与铜表面有着最高的局部反应活性。
2.5 缓蚀剂分子动力学模拟分析
缓蚀剂分子在Cu(111)面的吸附模型的温度以及能量波动曲线如图8 所示。通过时间为20 ps 左右的动力学模拟,BTA、BZI、2-MBT 分子的温度和能量波动趋于稳定,在较短的时间内达到吸附平衡,表明3 种缓蚀剂分子都较容易的吸附在铜表面。
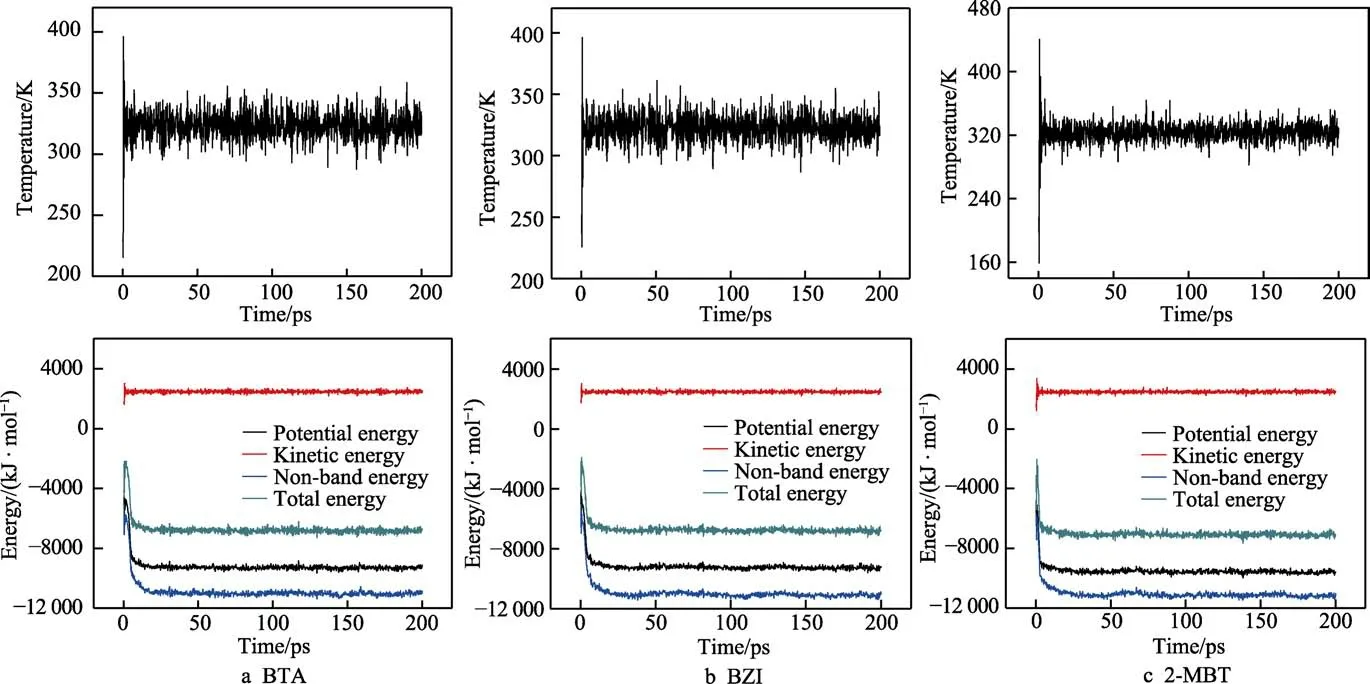
图8 3 种缓蚀剂在Cu(111)面的吸附模型的温度波动以及能量波动曲线Fig.8 Temperature fluctuation and energy fluctuation curve of three corrosion inhibitors in the adsorption model of Cu(111)
通过分子动力学计算,得出BTA、BZI、2-MBT分子在铜层表面上的吸附总能量Etotal分别为–9185.76、–9263.17、–9583.33 kJ/mol;BTA、BZI、2-MBT 和水的分子总能量Eorgan分别为–6258.72、–6229.23、–6485.75 kJ/mol。利用公式计算出BTA、BZI、2-MBT分子的吸附能分别为–2927.04、–3033.94、–3097.58 kJ/mol。由此可知,3 种缓蚀剂分子都能自发地吸附在铜层表面,且吸附作用能均较大。通过吸附能的比较可以得出,2-MBT 吸附在Cu(111)面释放的能量最大,BTA 释放的能量最小。表明2-MBT 更容易吸附在铜层表面,形成的吸附配位键更稳定,体系的总能量相对更低,更能够抑制蚀刻液对铜侧面的腐蚀作用。这就证明了缓蚀剂的加入能减小蚀刻速率,提高蚀刻因子,动力学计算结果与前文的实验结果相符合。
3 结论
1)在酸性蚀刻液中添加缓蚀剂 BTA、BZI、2-MBT,减小了蚀刻速率,有效地抑制了侧蚀的影响,提高了蚀刻精度。
2)结合量化计算的所有全局反应活性参数,得出3 种缓蚀剂分子的缓蚀效率关系为2-MBT>BZI>BTA。由局部反应活性分析表明,2-MBT 分子中的2个S 原子一个是亲电中心,另一个是亲核中心,不仅能形成配位键,还可以形成反馈键,在Cu 表面生成一层薄膜,达到最佳的缓蚀效果。
3)通过分子动力学计算,发现3 种缓蚀剂分子均能自发地吸附在Cu(111)面,对蚀刻反应起到一定的抑制作用,吸附能的大小与蚀刻因子正相关。

