凝胶型菌落总数测试片的研制
王杰伟,吴艳辉,孙万东,何艳玲
(北京陆桥技术股份有限公司,中国检验检疫科学研究院,北京 100123)
近些年,随着国家对食品质量管控的日趋严格,在食品检测行业,作为必检项目食品中菌落总数指标[1]检测量激增,菌落总数是衡量食品卫生质量的重要指标之一,为食品样品的卫生学评价提供科学依据。依据GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》标准,食品微生物菌群数量的检测方法为平板培养法[2],整体检测流程费时费力,微生物菌落计数测试片检测法是一种新型检测方法,它是以凝胶、无纺布和滤纸3种主流载体替代琼脂作为培养基载体培养微生物的一种检测新技术。测试片作为在传统琼脂平板计数法基础上经过简化和改进,形成的一种新型检测方法,是微生物快速检测方法发展的趋势,测试方法的接受度逐年上升[3]。
国内对于菌落总数测试片的研究以无纺布体系为主,随着研究的不断深入,无纺布体系菌落色素扩散、菌落显色不清晰或连成片[4],有的需要借助压板固定菌落生长区等缺点,以及与传统方法相比计数结果偏低[5]的问题逐渐显露,因此,无纺布应用于菌落总数测试片还需进一步改善,目前并尚无理想改进方案。
本研究针对无纺布载体测试片的弊端,进行冷水可溶凝胶测试片的研制。冷水可溶凝胶作为一种亲水胶体,在适当的配比下可提供较好的固化粘合作用[6],可起到替代琼脂粉的效果,因此相比无纺布体系菌落测试片,凝胶体系菌落测试片可为微生物提供与GB 4789.2-2016倾注培养法更为接近的生长环境,从而得到更为准确的检测结果。本文以GB 4789.2-2016平板计数培养基为基础,使冷水可溶凝胶替代琼脂粉,进行凝胶体系菌落总数测试片的研究。
1 材料与方法
1.1 主要试剂和材料
1.1.1 主要试剂
脑心浸液肉汤(BHI)、平板计数琼脂由北京陆桥技术股份有限公司提供;3M Petrifilm菌落总数测试片购自3M中国有限公司;2,3,5-三苯基氯化四氮唑(TTC)购自SIGMA公司;瓜尔胶、聚丙烯酸钠、黄原胶、卡拉胶、高吸水树脂(SAP)、丙酮酸钠购自阿拉丁试剂有限公司;聚对苯二甲酸乙二醇酯(PET)膜、聚乙烯膜、聚丙烯膜购自上海晶华胶粘新材料股份有限公司;纸基胶板购自上海金标生物科技有限公司。
1.1.2 菌株
大肠埃希氏菌ATCC25922、金黄色葡萄球菌ATCC6538、铜绿假单胞菌ATCC10104、阪崎克罗诺杆菌ATCC29544、单增李斯特氏菌ATCC19111购自美国菌种保藏中心;枯草芽孢杆菌CMCC63501购自中国工业微生物菌种保藏中心。
1.2 方法
1.2.1 菌悬液的制备
分别挑取上述试验菌株的单菌落接种于脑心浸液肉汤中,于36 ℃培养24 h。取1 mL菌液加入9 mL无菌生理盐水中混合均匀,即为10-1稀释液,重复上述操作将菌液稀释至适宜稀释度,得到菌落总数处于102CFU/mL的各标准菌株菌悬液;将大肠埃希氏菌、金黄色葡萄球菌、铜绿假单胞菌与枯草芽孢杆菌四种标准菌株菌悬液各取2 mL混合,得到混合菌液。
1.2.2 测试片的制备
测试片上层覆膜为PET塑料膜,底板为200 g防水型背胶相纸,将培养基各组分混合均匀后添加于测试片底板培养区域。
1.2.3 菌落总数测试片覆膜的确定
分别选用厚度为0.2 mm的聚乙烯膜、聚丙烯膜、PET膜作为覆膜,使用200 g/m2纸基胶板作为下基材。按照38.5 g/L BHI(本研究后续试验中BHI添加量均为38.5 g/L),卡拉胶15 g/L的添加量混合均匀,涂布于基材上制成菌落总数测试片,接种铜绿假单胞菌菌液,于36 ℃培养24 h观察菌落状态。
1.2.4 菌落总数测试片培养基组分的确定
1.2.4.1 冷水可溶凝胶的筛选
冷水可溶凝胶的筛选参照Ren[7]等的相关信息,选择瓜尔胶、聚丙烯酸钠、黄原胶、卡拉胶进行试验。将各冷水可溶凝胶均按照15 g/L的添加量,分别与BHI培养基进行混合,均匀添加至测试片培养区域,接种枯草芽孢杆菌菌液,于36 ℃培养24 h。综合测试片理化与微生物生长状态筛选冷水可溶凝胶。
1.2.4.2 单因素-正交实验确定培养基组分
(1)TTC添加量水平的确定[8,9]
分别将0.006、0.007、0.008、0.009与0.01 g/L TTC与BHI培养基,15 g/L复合凝胶(黄原胶:卡拉胶=1:1,下同),0.05 g/L SAP以及1.5 g/L丙酮酸钠混合后均匀添加至测试片培养区域,接种1 mL混合菌液于37 ℃培养24 h统计菌落数量。
(2)SAP添加量水平的确定
分别将0.03、0.04、0.05、0.06和0.07 g/L SAP与BHI培养基、复合凝胶、0.008 g/L TTC以及1.5 g/L丙酮酸钠混合后均匀添加至测试片培养区域,接种1 mL混合菌液,于37 ℃培养24 h后统计菌落数量。
(3)丙酮酸钠添加量水平的确定
分别将0.5、1.0、1.5、2.0与2.5 g/L丙酮酸钠与BHI培养基,复合凝胶,0.008 g/L TTC以及0.05 g/L SAP混合后均匀添加至测试片培养区域,接种1 mL混合菌液,于37 ℃培养24 h后统计菌落数量。
(4)培养基组分最优组合的确定
在上述试验结果的基础上,根据所确定的TTC添加量范围(0.007 L、0.008、0.009 g/L)、SAP添加量范围(0.04、0.05、0.06 g/L)以及丙酮酸钠添加量范围(1.0、1.5、2.0 g/L),进行三因素三水平正交试验,以确定三种关键组分在培养基中的最优组合。
1.2.5 冷水可溶性凝胶比例的确定
按照15 g/L的总凝胶添加量,黄原胶与卡拉胶复配比例分别为9:1、8:2、7:3、6:4、5:5,与优化后的培养基混合后均匀添加至测试片培养区域,接种1 mL混合菌液,于37 ℃培养24 h后观察测试片理化状态并统计菌落数量。
1.2.6 菌落总数测试片的性能评价
本文所研制的菌落总数测试片的性能,通过灵敏度、准确度两项指标,与GB 4789.2-2016平板计数法以及当前市场占有率最高的3M Petrifilm测试片进行比对验证并评估。
1.2.6.1 灵敏度
将制备好的混合菌液,以生理盐水进行梯度稀释至10-2~10-7,分别使用测试片方法、GB 4789.2-2016平板计数法以及3M Petrifilm测试片进行菌落计数,试验设置三个平行,以最低稀释度的检测结果作为最低检测限,以最低检测限作为测试片灵敏度的检测标准。检测结果大于最低检测限的为阳性,检测结果小于最低检测限的为阴性,灵敏度=阳性/(阳性+阴性)[10]。
1.2.6.2 准确度检测
将6种标准菌菌悬液,以无菌生理盐水稀释至102CFU/mL,同时选取散装熟食、散装糕点、生鸡肉、奶粉等菌落总数相对较高的市售食品样品,分别进行10-2~10-5稀释,各标准菌株以及实际样品稀释液均分别使用测试片方法、GB 4789.2-2016平板计数法以及3M Petrifilm测试片进行菌落计数,其中实际样品检测统计菌落数处于102CFU/mL稀释度的结果。建立标准菌株测试片法-国标法以及测试片法3M Petrifilm法检测结果的标准曲线。
1.2.7 数据处理
本试验数据使用SPSS 17.0软件进行处理,灵敏度检测数据采用t检验,以p<0.05为差异有统计学意义;准确度检测采用线性回归分析以检验不同方法检测结果的一致性。各组试验均重复三次,检测结果使用平均值±标准偏差表示。
2 结果与讨论
2.1 覆膜的确定
测试片的覆膜除作为结果观察与计数的窗口外,对于保证测试片培养区域的氧气供应起着决定作用。本研究中选用好氧程度较高的铜绿假单胞菌进行试验,结果表明,以聚乙烯和聚丙烯材质作为覆膜的测试片中铜绿假单胞菌生长状态差显色均过浅,无法准确计数,而以PET材质作为覆膜的测试片中菌落生长良好显色清晰,说明PET材质微观结构有一定程度上利于氧气自由扩散[11],对好氧菌的促生长效果更理想,更为适宜作为测试片的覆膜材质,各种材质覆膜制备的测试片效果见图1。

图1 不同上基材制备测试片的菌落形态Fig.1 Colony morphology of testing plates prepared by 3 different upper substrates
2.2 冷水可溶凝胶的筛选
菌落测试片中冷水可溶凝胶的性能要求包括:结构稳定,不可被液化能力较强的芽孢杆菌所分解液化;复水后阻隔性强,可阻断色素在培养体系中的过度扩散,从而使色素聚集于菌落周边,避免产生色素晕圈,便于计数;水扩散性能理想,样品稀释液加入培养区域后可自由扩散至整个培养区域且时间尽量短,方便实验操作并节省试验时间。本试验中选用凝胶液化能力强,菌落色素扩散较严重的枯草芽孢杆菌检测各种冷水可溶凝胶的稳定性,同时观察菌落晕圈情况及稀释液自由扩散至整个培养区域的时间。各冷水可溶凝胶培养后的菌落形态与性能比对情况见表1与图2。

表1 各冷水可溶性凝胶性能比对Table 1 Comparison of cold water soluble gel
本试验表明,四种冷水可溶凝胶制作的测试片中,菌落数量及大小差异不大;聚丙烯酸钠与瓜尔胶稳定性较差[12],对应的测试片均被严重液化,不适用于作为测试片中的凝胶组分;卡拉胶有轻微程度的液化以及因菌落色素扩散产生的晕圈,稀释液在测试片表面扩散速度最快;黄原胶扩散速度慢[13],但具有优越的稳定性以及色素阻隔性能。
本试验所选用的四种冷水可溶凝胶中的任何一种均无法满足菌落总数测试片对于凝胶的要求,综合考虑上述试验中各凝胶的技术指标,水扩散性能优势且结构稳定性尚可的卡拉胶,恰好与结构稳定但水扩散性能略有欠缺的黄原胶形成互补,因此本试验选用以黄原胶为主体,同时添加少量比例的卡拉胶作为复合凝胶进行后续试验研究。

图2 不同冷水可溶凝胶制备测试片的菌落形态Fig.2 Colony morphology of testing plates prepared by different gel
2.3 培养基组分单因素实验
TTC作为测试片中菌落生长指示剂,相对于其他指标剂灵敏准确,且常温下它与菌落形成的颜色在空气中稳定,可长时间保存,但浓度过高时对于微生物,尤其是革兰氏阳性细菌造成较强的抑制,需根据测试片菌落颜色清晰且计数准确的实际需求对TTC的使用浓度进行优化[14]。TTC添加量为0.006 g/L时,菌落显色略浅尚无法清晰计数,TTC添加量为0.008 g/L时菌落显色明显(见图3)且未表现出明显的抑制性,当TTC添加量达到0.01 g/L时菌落数量明显减少,因此确定TTC最佳添加量为0.008 g/L。
SAP亲水性强,将其添加于培养基组分中作为分散剂,可显著提升测试片的水扩散速度,但其含量过高时也会对微生物生长形成负作用。不同SAP添加量的测试片菌落数量见图4,SAP添加量越高测试片水扩散速度越快,添加量达到0.07 g/L时对微生物表现出一定的抑制性,SAP的最佳添加量为0.05 g/L,此时测试片水扩散速度为3~5 s。

图3 不同TTC添加量对菌落显色状态的影响Fig.3 Effect of different TTC concentration on colony chromogenic reation
微生物在正常生长过程中因需氧代谢会生成过氧化氢等有毒代谢产物[15],丙酮酸钠在酸性条件下分解产生丙酮酸,丙酮酸一方面可进行三羧酸循环产生能量,供微生物合成代谢酶分解过氧化氢,同时还可直接还原过氧化氢解除其毒害作用。因此丙酮酸钠对于促进微生物生长,修复损伤菌有着重要作用。由图4可知当丙酮酸钠添加量达到1.5 g/L后,菌落数量趋于平稳,因此确定丙酮酸钠的添加量为1.5 g/L。
2.4 培养基组分最优组合的确定
根据1.2.4.2中确定的三种关键组分添加量范围,进行三因素三水平正交试验,结果见表2,影响培养基效果关键组分主次顺序为A(丙酮酸钠)>B(TTC)>(SAP),最佳水平组合为C3A2B2,即三种组分的最优组合方式为TTC 0.008 g/L,SAP 0.05 g/L,丙酮酸钠2.0 g/L。按照最优组合再次进行验证,菌落总数为213 CFU/mL,与表2中试验5结果相符。

表2 培养基关键组分正交试验结果Table 2 Orthogonal test results of the key components

表3 不同冷水可溶凝胶复配比例测试片效果Table 3 Effect of different cold water soluble gel ratio testing plate

表4 菌落总数测试片灵敏度检测Table 4 Sensitivity detection of testing plate
2.5 冷水可溶凝胶比例的确定
不同黄原胶与卡拉胶比例下测试片水扩散速度、培养基液化情况、菌落色素扩散情况与菌落数量见表3,黄原胶与卡位胶比例为9:1与8:2时,测试片培养基无液化以及菌落色素扩散,但相比于9:1时水扩散速度6~7 s,8:2水扩散速度可达到3~4 s,此优势相当于在实际检测过程中缩短了整体检测周期,尤其在样品量大时此优势更为明显;黄原胶与卡位胶比例为7:3时,随着卡拉胶比例的增加,测试片出现了5%左右的液化,虽然此时水扩散速度也有了小幅度增加,但仅为改善0.2~0.3 s水扩散性能而牺牲掉5%液化并非理想的选择;黄原胶与卡位胶比例为6:4以及5:5时测试片液化比例已经较高,因此将黄原胶:卡拉胶为8:2作为冷水可溶凝胶复配比例。
2.6 性能评价
2.6.1 灵敏度检测
灵敏度试验结果见表4,本文所研制的菌落总数测试片、国标方法以及3M Petrifilm测试片的检测限均为2 CFU/mL。本文所研制的菌落总数测试片与国标方法对菌落数量为30~300之间的可计数样本进行计数与分析,t=2,p=0.18>0.05,说明菌落总数测试片与国标方法检测结果无差异显著性。
2.6.2 准确度检测
使用菌落总数测试片与GB 4789.2-2016倾注法对各标准菌株进行菌落总数检测,两种检测方法的线性相关曲线见图5,由本试验结果可知,菌落总数测试片与国标方法检测结果具有良好的线性关系,R2达到0.994,表明两种检测方法对于包括标准菌株与实际样品在内所有样本的计数结果无差异显著性。

图5 测试片法与国标法检测结果相关曲线Fig.5 Linear correlation curve of test results between
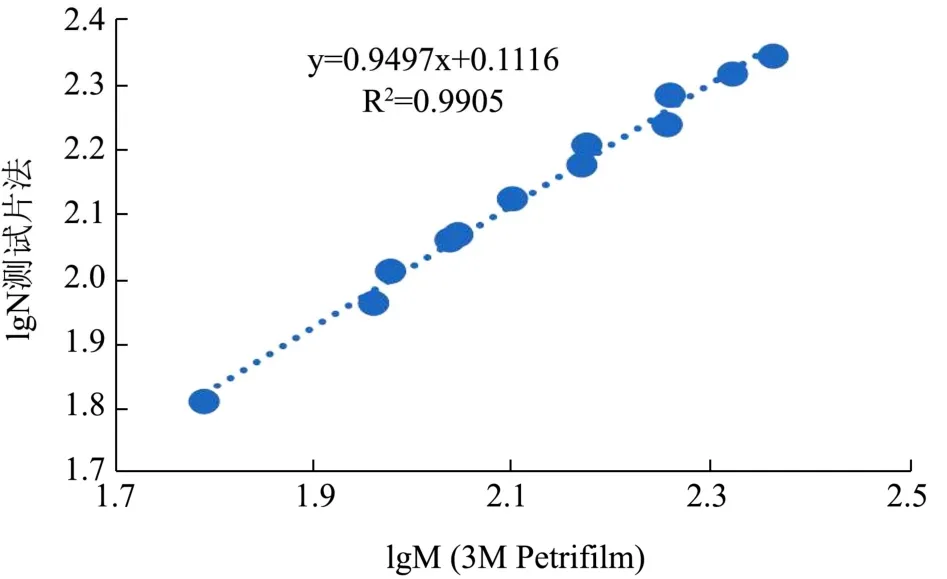
图6 测试片法与3M检测结果相关曲线Fig.6 Linear correlation curve of test results between testing plate and national standard method testing plate method and 3M Petrifilm method
测试片法-3M Petrifilm法的线性相关曲线见图6,对于标准菌株以及实际样品,菌落总数测试片与当前市场占有率最高的测试片产品-3M Petrifilm检测结果的线性关系达到0.99,说明本文所研制的菌落总数测试片可应用于食品微生物检测。
3 结论
本文以四种食品检测中常见的条件致病菌为试验菌株,通过筛选基材,优化培养基干粉的组分,研制菌落总数测试片;在优化培养基干粉组分这一核心环节上,首先通过理化性状及菌落生长状态筛选出黄原胶与卡拉胶作为测试片冷水可溶性凝胶;再通过单因素-正交实验确定培养基中关键组分TTC、SAP与丙酮酸钠的添加量分别为0.008 g/L、0.05 g/L与2.0 g/L;最后确定复合凝胶内黄原胶与卡拉胶的比例为8:2(m/m)。菌落总数测试片与国标中平板计数法以及3M Petrifilm测试片进行比对,标准菌株与实际样品检测线性相关性均良好,R2均达到0.99以上,测试片检出限可达2 CFU/mL,灵敏度达到100%,说明本文研制的菌落总数测试片可应用于食品微生物检测领域,同时对于不同基质的样品均有较理想的适用性。在食品检测行业精准高效的发展趋势下,相比于国标方法,测试片方法具有明显的优势,在检测流程上省去了培养基制备、高压、冷却、倒平板等工序,极大简化了检验流程;在微生物定量结果准确性保证上,测试片法避免了国标倾注法在倾倒培养基时对细菌的热损伤,同时适量TTC的加入使得培养后菌落更易识别,不存在国标平板计数法在读取结果时生长于培养基内部的细菌形态过小不易识别的问题;另外测试片体积极小,便于培养、保存与运输。在检测成本方面,虽然测试片在直接材料成本上高于国标方法,但如考虑到测试片法无繁琐的平板制备工序,节省人工缩短、总体检测周期短从而隐形成本更低,测试片法在总成本上与国标法差距并不明显,而且在检测量越大时优势越明显。因此本文所研制的测试片方法在检测行业具有广阔的应用前景。

