低共熔溶剂提取桂花黄酮的工艺优化
都宏霞,缪领珍,2,胡梓恒,严忠杰
(1.南京科技职业学院化学与材料工程学院,江苏南京 210048)(2.东南大学成贤学院,江苏南京 210088)
桂花(Osmantus fragrans),又名木犀、岩桂、金粟、九里香等,系木犀科常绿灌木或小乔木,属珍贵的芳香型鉴赏植物。味辛,可入药;芳香,可用于食品、化妆品;清雅高洁,香飘四溢,《本草纲目》中早有记载,在我国广泛种植,深受人们喜爱。桂花中含有黄酮、多糖、多酚、精油等多种生物活性成分及抗氧化、降血脂、抗衰老、护肝、抑菌等多种活性功效[1-11]。研究表明,作为主要活性成分的桂花黄酮(Flavonoids ofOsmanthus fragrans,FOFs)具有抗氧化、抗炎、提高机体免疫力多种活性功能。目前,针对FOFs的提取方法主要是回流、酶提、微波、超声波,但溶剂都采用传统的有机溶剂,对环境十分不友好[3-5]。因此,探索一种绿色、高效的新提取技术十分必要。
低共熔溶剂(Deep Eutectic Solvents,DESs)由Abbott等人于2003年首次合成的一类绿色新型溶剂[12],一般通过两类化合物,即氢键受体(hydrogen-bond acceptor,HBA)和氢键供体(hydrogen-bond donor,HBD),通过氢键作用而合成,所制成的低共熔溶剂熔点低于其任一组分的熔点,且具有高热稳定性。与传统溶剂相比,具有绿色、低成本、低毒、低挥发、高密度、高极性、高表面张力等优良特点,同时,易于制备、易于存储、生物可降解、可回收,是传统溶剂和离子液体的良好替代品,已受到极大关注,并在天然产物活性成分提取方面证实了明显的优势和巨大潜力[13,14]。
本文设计并制备6种低共熔溶剂,首次用于FOFs的提取,并在比较了醇提、冻融、超声波和微波提取四种技术,在单因素研究的基础上,结合响应面法探索FOFs的最佳提取工艺,旨在为进一步开发桂花资源和拓展低共熔溶剂在天然产物绿色提取方面提供数据支撑。
1 材料与方法
1.1 材料与试剂
桂花,北京同仁堂药店;芦丁标准样品,北京恒元启天化工技术研究所;氯化胆碱,Aladdin公司;三氯化铝、乙醇、醋酸钾、三乙醇胺、1,3-丁二醇、1,2-丙二醇、蔗糖、山梨醇均为分析纯。
1.2 仪器与设备
ME204E-02型电子天平,梅特勒-托利多仪器(上海)有限公司;FS-250N型超声波提取仪,上海生析超声仪器有限公司;TDL-50B型低速台式离心机,上海安亭科学仪器厂;7600型紫外分光光度计,上海菁华科学仪器制造有限公司。
1.3 方法
1.3.1 标准曲线绘制[15,16]
准确称取芦丁标准品5.0 mg,用浓度为50%的乙醇定容至25.0 mL。准确称取芦丁标准品(0.2 mg/mL)0.5、1.0、2.0、3.0、4.0、5.0 mL于6只比色管中,分别用5.0 mL的50%乙醇,3.0 mL的0.1 M AlCl3溶液和5.0 mL的1 M醋酸钾溶液,摇匀,同法制成空白对照:静置反应40 min,充分接触混合,通过紫外分光光度计在波长415 nm处检测其吸光度值,建立芦丁标准曲线,测定FOFs的含量。
1.3.2 提取技术比较研究
准确称取桂花花粉10 g,通过冻融(Freeze Thawing,FT)、醇提(Ethanol Extraction,ET)[17,18]、超声波提取(Ultrasonic Extraction,UA)[19-21]、微波提取[22-24](Microwave Extraction,MA)四种技术来提取FOFs,提取条件详见表1,将提取液以转速4000 r/min的速度离心10 min,取上层清液,过0.45 µm滤膜,使用预处理后的D101大孔树脂上样,吸附平衡后,用纯水、质量浓度为30%、50%、70%、90%的乙醇溶液依次洗脱,每个浓度均洗脱3柱体积(BV),流速为1 BV/h,收集90%乙醇浓度的洗脱液,于45 ℃旋转蒸发进行浓缩后,再用50%的乙醇溶液进行稀释[25]得到FOFs,根据1.3.1所述方法测其吸光度,计算得出FOFs含量。

表1 提取条件表Table 1 Factors of different technology

表2 不同类型的低共熔溶剂Table 2 Different types of DESs
1.3.3 DESs的合成
参考Abbott的方法[26],设计了6组DESs(见表2),选择氯化胆碱作为氢键受体,分别与不同的氢键供体按一定摩尔比,在85 ℃水浴条件下加热搅拌,直至溶液澄清,冷却至室温,分别得到DES1-6,备用。
1.3.4 FOFs的提取
精确称取桂花花粉10 g,通过超声波辅助DES1-6,在超声波150 W、液料比20:1、时间10 min的条件下分别提取FOFs。
1.3.5 FOFs提取量的测定

式中:Y为FOFs提取量,mg/g;c为试样的测定质量浓度,mg/mL;V为滤液体积,mL;D为稀释倍数;m为原料质量,g。
1.3.6 超声波辅助DES-4提取FOFs的单因素实验
1.3.6.1 液料比对FOFs提取量的影响
在含水量60 mol,超声时间10 min,超声功率150 W,氯化胆碱:山梨醇:1,2-丙二醇=1:1:1的条件下,分别取液料比20:1、30:1、40:1、50:1、60:1,研究液料比对FOFs提取量的影响。
1.3.6.2 摩尔比对FOFs提取量的影响
在液料比50:1,含水量60 mol,超声时间10 min,超声功率150 W的条件下,取氯化胆碱:山梨醇:1,2-丙二醇的摩尔比为1:1:1、1:1:2、1:1:3、1:1:4、2:1:4、3:1:4作为变量,研究摩尔比对FOFs提取量的影响。
1.3.6.3 含水量对FOFs提取量的影响
在液料比50:1,超声时间10 min,超声功率150 W,氯化胆碱:山梨醇:1,2-丙二醇的摩尔比为2:1:4的条件下,分别取含水量40、50、60、70、80 mol作为变量,研究含水量对FOFs提取量的影响。
1.3.6.4 超声功率对FOFs提取量的影响
在液料比50:1,超声时间10 min,含水量60 mol,氯化胆碱:山梨醇:1,2-丙二醇的摩尔比为2:1:4的条件下,分别取超声功率30、60、90、120、150 W作为变量,比较超声功率对FOFs提取量的影响。
1.3.6.5 超声时间对FOFs提取量的影响
在液料比50:1,含水量60 mol,氯化胆碱:山梨醇:1,2-丙二醇的摩尔比为2:1:4,超声功率150 W的条件下,分别取超声时间5、10、15、20、25 min作为变量,比较超声时间对FOFs提取量的影响。
1.3.7 响应面法优化FOFs最优提取工艺条件
使用Design-Expert.V 8.0.6软件中Box-Behnken组合设计来探索FOFs最优工艺[27-30],在单因素实验基础上,选择含水量、液料比和时间作为3因素,每个因素选择三个对FOFs提取量影响较大的水平,进行3因素3水平的响应面试验,并以提取量作为响应值,各因素的三个水平分别采取-1、0、1作为编码,如表3。

表3 响应面试验分析因素水平表Table 3 Factors and levels of response surface methodology
1.4 数据处理
使用Origin 8和Design-Expert.V 8.0.6进行数据处理、图表制作及数据分析。
2 结果与分析
2.1 芦丁标准曲线的结果分析
经标准曲线测定及分析,得回归方程Y=32.87X+0.14,其系数R2=0.9998,在测定范围内线性关系良好。

图1 芦丁标准曲线Fig.1 Standard curve of Rutin
2.2 FOFs提取技术比较分析
通过冻融(FT)、醇提(ET)、超声波(UA)、微波(MA)四种技术提取FOFs,如图2所示,数据表明:超声波提取>微波提取>乙醇提取>冻融提取,最佳技术为超声波提取,提取量为1.65 mg/g。因此,采用超声波辅助进行FOFs提取和进一步优化分析。

图2 FOFs提取技术的比较Fig.2 Comparison of different technology for extraction of FOFs
2.3 DESs的筛选
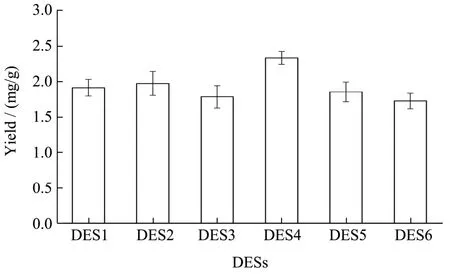
图3 DESs的筛选Fig.3 Comparison of different DESs
设计并制备了6种DESs提取FOFs,数据表明:低共熔溶剂的提取FOFs的效果整体优于冻融、醇提、超声波和微波提取技术,其中DES-4,即以氯化胆碱和山梨醇和1,2-丙二醇所构成的三元体系提取效果最好,FOFs提取量为2.33 mg/g,结果见图3。为了得到FOFs提取的最佳工艺条件,本研究以超声波辅助-DES-4(UA-DES-4)进行进一步研究。
2.4 单因素实验
2.4.1 液料比对FOFs提取量的影响

图4 液料比对FOFs提取量的影响Fig.4 Effect of liquid-material ratio on extraction yield of FOFs
如图4所示:当液料比在20:1到50:1区间,FOFs提取量呈上升趋势,之后趋于平稳。其中在50:1时,提取量最高,为4.72 mg/g。主要原因是增加提取溶剂的体积可以增加溶剂与溶质之间的接触面积,使溶解度升高,促进黄酮成分的溢出,当溶解度大到一定程度时,会发生饱和的现象,导致部分黄酮无法溶解,提取量降低。
2.4.2 摩尔比对FOFs提取量的影响

图5 摩尔比对FOFs提取量的影响Fig.5 Effect of molar ration on extraction yield of FOFs
结果如图5所示:FOFs提取量随着DES-4体系中氯化胆碱和1,2-丙二醇摩尔比的增加而增加,当摩尔比为2:1:4时,提取量最高,为6.19 mg/g。主要原因是1,2-丙二醇摩尔比的增加有效的调节了DES-4体系的粘度及表面张力,促进了黄酮物质的扩散,提高了提取量,而氯化胆碱的比例低会弱化黄酮物质与溶剂的相互作用。当摩尔比为2:1:4时,刚好达到最佳效果[31]。
2.4.3 含水量对FOFs提取量的影响
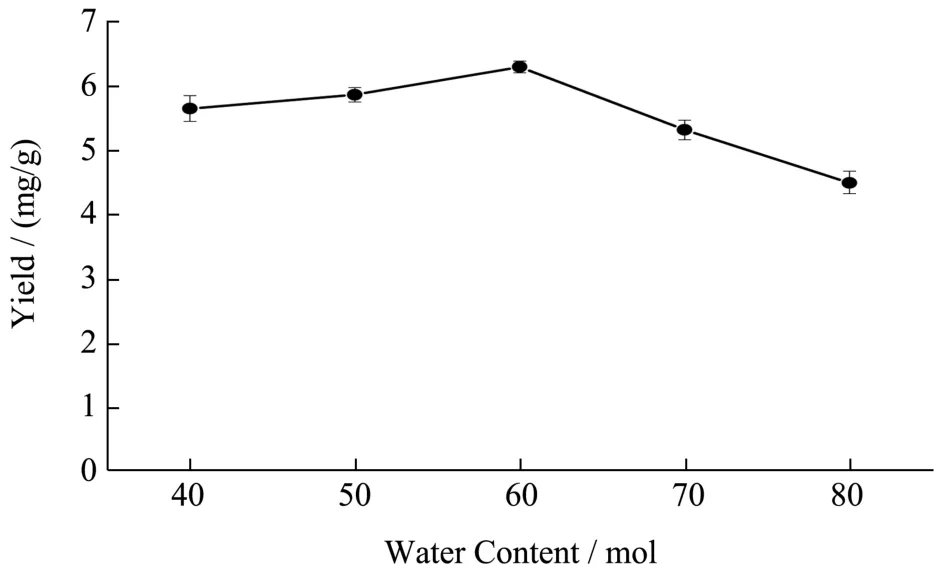
图6 含水量对FOFs提取量的影响Fig.6 Effect of water content on extraction yield of FOFs
DESs的含水量是影响提取效果的重要因素,本研究考察了含水量40~80 mol对FOFs提取量的影响,结果如图6所示:含水量从40到60 mol时,FOFs的提取量逐渐上升,含水量为60 mol时,提取量最高,为6.29 mg/g,含水量从60~80 mol时,提取量降低。主要原因随着水含量的增加,可以明显降低DES的粘度,同时调节体系极性,有益于黄酮成分的溢出,增加提取量,但当含水量超过60 mol后,随着极性的增加,会引起分子间氢键的断裂,影响提取效果[32]。
2.4.4 超声功率对FOFs提取量的影响

图7 超声功率对FOFs提取量的影响Fig.7 Effect of ultrasonic power on extraction yield of FOFs
结果如图7所示:FOFs的提取量随着超声波功率的提高而逐渐上升,当功率为150 W时,提取量最高,为6.29 mg/g[20]。因为超声波会促进黄酮物质在溶剂中的分散与渗透,增大接触面积,促使黄酮物质的释放。因此最佳超声功率为150 W。
2.4.5 超声时间对FOFs提取量的影响
结果如图8所示:在5~15 min时FOFs提取量呈上升趋势,之后有所下降,最佳超声时间是15 min,此时提取量为6.30 mg/g。这是因为时间越长,超声波产生的能量就越大,在溶液中所形成的空化效应就越强,对桂花细胞壁的破坏程度就越强,提取量就越高。但是,随着超声波作用时间的延长,温度也会增加,体系同时处于超声辐射和热效应的作用之下,可能会产生双重降解[33],并且长时间的提取黄酮物质内部化学结构会发生改变,DES与样品的相互作用变得不稳定,影响提取效果[34]。

图8 超声时间对FOFs提取量的影响Fig.8 Effect of extraction time on extraction yield of FOFs
2.5 响应面试验结果与优化分析
2.5.1 响应模型的建立与分析
基于单因素试验结果,选取含水量(A)、液料比(B)和超声时间(C)三个主要因素为自变量,以FOFs提取量为响应值(Y),采用Design-expert软件按照Box-Behnken实验设计了15组实验,12组为析因点实验,3组为重复零点实验,进行交叉设计实验,结果见表4,方差与误差统计分析见表5。
利用Design-Expert软件对实验数据进行分析,得到二次多项回归方程:
R=8.67+0.059A+1.74B+0.16C+0.80AB+0.020AC+0.22BC-1.97A2-0.98B2-1.38C2
其中R为提取量,A、B和C分别为对应含水量、液料比和超声时间的编码。
由表5的数据可知:模型的p值为0.0037,模型极显著(p<0.01);失拟项p值为0.0712,结果不显著(p>0.05),表明拟合状况良好。方程决定系数R2=0.9659,CV为9.27%<10%,能真实的反映本模型,可用此模型分析响应面的变化。信噪比(Adeq Precision)为11.286大于4,表示模型合理。
由方差F值可知,各因素对提取量影响为:B(料液比)>C(超声时间)>A(含水量)。由表5还得知,因素中B、A2、C2的影响极显著(p<0.01),因素AB、B2的影响显著(p<0.05),而A、C、AC、BC的影响不显著,表明该方程可适用。

表4 响应面分析实验设计与结果Table 4 Design and results of the response surface methodology (RSM) and Box-Behnken

表5 提取量响应面拟合回归方程的方差分析结果Table 5 ANOVA results of extraction rate response surface fitting regression equation
2.5.2 响应面交互作用分析与优化
各因素间交互作用得到响应面曲线图。图9~图11分别显示含水量、料液比、超声时间的交互作用对FOFs提取量的影响结果。曲线走势越陡,表明该因素影响越显著;曲线走势越平滑,则表明该因素影响较小[32-34]。图9中,随着含水量的增加,FOFs提取量呈现出先升后降的趋势,影响显著,含水量在62 mol时达到最高点。图10中,提取量随着液料比的增加,影响十分显著,在液料比为60:1(mL/g)左右时出现最大值,之后逐渐降低;图11中,随着超声时间的增加,FOFs提取量逐渐上升,在16 min左右时达到最大,之后缓慢降低。
2.5.3 验证试验
根据Design-Expert软件得出在含水量、超声时间和料液比交互作用影响下,最优提取工艺为:液料比为59.90:1,含水量为62.17 mol,超声时间为15.69 min,在此条件下模型预测的提取率为9.55 mg/g。
结合实验室具体情况,修正实际提取条件为液料比60:1 (mL/g),超声波功率150 W,含水量62 mol,摩尔比2:1:4,超声时间16 min,所得FOFs提取量为10.06 mg/g,与预测值相差0.51 mg/g,说明模型与实际数据拟合较好,证实根据此模型优化的工艺条件可靠。

图9 含水量与超声时间交互作用对提取量的影响Fig.9 Response Surface of Y=f(A,C)

图10 含水量与液料比交互作用对提取量的影响Fig.10 Response Surface of Y=f(A,B)
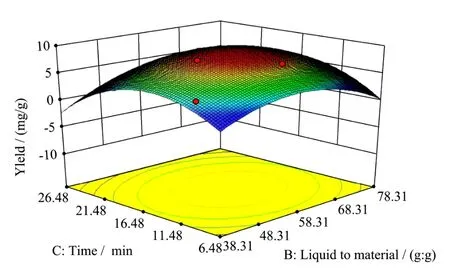
图11 超声时间与液料比交互作用对提取量的影响Fig.11 Response Surface of Y=f(B,C)
3 结论
本文结合超声波辅助低共熔溶剂提取,建立了一种高效、环保的FOFs提取工艺。通过设计并制备6种低共熔溶剂用于提取FOFs,并使用传统的醇提、冻融、超声波及微波技术进行提取,证实低共熔溶剂的提取效果整体优于其他技术。其中,三元DES体系氯化胆碱/山梨醇/1,2-丙二醇的效果最好。因此,选用此体系,在单因素的基础上,结合响应面优化实验和实验室实际条件,得到FOFs提取最佳工艺是:氯化胆碱:山梨醇:1,2-丙二醇=2:1:4,含水量62 mol,液料比60:1 (mL/g),超声波功率150 W,超声时间16 min,在此条件下,FOFs的提取量达到10.06 mg/g;FOFs提取量比传统的醇提提高了8.93 mg/g,相当于其890%,同时,提取效果也优于文献报道[4]中采用微波-超声联合辅助提取最优工艺得到的7.86 mg/g,说明超声波辅助低共熔溶剂提取FOFs的高效性。本工艺绿色、高效、环保,为天然植物活性成分绿色提取和桂花的深度开发提供了数据支撑。

