一株高产乙偶姻芽孢杆菌菌株筛选及发酵条件优化
张玲玲,罗惠波,黄丹,张倩,郑升海,童文华
(四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)
曲为酒之骨,酒曲质量的好坏直接影响着白酒的质量、产量和风格。中高温大曲是酿造浓香型白酒的糖化发酵剂,含有酵母、霉菌、细菌等多种微生物,这些微生物在浓香型白酒的酿造过程中共酵生成复杂的白酒成分,赋予了浓香型白酒独特的风格特征[1,2]。中高温大曲在制曲培菌过程中最高品温可达62 ℃,由于芽孢杆菌存在利用芽孢应对胁迫环境的特性,因此在大曲制备的高温条件下芽孢杆菌成为其中的优势细菌之一。芽孢杆菌不但能够代谢产生ACT、2,3-丁二醇以及吡嗪等风味物质作为浓香型白酒的主要呈香物质,还可以代谢产生淀粉酶、蛋白酶等多种酶类,推动大曲及白酒酿造过程中的各种生化反应进行[3,4]。ACT学名3-羟基-2-丁酮(3-Hydroxy-2-butanone),是一种具有特殊奶油香味的挥发性化合物,有类似蜂蜜的甜味,是酒类调香中一个极其重要的物质,也是白酒风味物质中的重要香味成分,在名优酒中含量尤为突出[5]。ACT同时也是一种重要的高附加值化学品,广泛用于食品,烟草,化妆品,洗涤剂,化学合成,植物生长促进剂和生物害虫防治中[3,6,7]。
近些年ACT合成方式的研究越来越受关注,ACT生产方法主要有化学合成法[8]、酶转化法[9]和微生物合成法[10-12]。由于化石资源日益枯竭、温室效应、污染排放等因素的制约,化学合成法逐步被微生物合成法取代。微生物合成法是根据微生物的生理特性和其自身的代谢特点,以廉价碳源为底物,在一定条件下通过发酵获得ACT的一种良好方法,具有安全、经济、绿色、高效、可持续的特点,越来越受到各国研究者的关注。在微生物发酵法中,筛选更高效、稳定的ACT生产菌株,优化其发酵工艺,对提高ACT产量有至关重要的作用[13,14]。
自然界中能够自然合成ACT的微生物有很多。TIAN等[15]从日本传统食品纳豆中分离出枯草芽孢杆菌(Bacillus subtilisSF4-3),使用优化的培养基后ACT产量达到46.2 g/L;TEIXEIRA等[16]对有孢汉逊酵母(Hanseniaspora guilliermondii)的摇瓶发酵条件(葡萄糖浓度、温度、pH)进行优化,使得最终ACT产量达到365 mg/L;ZHENG等[17]将哈尔滨乳杆菌(Lactobacillus harbinensisM1)应用于豆浆发酵,使其风味明显改善,经GC/MS分析2,3-丁二醇与ACT丰度显著增加;SUN等[12]采用辅因子工程提高了粘质沙雷氏菌(Serratia marcescensH32)的ACT产量,结合补料分批发酵使ACT产量达到75.2 g/L;LIU等[18]将NADH/NAD+再生系统引入多粘类芽孢杆菌(Paenibacillus polymyxaCJX518),从而调节ACT和2,3-丁二醇之间的分布,使ACT最大产量为57.20 g/L。近年来对ACT的研究更多集中于天然高产ACT菌株的选育、代谢通路改造与工程菌的构建。本研究以浓香型大曲为菌株来源,以四川某酒厂大曲为样品,经肌酸比色法获得高产ACT的菌株,为天然高产ACT的微生物添加新菌株,并利用单因素法和响应面法对其产ACT的发酵条件进行了优化,确定了菌株发酵生产ACT的最佳发酵条件。
1 材料与方法
1.1 材料、试剂与培养基
大曲样品取自四川某酒厂。
葡萄糖、酵母粉、琼脂、蛋白胨、七水硫酸镁,上海生工生物工程股份有限公司;氢氧化钠、氯化钠、二水氯化钙、磷酸二氢钾、硫酸铵,成都市科隆化学品有限公司;肌酸,上海麦克林生化科技有限公司;1-萘酚,天津市光复精细化学试剂研究所。
液体富集培养基:葡萄糖3%、蛋白胨1%、酵母粉0.50%、氯化钠0.05%、酒醅浸提液,pH 6.0,121 ℃下灭菌20 min。
分离、纯化培养基:葡萄糖3%、蛋白胨1%、酵母粉0.50%、氯化钠0.05%、琼脂1.50%,pH 6.0,121 ℃下灭菌20 min。
种子培养基:葡萄糖3%、蛋白胨1%、酵母粉0.50%、氯化钠0.05%,pH 6.0,121 ℃下灭菌20 min。
发酵培养基:葡萄糖8%、蛋白胨1%、酵母粉1%、氯化钠0.05%、七水硫酸镁0.03%、二水氯化钙0.10%、磷酸二氢钾0.03%、硫酸铵0.03%,pH 6.0,在121 ℃下灭菌20 min。
1.2 仪器与设备
LS-l201生化培养箱,美国Fisher Scientific公司;ST2100 pH计,奥豪斯仪器(常州)有限公司;UV-1200紫外可见分光光度计,上海美谱达有限公司;HHS电热恒温水浴锅,上海齐欣科学仪器有限公司;ZWYR-D240恒温培养振荡器,上海智城分析仪器制造有限公司;LYNX 6000高速冷冻离心机,美国Thermo公司;XSP-C生物显微镜,北京瑞宏诚科技发展有限公司。
1.3 方法
1.3.1 高产ACT芽孢杆菌的筛选
1.3.1.1 芽孢杆菌菌株的分离筛选
样品处理:称取大曲1 g,放入盛有99 mL无菌水且含有无菌玻璃珠的三角烧瓶中,振荡使大曲分散均匀,制备样品悬浮液。悬浮液在85 ℃水浴加热10 min,淘汰非芽孢细菌,再吸取1 mL悬浮液于富集培养基中,过夜富集培养。
分离纯化:在超净工作台中将富集液梯度稀释成10-3~10-8的菌液,吸取0.2 mL菌液滴于分离培养基平板中央,用涂布棒将菌悬液在培养基上涂抹均匀,在37 ℃培养箱中倒置培养36 h。根据芽孢杆菌菌落形态特征,选取菌落形态不一致的菌落,用无菌接种环分别于分离培养基平板上划线,37 ℃培养箱中培养,直至长出单个菌落,再挑选单菌落进行不断纯化培养。
1.3.1.2 高产ACT菌株的筛选
初筛:采用肌酸显色法来筛选能合成ACT的菌株。方法为将1 g 1-萘酚,0.1 g肌酸与4 g NaOH配成100 mL肌酸混合液,将从大曲中筛选得到的芽孢杆菌菌株,轻刮一环菌于盛有1 mL混合液的试管中,能产ACT的菌株能使混合液快速变为红色。
复筛:将初筛获得的菌株接种于50 mL种子培养基中,在37 ℃、180 r/min条件下摇床培养12 h,再以5%的接种量接种至50 mL发酵培养基。在37 ℃、180 r/min条件下摇床培养72 h。发酵结束后12000 r/min离心2 min,取上清液,以比色法测定发酵液的OD522nm值,从而获得ACT产量较高的菌株。将50%甘油与菌液按1:1混合均匀,-70 ℃保藏。
1.3.2 菌株生长曲线的绘制
挑取一环新鲜的斜面菌种,接入50 mL种子培养基中过夜培养12 h,以5%接种量接入50 mL发酵培养基中,37 ℃、180 r/min培养22 h,在0、2、4、6、8、10、12、14、16、18、20、22 h时取出对应三角瓶,测定OD600nm值,每组试验3个平行。
1.3.3 目的菌株的鉴定
1.3.3.1 形态学观察及理化鉴定
细菌的生理生化鉴定实验参照《伯杰氏细菌鉴定手册》,对该菌株进行革兰氏染色、芽孢有无运动性、酪蛋白水解、淀粉水解、明胶水解、硝酸盐还原、甲基红试验等生理生化鉴定,细菌大小利用电子显微镜观察。
1.3.3.2 菌株的耐受性研究
菌株对酸度的耐受性:将种子液以5%接种量转接到pH分别为3.5、4.0、5.0、6.0、7.0、8.0、9.0、9.5的发酵培养基中,37 ℃、180 r/min振荡培养24 h后,测定OD600nm,每组试验3个平行。
菌株对乙醇的耐受性:将种子液以5%接种量转接到乙醇含量分别为1%、2%、3%、4%、5%、6%发酵培养基中,37 ℃、180 r/min振荡培养24 h后,测定OD600nm,每组试验3个平行。
1.3.3.3 16S rRNA序列分析测定
细菌染色体提取方法用改良CTAB法[19]。以提取的基因组DNA为模板,采用细菌通用引物27F:AGTTTGATCCTGGCTCAG,1492R:GGTTACCTTG TTACGACTTPCR,扩增16S rRNA基因。反应体系:10×Taq buffer 5 μL,dNTP(Mix)2 μL,DNA模板1 μL,Taq DNA聚合酶0.5 μL,上下游引物各2 μL,双蒸水补至总体积50 μL。反应条件:95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后72 ℃修复延伸5 min。扩增产物经1%琼脂糖凝胶电泳检测。将PCR产物送上海生工生物工程有限公司测序后,将测序结果通过美国国家生物技术信息中心(NCBI)数据库的BLAST比对获得鉴定结果,并利用MEGA5构建系统发育树。
1.3.4 高产ACT菌株发酵条件优化
1.3.4.1 单因素试验
pH、装液量、接种量、转速和温度等因素[13,16]影响着菌体的生长和代谢,因此选取pH(5.0、5.5、6.0、6.5、7.0)、温度(31、34、37、40、43 ℃)、接种量(3%、5%、7%、9%、11%)、转速(120、150、180、210、240 r/min)、装液量(30、40、50、60、70 mL/250 mL)等5个因素做单因素试验,每组试验3个平行。
1.3.4.2 正交试验
设计L18(73)正交试验,考察不同因素对ACT产量影响的大小。对pH、温度、转速、装液量和接种量5个因素进行考察,每个考察因3个水平进行试验,每组试验3个平行。
1.3.4.3 响应面试验设计
用软件Design Expert 8.0.6进行Box-Behnken Design (BBD)设计响应面试验,以pH,温度,装液量作为变量,以ACT产量为响应值,进行3因素3水平的响应面分析试验,每组试验3个平行。
1.3.5 检测方法
1.3.5.1 ACT的标准曲线制作
分别配制浓度为0.05、0.1、0.2、0.4、0.8 g/L ACT标准溶液。分别吸取0.1 mL不同浓度的标准溶液于试管中,加入4.5 mL肌酸混合液,振荡混匀,在30 ℃水浴锅中反应30 min,测定OD522nm值。每个浓度3个平行实验,并准备一个作为空白对照。
1.3.5.2 发酵液中ACT含量的测定
吸取1 mL发酵液于离心管中,4 ℃、12000 r/min离心2 min,上清液适当稀释后,取0.1 mL于试管中再加入4.5 mL肌酸混合液,振荡混匀,30 ℃下反应30 min,测定OD522nm值,每组试验3个平行。最后根据ACT标准曲线的公式计算出ACT产量。
1.3.6 数据分析方法
采用SPSS 19.0进行单因素方差分析,采用Origin进行图表的绘制。
2 结果与讨论
2.1 菌株筛选结果
2.1.1 样品初筛
将分离纯化得到的30株芽孢杆菌分别轻刮一环菌于含有1 mL肌酸混合液的试管中,能产ACT的菌株使混合液2 min内迅速变为红色,实验结果显示有20株芽孢杆菌可使肌酸混合液变红,其中有5株芽孢杆菌(A2、A9、A18、A19、A21)代谢物与肌酸混合液快速反应且呈现深红色(图1)。但此法不能准确判断菌株产ACT的能力强弱,需进一步试验。

图1 菌株初筛结果Fig.1 Strain screening results
2.1.2 ACT标准曲线
以ACT浓度为横坐标,吸光值为纵坐标,绘制ACT标准曲线。回归方程为 y=5.3989x-0.0444,相关系数 R2=0.9991,表明两者之间线性关系良好。
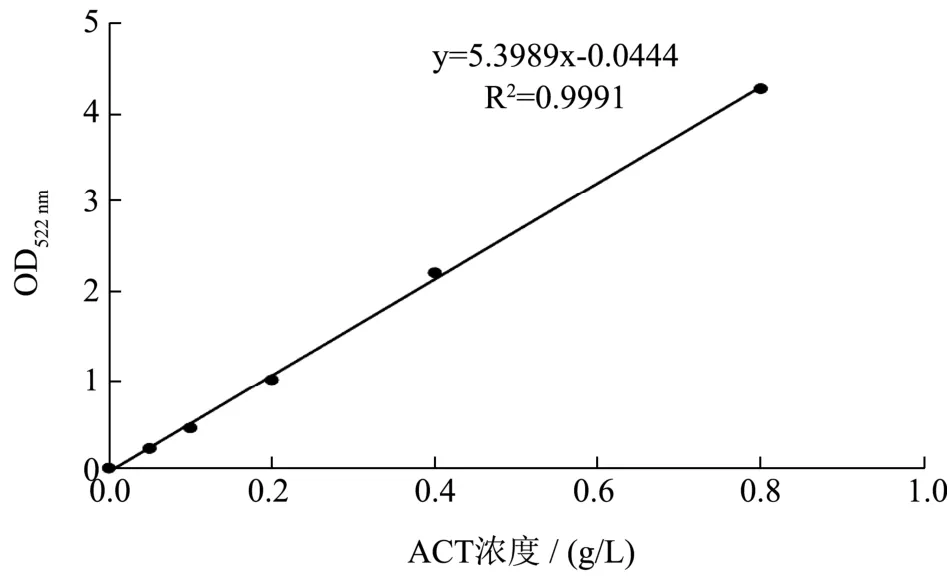
图2 ACT标准曲线Fig.2 Standard curve of acetoin
2.1.3 样品复筛
对初筛获得的5株芽孢杆菌进行摇瓶发酵复筛实验,发酵结束后离心取上清液,将其与肌酸混合液反应后测吸光值,结果见表1,筛选得到一株高产ACT的菌株A21。
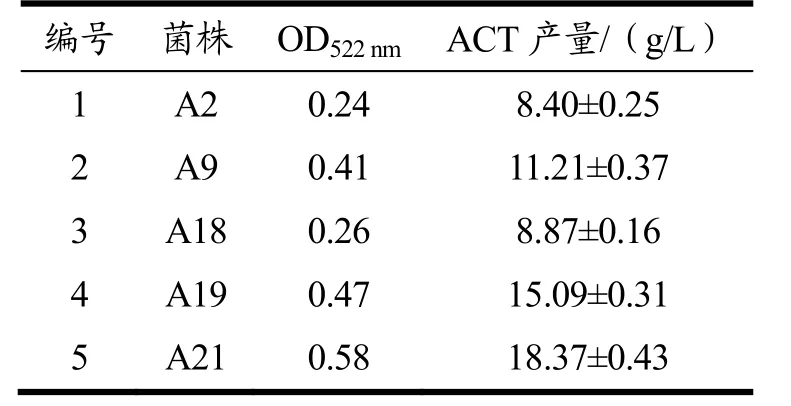
表1 菌株复筛结果Table 1 Strain rescreening results
2.2 菌株A21的生长曲线
在摇瓶培养的过程中,每隔2 h取样测OD600nm值,由图2可知,菌株A21在0~4 h为生长延滞期,菌数增长缓慢;6~12 h为对数生长期,活菌数以几何级数快速升高;12~18 h处于稳定生长期,菌群总数保持稳定;18 h后开始进入衰亡期。
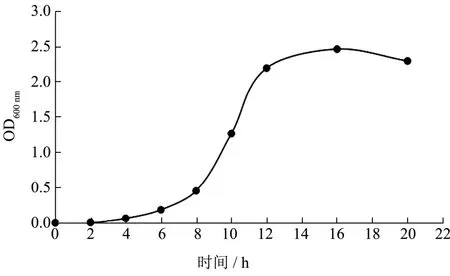
图3 菌株A21生长曲线Fig.3 Growth curve of strain A21
2.3 菌株A21的耐受性特征
由图4a可知,当pH为3.5时,OD600nm值为0.1,表明该菌株具有较强的耐酸性能,最低酸耐受pH为3.5,随着pH的增大,OD600nm值先增大后降低,表明菌株A21生物量呈先上升后下降的趋势,在pH 5~8时生长良好,其最适生长pH为5.0。由图4b可知,随着乙醇体积分数的升高,OD600nm值逐渐降低,表明随着酒精度的不断增加,菌株A21生长逐渐受到影响,菌株A21适合在酒精度较低的条件下生长繁殖,当酒精度达到6%时,OD600nm值趋于零,表明菌株A21的生长完全受到抑制,乙醇最大耐受5%。
2.4 菌株A21的鉴定
2.4.1 形态观察
菌株A21革兰氏染色后呈紫色(图5a);芽孢染色实验表明该菌株含有芽孢(图5b),染色后芽孢呈绿色,菌体呈红色;由电镜照片可知,此菌株大小,宽0.40 μm~0.80 μm,长2 μm~3.80 μm(图5c)。由此判断该菌株为革兰氏阳性短杆状芽孢杆菌。
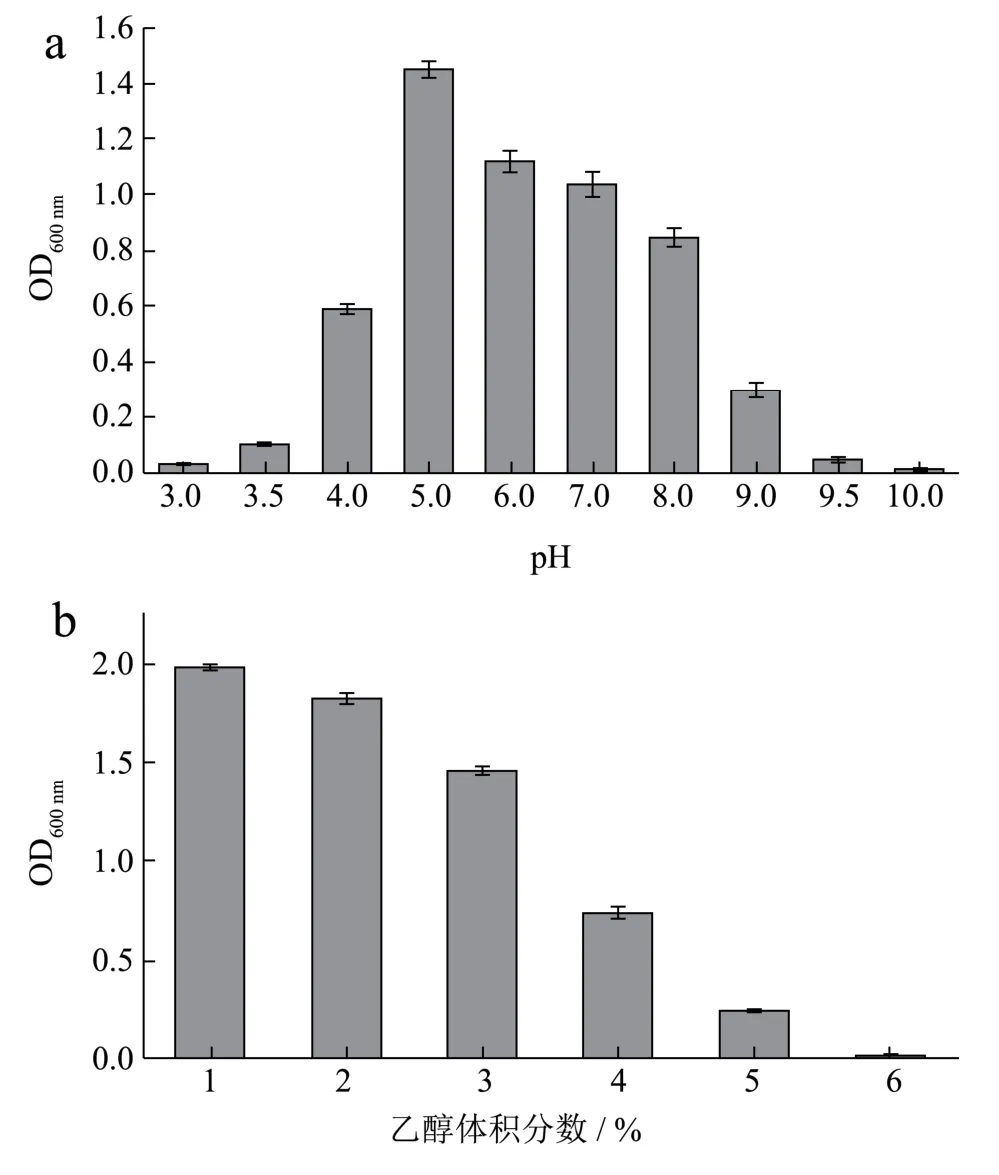
图4 菌株A21对酸度和乙醇的耐受性Fig.4 Acidity and ethanol tolerance of strain A21
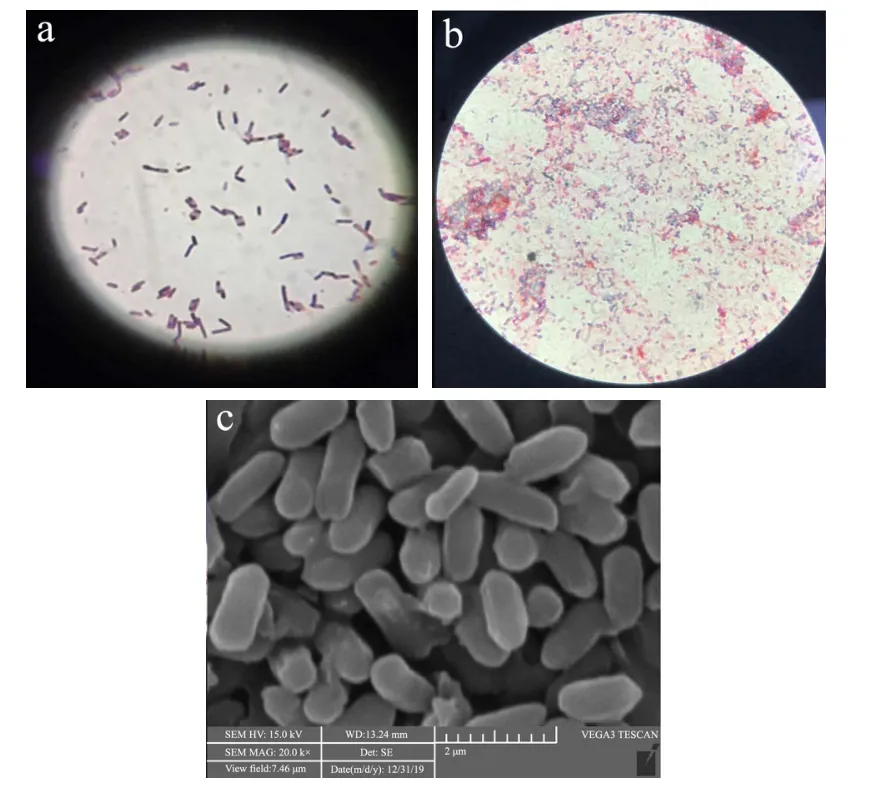
图5 菌株A21的形态学特征Fig.5 Morphological characteristics of strain A21
2.4.2 生理生化试验
菌株的生理生化试验结果见表2。菌株A21兼性厌氧,能产酸,有运动性,产蛋白酶、淀粉酶、明胶酶,还可使硝酸盐还原,糖利用实验表明菌株A21可以利用葡萄糖、蔗糖、麦芽糖、乳糖、可溶性淀粉,不能产气,甲基红试验为阴性,对照细菌手册可知菌株A21类似于解淀粉芽孢杆菌。

表2 菌株A21生理生化实验结果Table 2 Results of physiological and biochemical experiments of strain A21
2.4.3 菌株的16S rDNA鉴定结果
将测序结果提交NCBI数据库进行BLAST序列比对,再利用MEGA5.0构建系统发育树。结果显示,菌株A21与Bacillus velezensisFZB42在同一分支上(如图6),且相对置信度为90,结合细菌形态与理化鉴定结果,确定菌株A21为贝莱斯芽孢杆菌(Bacillus velezensis),将其命名为Bacillus velezensisDQA21。在《国际细菌命名法规》中曾一度认为解淀粉芽孢杆菌植物亚种与贝莱斯芽孢杆菌是同物异名,但近年来有研究人员[20]陆续利用全基因组比较对贝莱斯芽孢杆菌、解淀粉芽孢杆菌植物亚种的分类地位进行研究,结果认定贝莱斯芽孢杆菌不是解淀粉芽孢杆菌的同物异名,使其获得在细菌命名法中的地位。
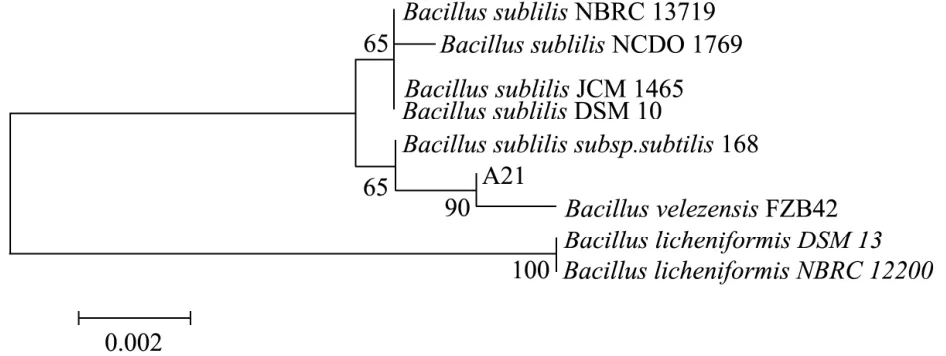
图6 菌株A21系统发育树构建结果Fig.6 Results of phylogenetic tree construction of strain A21
2.5 Bacillus velezensis DQA21产ACT发酵条件优化
2.5.1 单因素试验发酵条件优化
由图7a可知,发酵培养基的初始pH为5.5时ACT的产量达到最大值25.06 g/L,随着pH的增加产量快速下降。外界pH的变化会改变菌体细胞内的pH值,从而影响细菌的代谢反应,进而影响细胞的生物量[20]。B.velezensisDQA21在pH 5~7范围内生长良好,且在酸性条件下,ACT合成途径中关键酶α-乙酰乳酸合成酶活力较强[22],能积累大量丙酮酸,乳酸脱氢酶活力较低[23],催化较少的丙酮酸形成乳酸,从而相对多的丙酮酸被转化为ACT。ZHANG[24]釆取了分段控制pH的策略,发酵前48 h,pH控制在6.5,此时乙偶姻还原酶、2,3-丁二醇脱氢酶催化反应向生成ACT和2,3-丁二醇的方向进行;郝飞[21]在发酵前期(0~16 h)控制pH 5.5,发酵中后期(16~72 h)控制pH 4.5,证明酸性条件下更有利于细胞合成ACT。
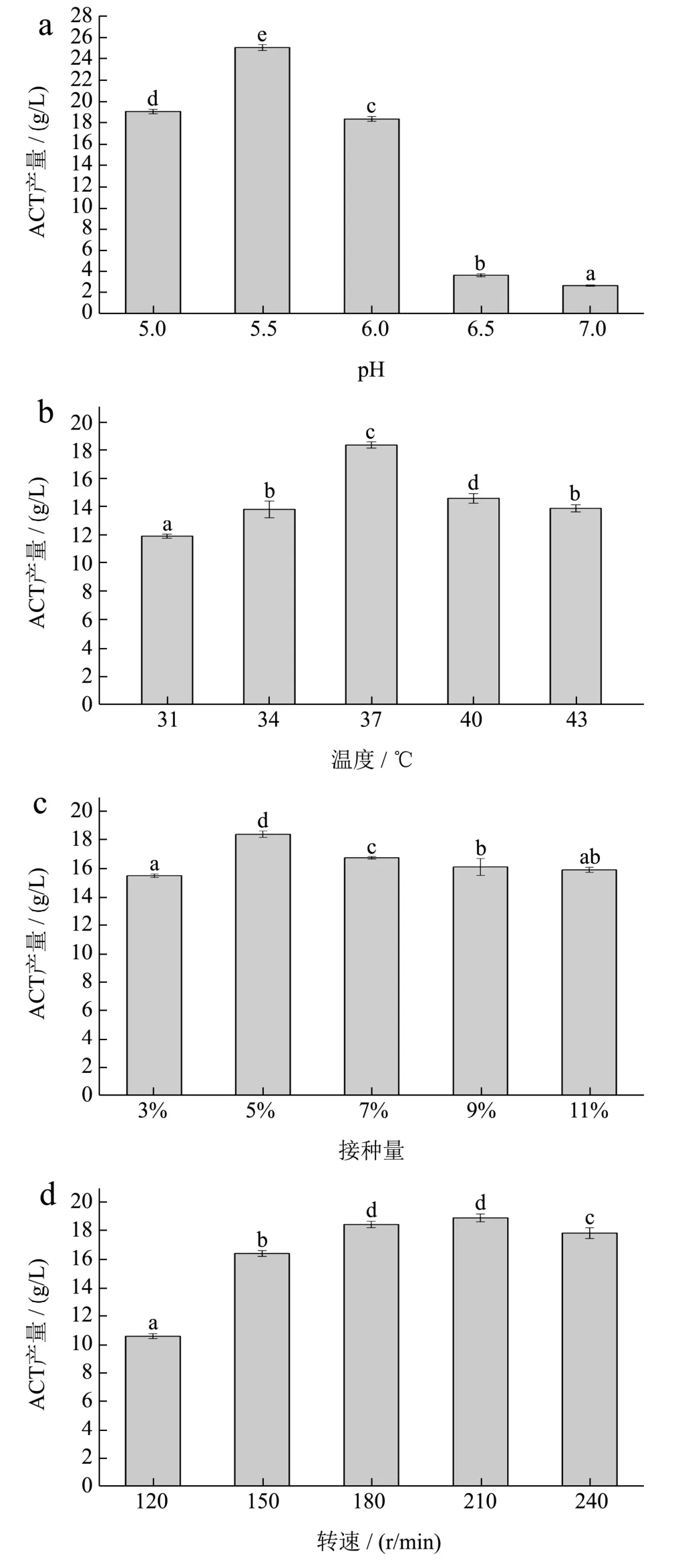
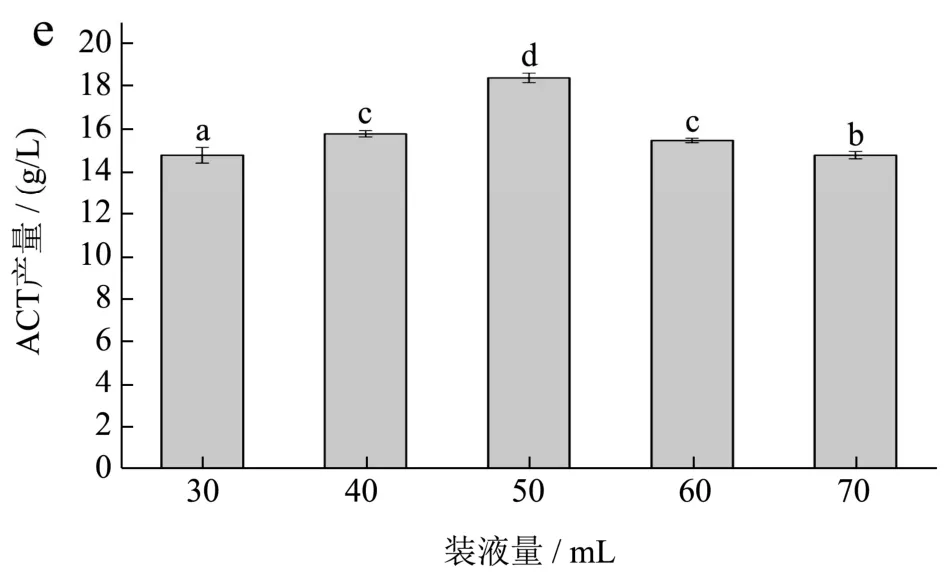
图7 B.velezensis DQA21发酵产ACT的单因素实验结果Fig.7 Single-factor experimental results of ACT production by B.velezensis DQA21
由图7b可知,当发酵温度从31 ℃升至37 ℃时ACT产量随之增加,37 ℃时ACT的产量达到最大值,可能是由于B.velezensisDQA21在37 ℃时最适合其生长繁殖且其关键酶活性亦随之提高。随后ACT产量又随温度升高而降低,推测高温下B.velezensisDQA21代谢酶受到抑制,同时ACT在高温下会与氨反应生成四甲基吡嗪,造成ACT浓度下降[25]。由图7c可知,ACT产量随菌株接种量的增大而增加,在5%时达到最大,随后有所下降,这是由于接种量过大引起发酵初期比较高的细胞浓度,进而底物大量消耗,造成产物合成阶段营养物质供应不足。由图7d可知,ACT产量随转速增加而增大,当转速为210 r/min时ACT产量达到最大值,随后开始下降。ACT的积累需要大量氧气,低转速条件下溶氧较低不利于菌体生长繁殖,但转速过高产生的剪切力会加速菌体衰亡,同时可能会导致副产物2,3-丁二醇、四甲基吡嗪会加速生成[26]。由图7e可知,ACT产量随装液量增加而增大,当装液量为50 mL/250 mL时ACT产量达到最大值,随后开始下降,这是由于装液量也与溶氧有关,装液量过少时,溶氧虽然增加,但发酵后期营养不足,不利于ACT积累。
2.5.2 正交试验
在单因素实验的基础上,通过正交试验考察各因素对B.velezensisDQA21的ACT产量影响的大小。正交试验设计方案及结果见表3,由极差分析可知,各因素对ACT产量的影响大小依次为pH>温度>装液量>接种量>转速。选取对ACT产量影响前3的因素进行响应面试验,其余各因素选取最优值进行实验,转速210 r/min,接种量5%。正交试验方差分析结果见表4,pH和温度p<0.01,装液量p<0.05,接种量和转速p>0.05,说明pH和温度对ACT产量具有极显著影响,装液量对ACT产量具有显著性影响,接种量和转速对ACT产量无显著性影响。
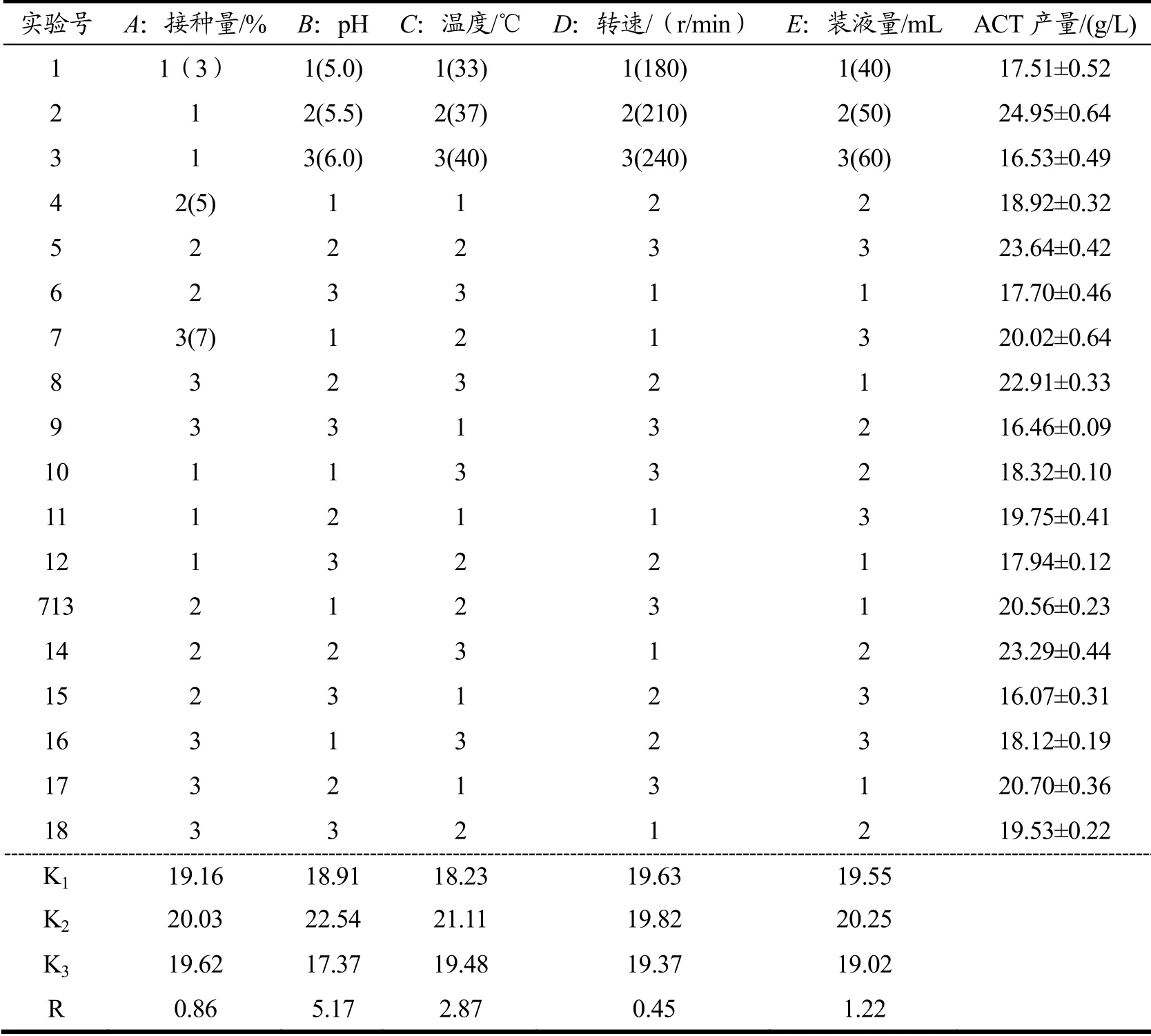
表3 正交试验设计方案及结果Table 3 Design and results of orthogonal test
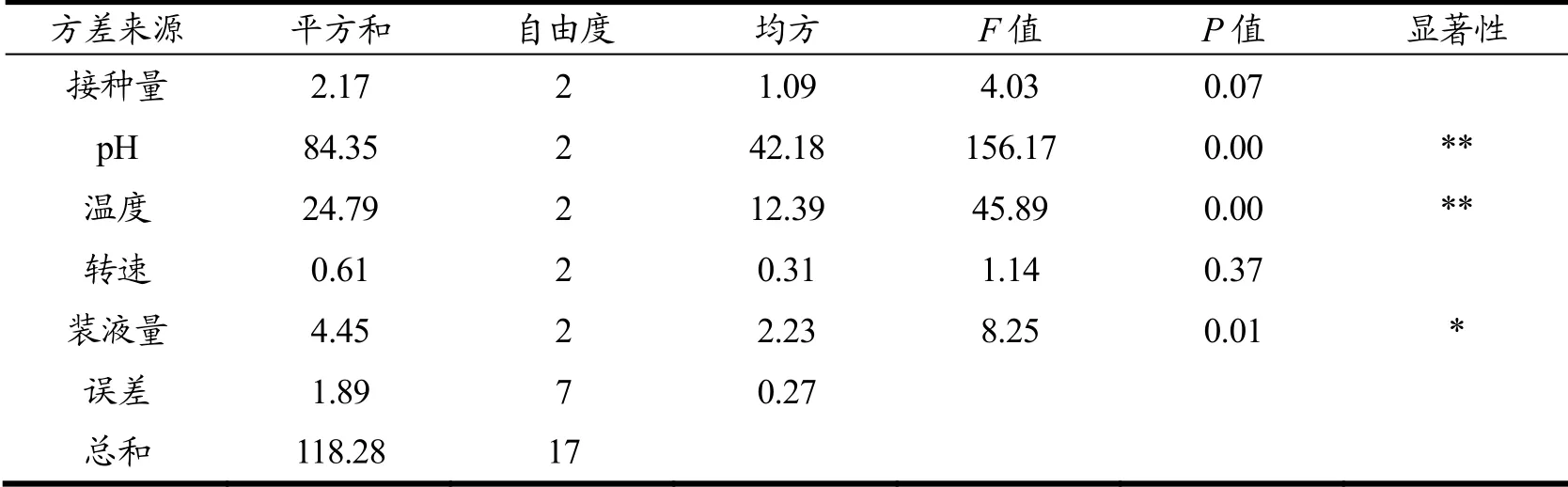
表4 正交试验方差分析Table 4 The variance analysis of orthogonal test
2.5.3 Box-Behnken实验结果与分析
2.5.3.1 二次响应面回归模型的建立与分析
根据正交试验结果,对pH、温度、装液量做3因素3水平共17个试验(5个中心点)的响应面分析试验,设计方案及结果见表5。经多元二次回归拟合后,建立了ACT发酵条件优化模型,回归方程为:Y=25.42-0.72A+0.40B-0.38C-0.33AB+0.23AC+0.17BC-5.57A2-2.07B2-2.02C2。
由回归模型方差分析(表6)可知,模型p<0.01,达到极显著水平,说明模型的预测值与实际值非常吻合。失拟项p为0.32>0.05,失拟项差异不显著,证明模型与实验拟合程度较好,具有统计学意义。模型中一次项A、B、C对ACT产量的影响极显著,一次项影响因子的主次顺序为pH>温度>装液量,这与正交试验的结果吻合。二次项A2、B2、C2对ACT产量的影响极显著。交互项AB对ACT产量的影响极显著,AC对ACT产量影响显著,BC对ACT产量影响不显著。
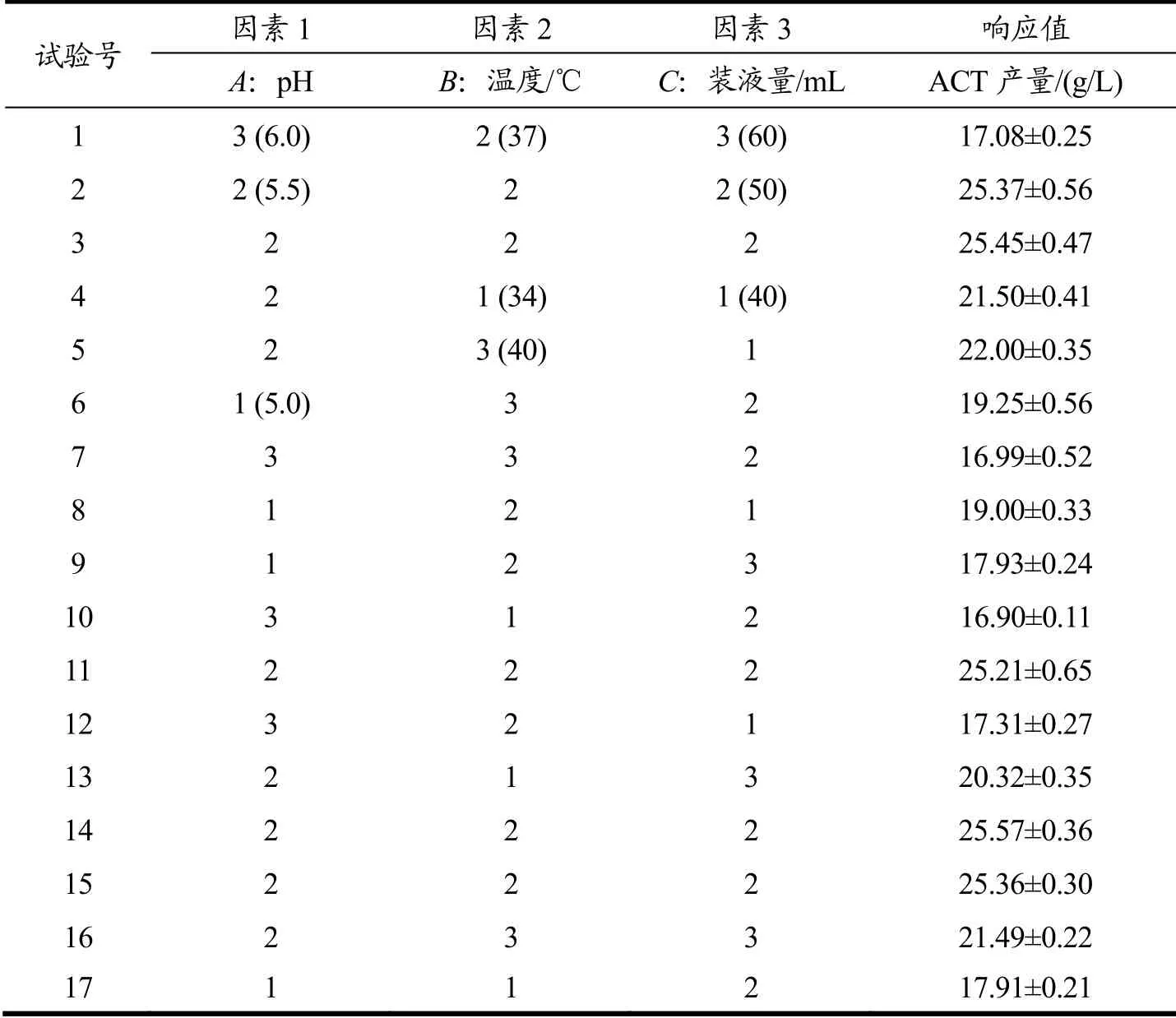
表5 响应面试验设计方案及结果Table 5 Design and results of response surface test
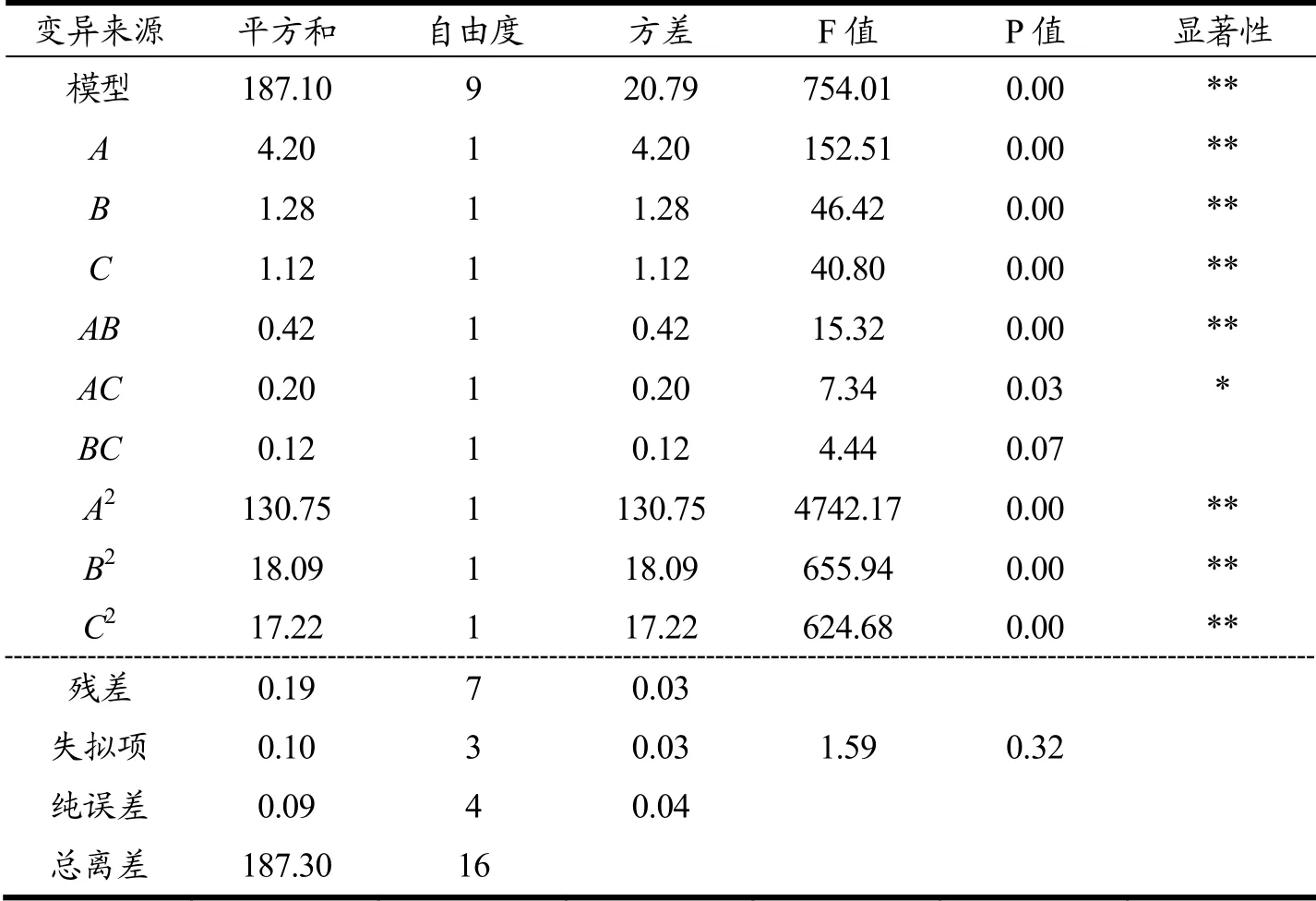
表6 回归模型方差分析结果Table 6 Analysis of variance (ANOVA) for response surface model
2.5.3.2 各因子交互作用对ACT产量影响的分析
响应面图可以直观的反映出试验因素对ACT产量的影响,响应面坡度越陡峭,说明响应面值对操作条件的改变越敏感。温度和pH(图8a)、装液量和pH(8b)交互作用的响应曲面坡度均较为陡峭且等高线密集,呈椭圆形,表明交互作用显著;装液量和温度(图8c)交互作用的响应曲面坡度均较为平缓,等高线稀疏,接近圆形,表明交互作用不显著,该结果与表6方差分析结果一致。
2.5.3.3 最优实验条件ACT产量及验证
通过对回归方程模型的分析,B.velezensisDQA21产ACT的最佳发酵条件为:pH 5.46,温度37.3 ℃,装液量49.2 mL,此时ACT产量预测值为25.45 g/L。在此条件下,重复5次摇瓶发酵实验,得到ACT平均产量为25.60±0.33 g/L,该结果与预测值十分接近,证明试验得到的模型可以较好的预测B.velezensisDQA21发酵后ACT产量。
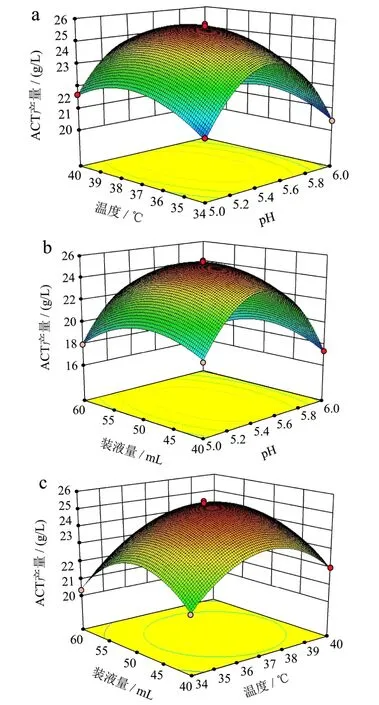
图7 响应面分析因素间交互作用对ACT产量的影响Fig.7 Response surface analysis of the effect of interactions among independent variables on ACT yield
3 讨论
3.1 本研究从浓香型大曲中分离出30株芽孢杆菌,通过肌酸比色法快速判断出其中20株菌株可产ACT,有5株产ACT能力较强,将这5株菌摇瓶发酵后测吸光值,利用ACT标准曲线计算出ACT产量,得到一株高产ACT的菌株A21。经生理生化及16S rDNA鉴定,A21为一株贝莱斯芽孢杆菌,其pH耐受范围为3.5~9、乙醇最大耐受值为5%。在单因素试验的基础上进行了正交试验,由极差分析可知,各因素对ACT产量的影响大小依次为pH>温度>装液量>接种量>转速。对前3因素进行响应面优化试验,由方差分析可知:pH、温度、装液量对ACT产量的影响极显著。B.velezensisDQA21产ACT的最佳发酵条件为:pH 5.46,温度37.3 ℃,装液量49.2 mL,转速210 r/min,接种量5%,此时ACT产量为25.60 g/L,比优化前菌株产率18.37 g/L提高了39.13%。
3.2 赵洪源[13]利用气相色谱法从凉州熏醋中筛选出一株高产ACT的醋酸杆菌,最佳发酵条件为培养温度31.31 ℃、接种量8.27%、pH 6.55、摇床转速209 r/min,最适条件下ACT达到19.04 g/L,比原始发酵产量高35.80%;郝飞[23]通过两阶段控制pH:发酵前期(0~16 h),控制pH 5.5,发酵中后期(16~72 h),控制pH 4.5,使菌株合成ACT的能力得到进一步提高,ACT的产量为32.70 g/L。本研究所得贝莱斯芽孢杆菌的发酵条件与他们有明显差异,证明不同来源的菌株发酵水平不同。刘延波[27]、王志山[28]从大曲中分离筛选出的贝莱斯芽孢杆菌具有高产淀粉酶、蛋白酶的特征;杨斌[29]从大曲中获得一株具有高发酵力的贝莱斯芽孢杆菌,但都未对贝莱斯芽孢杆菌的其余特性进一步探究。现有产ACT芽孢杆菌的研究多为枯草芽孢杆菌[30]、解淀粉芽孢杆菌[31],贝莱斯芽孢杆菌产ACT的报道较少,且多应用于生物防治[32],未见对大曲中高产ACT贝莱斯芽孢杆菌菌株的报道。
3.3 由于B.velezensisDQA21来源于大曲,对温度有较大的耐受性,且在耐酸、耐乙醇等方面表现出较好的特性,非常利于后期通过代谢工程的手段,使其ACT产量大幅提升,为ACT微生物合成的工业化奠定基础。B.velezensisDQA21可作为强化曲[33]投入发酵,也可制成窖泥养护液,使其定植于窖泥中,改善窖泥风味,对提高浓香型大曲酒的风味具有潜在价值,同时ACT作为健康功能因子四甲基吡嗪的前体物质,也表明该功能菌株在健康营养白酒生产中有非常重要的应用前景[34]。本研究主要采用摇瓶发酵的方法,很多因素(如pH、溶氧、补糖等)难以在发酵过程中进行有效控制,不能充分发掘该菌发酵生产ACT的潜力,对于该菌廉价原料的寻找、ACT发酵规模的放大及相关酶学性质,也待进一步研究。

