核桃油对脂多糖诱导小鼠小肠炎性因子TNF-α的影响
缪福俊 单春兰 耿树香 宁德鲁 王宣军
(云南农业大学食品科学技术学院1,昆明 650201)(云南省林业和草原科学院2,昆明 650201)
肠道是机体营养消化吸收的最大场所,在维持肠道稳态中发挥了重要作用,然而机体的肠道易受环境、饮食等因素的影响下极易引发肠道炎症[1,2]。炎症性肠病(IBD)是一种慢性非特异性肠道炎症性疾病,其发病机制尚未完全清楚[3]。细胞因子广泛存在肠道黏膜中,其中肿瘤坏死因子α(TNF-α)属重要的促炎因子,其在肠道中的表达水平直接影响肠道炎症的变化[4]。目前用于治疗IBD的主要临床药物包括糖皮质激素、TNF-α抑制剂、5氨基水杨酸等,长期服用存在着价格昂贵、毒副作用大、易产生药物依赖等问题[5]。由于近年来IBD的发病率越来越高,严重影响人类的健康,从天然产物中提取安全、低毒或无副作用的功能性成分已成为目前的研究热点[6]。
核桃是我国传统的药食两用佳品,由核桃仁提炼的核桃油,具有核桃仁大部分的营养保健及药理功效成分[7,8]。核桃油具有良好的脂肪酸结构(亚油酸∶α-亚麻酸比值接近于4∶1),富含维生素E、磷脂、角鲨烯、黄酮类等脂溶性化合物,具有抗氧化、抗炎症、降胆固醇、抗癌、健脑等功效[9-11]。补充α-亚麻酸可保护IBD患者肠壁的完整性,并通过恢复菌群平衡产生抗炎化合物[12]。
脂多糖(Lipopolysaccharide,LPS)是研究小鼠急性肠道损伤的常用方法之一,LPS经腹腔注射后可透过肠壁引发肠道炎症,激活Toll样受体4/核转录因子-κB(Toll-like receptor 4/Nuclear factor kappa B,TLR4/NF-κB)信号通路,并释放炎性因子,其小肠组织中炎症最为明显[13,14]。然而,核桃油对LPS诱导的小鼠小肠损伤是否会产生保护作用尚不清楚。因此,本研究利用LPS建立小鼠小肠急性损伤模型,通过检测小鼠肠道TNF-α表达水平变化,评价核桃油对小鼠肠道损伤的发挥的保护作用。预期研究结果即可为核桃油在机体肠道健康及其疾病的预防治疗提供新的思路,又可为后期产品深加工提供参考。
1 材料与方法
1.1 材料
1.1.1 小鼠
昆明种雄性小鼠:5周龄,(22±2) g,许可证号SCXK(滇)K2015-0002。普通维持饲料(许可证号SCXK(京)2018-06073),饲养条件(SYXK(滇)K2018-0008):温度为(25±2) ℃,湿度为(40±5)%,12 h日光灯明暗交替循环,自由进食和饮水,适应性饲养7 d。
1.1.2 核桃油
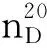
1.1.3 主要试剂
Mouse TNF-α ELISA检测试剂盒、Trizol、cDNA反转录试剂盒、SYBR Green试剂盒、LPS、免疫组化试剂盒,TNF-α抗体。
1.1.4 主要仪器与设备
6YY-280全自动液压榨油机,ELx800TM酶标仪,RM2135石蜡切片机,BX43F正置显微镜,CFX96Touch荧光定量PCR仪,Western blot成套设备。
1.2 方法
1.2.1 动物分组与给药
将40只小鼠随机为4组:对照组(Con)、LPS模型组(LPS)、LPS+核桃油保护组(LPS+WO)和核桃油组(WO)。其中LPS+WO组和WO组灌胃核桃油2.5 mL/kg·d,连续灌胃4周。灌胃后常规饲养,动物自由食水,保持饲养环境清洁。第29天,LPS组和LPS+WO组通过腹腔注射LPS造成急性肠道损伤,剂量为3 mg/kg,LPS溶于无菌生理盐水。Con组和WO组按5 μL/g腹腔注射无菌生理盐水。注射6 h后对各处理组小鼠摘眼球血并分离血清,小鼠脱臼处死后,迅速解剖取出结肠组织,进行后续实验。所有程序遵循中国小动物保护协会的要求。
1.2.2 血清和小肠组织中炎性因子TNF-α检测
小鼠肠道选取十二指肠组织,根据Mouse TNF-α ELISA检测试剂盒说明书检测血清中炎性因子的含量。
1.2.3 肠道组织TNF-α mRNA相对表达检测
TNF-α引物序列(F-GGCAGGTTCTGTCCCTTTCA;R-CTGTGCTCATGGTGTCTTTTC TG)由某公司合成。根据RNA提取说明书提取十二指肠组织RNA,并检测OD260/OD280值。根据cDNA逆转录试剂盒说明书反转录成cDNA,-20 ℃保存备用。荧光定量PCR反应体系为:SYBR 10 μL、引物各1 μL、cDNA模版2 μL、ddH2O 6 μL;反应条件为:95 ℃预变性30 s,(95 ℃变性10 s、Tm退火20 s),40×循环。采用2-ΔΔCt法计算mRNA的相对表达量。
1.2.4 肠道组织TNF-α蛋白Westen blot检测
取十二指肠组织经液氮研磨后加入RAPI裂解液,并置于组织破碎仪提取蛋白,离心获得上清液,经BCA定量检测蛋白浓度,经SDS-PAGE电泳(60 V,30 min;120 V,80 min),转膜(250 mA,50 min),封闭(5%脱脂奶粉,60 min),一抗孵育(1∶1 000,4 ℃摇摆过夜),二抗(1∶5 000,60 min)工序后,在凝胶成像仪中拍照观察。
1.2.5 肠道组织病理的检查
取各处理组小鼠十二脂肠组织0.5 cm于4%多聚甲醛固定,经酒精脱水和石蜡包埋后用徕卡切片机进行切片,厚度5 μm。常规脱蜡复水、经苏木精-伊红(HE)染色,中性树胶封片后于光学显微镜下观察。
1.2.6 肠道组织TNF-α蛋白免疫组化检测
十二指肠石蜡切片1.2.5方法制备。根据免疫组化试剂盒说明书进行染色,用兔抗TNF-α多克隆抗体(1∶200)室温孵育1 h,加入二抗(1∶400),放置15 min,DAPI复染胞核,甘油封片。组织学观察采用400倍放大,每张切片连续观察5个视野,采用Image Pro-Plus 6.0软件(Media Cybernetics, Silver Spring, MD, USA)统计各组TNF-α的表达面积。
1.3 统计与分析
实验数据以平均值±标准差(x±s)表示,采用 SPSS 23.0 统计软件的 ANOVA 程序进行单因素方差分析。采用邓肯(Duncan)氏法进行多重比较检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 核桃油对小鼠血清TNF-α的影响
首先检测了经LPS诱导后各处理组小鼠血清中TNF-α的含量。由图1可知,与Con组相比,LPS组小鼠血清炎性因子TNF-α含量极显著升高(P<0.01)。与LPS相比,LPS+WO组TNF-α、含量显著下降(P<0.05)。WO组中小鼠血液炎性因子水平下调,但与Con组无显著差异(P>0.05)。表明核桃油能降低LPS诱导的小鼠血清炎性因子TNF-α的水平。

注:不同大写字母表示差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05);尾标相同字母表示差异不显著(P>0.05),下同。图1 小鼠血清中TNF-α水平
2.2 核桃油对小鼠小肠TNF-α mRNA表达的影响
LPS诱导的小鼠肠道急性损伤在小肠组织中最为明显,研究了核桃油对小鼠十二指肠TNF-α炎性因子mRNA表达的影响。如图2所示,与Con组相比,LPS能极显著上调十二脂肠组织中TNF-α mRNA的转录水平(P<0.01)。与LPS组相比,LPS+WO组十二指肠组织中TNF-α mRNA的转录水平极显著降低(P<0.01)。WO组TNF-α mRNA的转录水平与Con相比无统计学差异(P>0.05)。表明核桃油能下调小鼠小肠组织中炎性因子TNF-α mRNA的转录水平。

图2 小鼠十二指肠TNF-α mRNA表达水平
2.3 核桃油对小鼠小肠TNF-α蛋白表达的影响
为进一步验证核桃油对LPS诱导的小鼠小肠组织中TNF-α蛋白表达水平的影响,分别采用免疫组化和免疫印迹方法检测了各处理组小鼠十二指肠中TNF-α蛋白水平。免疫组化结果见图3所示,与Con组相比,LPS组小鼠十二指肠组织中TNF-α蛋白表达面积极显著增高(P<0.01)。与LPS相比,LPS+WO组TNF-α蛋白表达面积极显著下降(P<0.01)。WO组与Con组无显著差异(P>0.05)。


图3 小鼠十二指肠TNF-α免疫组化及蛋白表达

免疫印迹结果见图4所示,与Con组相比,LPS能极显著诱导小鼠十二指肠中TNF-α蛋白的表达水平(P<0.01)。与LPS相比,LPS+WO组能极显著抑制小鼠十二指肠中TNF-α蛋白表达水平(P<0.01)。WO组与Con组无显著差异(P>0.05)。表明核桃油能抑制LPS诱导的小鼠十二指肠TNF-α蛋白的表达,与TNF-α mRNA的转录水平结果一致。

图4 小鼠十二指肠TNF-α免疫印迹及定量表达
2.4 核桃油对小鼠小肠病理的影响
采用HE染色观察了各处理组小鼠十二指肠组织病理学变化(图5),Con组和WO组小鼠十二指肠组织结构正常,绒毛结构完整,排列紧密,无组织学病变。LPS组十二指肠绒毛萎缩,上皮细胞脱落,绒毛有断裂现象,固有层炎性细胞浸润,提示小鼠肠道炎症模型建立成功。与LPS组相比,LPS+WO组小肠损伤较轻,肠绒毛恢复、炎性细胞浸润减轻。表明核桃油能减轻LPS诱导的小鼠急性肠道炎症的形态损伤。

图5 小鼠十二指肠病理变化
3 讨论
摄入n-3/n-6较高比率的多不饱和脂肪酸对IBD具有明显的预防作用[9]。肠道是机体消化吸收的最大场所,本研究评估在LPS诱导的小鼠急性肠道损伤过程中,核桃油对十二脂肠中TNF-α的影响。LPS是革兰氏阴性菌细胞壁的特有的一种化学成分,由脂质和多糖组成,经腹腔注射进入机体后导致肠道黏膜通透性增加,引发肠道氧化应激,活化TLR4/NF-κB炎症通路,并释放炎性因子TNF-α,进而诱导肠道细胞的坏死和凋亡,促使肠道发生炎症[15]。在本研究中,LPS能显著增加小鼠肠道组织中TNF-α水平,说明LPS诱导了小鼠肠道中TNF-α表达。
随着对核桃油生物活性研究的深入,核桃油具有显著的抗炎活性。Willis等[16]研究表明核桃油的抗炎作用通过磷脂酶D2(Phospholipase D2,PLD2)的活化降低小胶质细胞BV-2中TNF-α的表达水平,从而提高细胞的抗炎能力。Yolanda等研究表明核桃油可降低机体外周血单核细胞中炎性因子TNF-α和IL-6 mRNA的表达水平[18]。核桃油显著的抗炎作用机制可能是通过调控机体肠道菌群组成及多样性水平[增加肠道柔嫩梭菌属(Faecalibacterium)、罗氏菌属(Roseburia)和梭菌属(Clostridium)的相对丰度]相关,这3类菌可以产生丁酸盐,作为一种短链脂肪酸(Short chain fatty acids,SCFAs)具有抗炎和免疫调节的功能[20]。此外,核桃油中多酚类化合物主要为鞣质、黄酮类和酚酸成分,经肠道微生物菌群代谢生成尿石素(Urolithin)A和尿石素B,尿石素在机体内可抑制相关炎性因子的表达减轻炎症反应,如NF-κB、诱导型iNOS、TNF-α、IL-1β等[19,20]。核桃油在IBD非药物防控研究中具有较高参考价值,但其在肠道炎症中确切作用机制仍需进一步探索。
4 结论
本研究利用LPS建立小鼠小肠急性损伤模型,检测了小鼠十二指肠中关键促炎因子TNF-α表达水平的变化。结果表明:核桃油可显著下调LPS诱导的小鼠小肠组织中TNF-α表达水平,并改善小肠组织病理形态。核桃油可能通过抑制小鼠小肠组织中炎性因子TNF-α的表达对LPS诱导的急性肠道损伤发挥保护作用。

