物理改性对小米水溶性膳食纤维的结构表征及硒化能力的影响
王 娟 魏春红 王维浩,2 赵姝婷 刘德志王一飞 武云娇 苏有韬 曹龙奎,2
(黑龙江八一农垦大学食品学院1,大庆 163319)(黑龙江八一农垦大学国家杂粮工程技术研究中心2,大庆 163319)
小米是糖尿病患者的理想食物,其碳水化合物含量低于大米、小麦和玉米,多酚含量、VB1、VB2含量高于小麦和大米[1],且其膳食纤维(DF)含量是大米的2.5倍[2]。DF包括水溶性膳食纤维(SDF)和不溶性膳食纤维(IDF)[3],SDF在防治心血管疾病[4]、糖尿病[5]、动脉硬化等方面具有良好的作用且优于IDF[6],但是天然DF中的SDF含量较低,口感粗糙,阻碍了其在食品工业中的应用。因此,对DF进行改性提高SDF的含量成为很多学者研究的重点[7]。目前对DF的改性方法有物理方法、生物方法、化学方法或联合几种方法进行改性[8],但考虑到生物方法成本高、反应条件苛刻,化学方法安全性低、污染高,综合考虑对小米进行物理改性。现阶段,对于小米SDF的研究还停留在提取工艺、理化性质研究及加工方式对结构的影响[9,10],而在小米SDF改性方面的研究涉及较少。
目前对于DF功能性质的研究主要集中在吸水性、吸油性、胆固醇吸附能力等方面[11],而其对微量元素的影响鲜有报道。硒是人体的必需微量元素,可以抗氧化、促进免疫、参与基因表达[12]。自然界中的硒大多以无机硒存在,其吸收率较低,且对人体有一定的毒副作用,有机硒毒性小、安全指数高、体内转化率高,但有机硒含量相对较少[13],所以有机硒的开发利用至关重要。研究表明,将无机硒与多糖结合不仅可以降低无机硒毒性,还可以增加多糖的生物活性[14],而SDF与多糖具有相似的结构,如C—H、C—O等基团[15],这些基团在多糖与硒的结合中起着重要作用。因此,本实验研究改性前后的SDF的结构并研究其硒化修饰能力,以筛选出一种可使SDF硒化能力增强的改性方法,为进一步开发有机硒新产品、拓宽小米及小米SDF的应用提供借鉴。
1 材料与方法
1.1 实验材料
小米品种为东方亮谷,颗粒饱满均匀,色金黄,无霉烂碎米;蛋白酶(水解酶类,60 000 U/mL),耐高温α-淀粉酶(水解酶类,40 000 U/mL),淀粉葡糖苷酶(水解酶类,100 000 U/mL);溴化钾,光谱级;95%乙醇等试剂均为分析纯。
1.2 仪器与设备
GDE-CSF6膳食纤维测定仪,LHL型流化床式气流粉碎机,Nicolet 6700傅里叶变换红外光谱仪,LC20+RID20A凝胶渗透色谱仪,D8 ADVANCEX射线粉末衍射仪,SU8020场发射扫描电子显微镜,CW-2000A超声-微波协同萃取反应仪。
1.3 方法
1.3.1 小米前处理
小米粉的制备:取适量小米,经粉碎过60(D50=250.00 μm)目筛,进行脱脂处理,备用。
超微粉碎小米粉的制备:取适量小米,进行超微粉碎(D50=13.29 μm)后脱脂,备用。
流化床气流粉碎系统设有3个喷嘴,喷嘴间平面角度为120°,以洁净压缩空气为粉碎工质,空气温度不高于45 ℃。粉碎操作参数:持料量1.0 kg;进料频率3 Hz;粉碎工质压力0.8 MPa,分级机转速3 600 r/min;引风机流速15 m3/min;粉碎时间30 min。
脱脂:利用索氏提取法对小米粉进行脱脂处理[16]。
1.3.2 小米SDF的制备
1.3.2.1 超声-微波(U-M)萃取改性小米SDF的制备
称取5.00 g经普通粉碎的脱脂小米粉,在U-M萃取仪中按照微波功率550 W,料液比1∶25 (V∶V),微波温度55 ℃,微波时间20 min进行处理,将溶液转至500.00 mL烧杯中,加入250.00 mL磷酸盐缓冲溶液(0.08 mol/L,pH=6),分别加入耐高温α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶进行酶解,期间用碘液检测淀粉含量,硫酸铵使蛋白质充分沉淀,之后灭酶,滤液经浓缩后,4倍体积的95% (体积分数)乙醇溶液醇沉、离心、干燥得U-M萃取改性小米SDF (SDF1)。同时去除空白、未消化蛋白质、灰分的影响。
1.3.2.2 小米SDF的制备
称取5.00 g经普通粉碎脱脂小米粉,加入125.00 mL蒸馏水,加入250.00 mL磷酸盐缓冲溶液(0.08 mol/L,pH=6),分别经耐高温α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶进行酶解,期间用碘液检测淀粉含量,硫酸铵使蛋白质充分沉淀,灭酶,滤液浓缩后,用4倍体积的95% (体积分数)乙醇溶液醇沉、离心、干燥得小米SDF (SDF2)。同时去除空白、未消化蛋白质、灰分的影响。
1.3.2.3 超微粉碎协同U-M萃取改性小米SDF的制备
称取5.00 g经超微粉碎的脱脂小米粉,在U-M萃取仪中按照微波功率550 W,料液比1∶25 (V∶V),微波温度55 ℃,微波时间20 min进行处理,后续过程同(1),得超微粉碎协同U-M萃取改性小米SDF (SDF3)。
1.3.2.4 超微粉碎改性小米SDF的制备
称取5.00 g经超微粉碎的脱脂小米粉,后续过程同1.3.1,得超微粉碎改性小米SDF (SDF4)。
1.3.3 小米SDF的傅里叶变换红外光谱测定
参照张艳荣等[17]方法,称取干燥样品2.00 mg与溴化钾粉末200.00 mg于研钵中,充分混匀,研磨,制片。在4 000~400 cm-1进行红外光谱扫描。
1.3.4 小米SDF超微结构的观察
参照Park等[18]方法,将样品干燥至恒质量,取适量进行黏台、镀金,对样品进行5 000、10 000、20 000、50 000倍微观结构观察拍照。
1.3.5 小米SDF分子质量分布的测定
称取适量样品于容量瓶中,用流动相溶解,定容。色谱条件:色谱柱:TSKgel GMPWXL,流动相:水相,少量硝酸钠、叠氮化钠,流速:0.5 mL/min,柱温:30 ℃,进样量:20 μL。
1.3.6 小米SDF的X射线衍射测试
取适量干燥后的SDF于样品槽中用玻璃板压平,将其置于自动X射线衍射仪中[19]。参数设置:λ=0.156,管压36 kV,管流20 mA,Cu靶,扫描速率2 (°)/min,衍射角度2θ,扫描范围2°~40°,扫描频率0.02 (°)/步。
1.3.7 阳离子交换能力的测定
参照Chau等[20]的方法测定4种SDF的阳离子交换能力,称取小米SDF 1.00 g于250.00 mL三角烧瓶中,加入1 mol/L HCl溶液50.00 mL,搅拌均匀后密封,静置24 h,加入5 g/100 mL的NaCl溶液50.00 mL,搅拌均匀,加入2滴酚酞指示剂,用1 mol/L NaOH溶液滴定至终点,记录滴定体积。同时做空白实验,阳离子交换能力按式(1)计算。
(1)
式中:V1为滴定样品消耗氢氧化钠溶液体积/mL;V0为滴定空白样消耗氢氧化钠溶液体积/mL;m为样品干质量/g;1为滴定所用氢氧化钠溶液浓度/mol/L。
1.3.8 硒化能力的测定
准确称取500.00 mg SDF,缓慢滴加0.5%的HNO350 mL,边加边搅拌,均匀后加入0.65 g BaCl2固体粉末,然后滴加5 mg/mL Na2SeO3溶液4.00 mL,50 ℃恒温下搅拌反应6 h,冷却至室温,无水碳酸钠调节pH=5~6,加入一定量硫酸钠固体粉,离心得上清液用流水透析1 d,透析液减压蒸馏至10~20 mL,之后再用蒸馏水透析1 d,透析液冷冻干燥得硒化小米SDF。
称取50.00 mg硒化小米SDF,加入3.00 mL混酸(V硝酸∶V高氯酸=4∶1) 浸泡过夜,次日加热消解至消化液出现浅棕色,冷却至室温;加入0.50 mL的双氧水,加热到出现白烟,冷却至室温;用10.00 mL蒸馏水冲洗瓶壁,然后加热赶酸至剩余体积为1~2 mL,然后加入6 mol/L混酸,定容至10.00 mL;取2.00 mL溶液,加6.00 mL蒸馏水,1.0 mol/L的盐酸溶液调至pH=2~3,加入4.00 mL体积分数为2%的邻苯二胺溶液,放置暗处20 min,质量分数5% 的NaOH溶液调节至中性,加入5.00 mL甲苯振荡2 min,静置分层,甲苯层在334 nm处测吸光度,得其含量为x[21,22],硒含量按式(2)计算。
(2)
式中:Se为硒多糖中硒的含量/mg/g;Cx为甲苯萃取溶液中硒的浓度/μg/mL;V1为待测水溶液的体积/mL;V2为甲苯萃取液的总体积/mL;V3为用于络合测试的待测水溶液的体积/mL;m为多糖亚硒酸酷的质量/g。
1.4 数据统计与分析
所有实验均进行3次平行,取其平均值,SPSS 22软件对数据进行显著性分析(P<0.01),Excel 2019对数据进行统计分析,用Origin 8.0软件进行绘图处理。
2 结果与分析
2.1 改性小米SDF的红外光谱分析
小米SDF的红外光谱图如图1所示,4种SDF具有相似的光谱模式,但改性后部分纤维素类多糖特征吸收峰强度发生变化[23]。4种SDF在2 984 cm-1处出现饱和的C—H伸缩振动,峰强较弱,这可能是烷烃类的C—H振动峰;2 192~2 204 cm-1处的特征吸收峰由炔烃C—H的伸缩振动所致;1 467 cm-1处可能是O—H的变形振动引起;1 400~1 200 cm-1范围内为C—H或C—O的变角振动吸收峰,这些区域的吸收峰为糖类的特征吸收峰[24],SDF2和SDF3在1 361 cm-1处出现特征吸收峰,SDF1和SDF4在1 358 cm-1处出现特征吸收峰,这是甲基的C—H对称弯曲振动引起的,由此可知小米SDF与糖类存在相似的结构;指纹区在1 300~650 cm-1处出现吸收峰,分别在1 279、869、855、753 cm-1处出现吸收峰,分别对应C—O、C—C伸缩振动峰和C—H面外弯曲振动吸收峰[25],其中869 cm-1处的特征吸收峰,是糖分子中次甲基的横向振动吸收,表明小米SDF中有甘露糖苷键存在[26]。4种SDF虽然改性方法不同,但峰型及出峰位置无明显变化,说明物理改性不会改变物质结构,但由于官能团含量或结合方式不同,所以导致峰的吸收强度不同,且这些基团对SDF理化性质如持水力、油能力、阳离子吸附和金属螯合等起着重要作用[27]。

图1 小米SDF的傅里叶变换红外光谱图
2.2 改性小米SDF的显微结构
4种小米SDF的微观形态如图2所示,2万倍放大倍数下,小米SDF表面网状结构被破坏,组织结构疏松,放大倍数增大后,小米SDF微观结构为大小不一的颗粒圆球状,分布较密集。当放大倍数为2万倍时,SDF3较其他3种SDF出现明显的片层结构,而放大倍数为5万倍时,SDF1微观结构似葡萄串状,中间有较大孔隙,SDF2结构分布较均匀,SDF3结构为颗粒圆球状,有较明显的片层存在,SDF4孔隙较大。可能是因为物料经过处理后粒度更加均匀,使其微观结构和分子大小改变[28],或者超微粉碎协同U-M作用极大程度地破坏了纤维的糖苷键及分子间氢键作用力,使得SDF降解,分子质量降低,聚合度变小[29]。超微粉碎协同U-M萃取改性可破坏SDF的网状结构,使SDF表面粗糙,出现片层结构,而且超微粉碎极大的剪切力可以使SDF的内部结构发生变化,使包裹在内部的基团暴露出来,与傅里叶红外光谱的结果也一致[30]。

注: 图b、图d、图f和图h分别为图a、图c、图e和图g的局部放大图。图2 小米SDF的扫描电子显微镜图
2.3 改性小米SDF的相对分子质量分布
采用凝胶渗透色谱法测定4种SDF分子质量绘制出的分布图,结果如表1所示。从重均相对分子质量角度分析,SDF2的重均分子质量大于其他3种SDF,说明SDF2较其他3种SDF分子链长,分析可能是由于酶法提取的反应条件较温和,作用于物料细胞壁释放SDF,而未对SDF大分子进行降解[31],而其他3种SDF的分子链被切断,聚合度降低,从而使其重均相对分子质量降低[32]。4种SDF的分散指数均大于1,说明分子质量呈多分散,有自由基产物存在,其中SDF2分散指数大于3,说明SDF2的分子质量较大且分布范围广[33]。超微粉碎协同U-M萃取改性会使小米SDF分子链被切断,聚合度降低,分子质量降低。

表1 小米SDF分子质量测试结果
2.4 改性小米SDF的X射线衍射结果
图3为4种SDF的X-衍射图谱, SDF1在2θ为14.08°、19.85°和32.19°处有明显的结晶衍射峰,SDF2在2θ为21.02°处有明显的结晶衍射峰,这表明SDF1的晶体为纤维素Ⅰ型和纤维素Ⅱ型,SDF2的晶体为纤维素Ⅰ型[34],根据Segal[35]的计算方法,可计算两者的结晶度分别为24.50%、20.19%,说明U-M萃取处理使小米SDF表面结构被破坏,结晶区暴露,从而结晶度增大[36];SDF3和SDF4在2θ范围内衍射强度较弱,无明显的结晶衍射峰。李杨等[37]研究发现物料粒度对DF衍射峰的位置无明显影响,但是衍射峰的强度却随着物料粒度的减小而减小,而且衍射峰宽度增加;王秋阳等[38]分析造成这种现象的原因是超声波使结晶区纤维素分子间的氢键破坏,纤维素分子发生部分降解,进而使得衍射峰不明显,本结果与前人研究结果相同,证明物料粒度及超声波对物料结构具有一定影响。超微粉碎对小米SDF结晶区造成破坏,但不会改变晶体结构。

图3 小米SDF的X-衍射图谱
2.5 改性小米SDF的阳离子交换能力的比较
膳食纤维的羧基、羟基等离子型官能团的暴露量是判断其阳离子交换能力强弱的关键影响因素[39]。由图5可知,4种SDF的阳离子交换能力强弱依次为SDF3>SDF1>SDF4>SDF2,说明物料经超微粉碎协同U-M萃取改性可以提高小米SDF阳离子交换能力,这可能是由于超微粉碎减小了物料粒度,使其表面暴露出许多糖醛酸结合位点[40],增加了交换的概率,再加上U-M萃取具有超声波的空化作用及微波的高能作用[41],可以使SDF表面积增大,基团暴露,与傅里叶红外光谱测定结果一致。本研究表明超微粉碎协同U-M萃取改性对小米SDF的阳离子交换能力具有显著的增强作用,有助于SDF与硒的结合能力的提高。
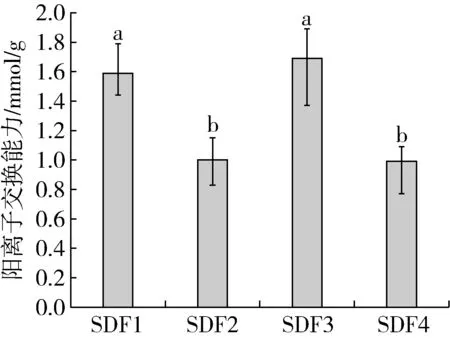
图5 小米SDF的阳离子交换能力的比较
2.6 改性小米SDF硒化能力的测定


图6 小米SDF硒化能力的比较
3 结论
利用3种物理方法对小米进行改性处理,并对4种小米SDF与硒元素的结合能力进行考察,实验结果表明物理改性对小米SDF官能团、结晶度无明显影响,而对于小米SDF微观结构、分子质量大小及分布范围具有一定影响,其中超微粉碎协同U-M萃取可使小米SDF呈现较明显的特征吸收峰,分子质量减小,X-衍射峰宽度增加,并且使SDF具有较强的阳离子交换能力和硒化能力。本研究仅对小米中的SDF进行了物理改性,后续可利用生物方法或物理生物相结合的方法对其进行改性。

