TINCR靶向microR-544a/FBXW7对人乳腺癌细胞增殖、侵袭的影响*
江国斌,陈晓萍
(台州医院 乳腺甲状腺外科,浙江 台州318050)
乳腺癌是全球范围内常见的恶性肿瘤之一,是女性死亡的首要原因[1]。据全球癌症报告统计,2016年全球约25万人确诊为乳腺癌,占女性恶性肿瘤新发病例的29%左右[2]。近年来,乳腺癌在我国的发病率呈上升趋势,且逐渐年轻化,对我国女性生命安全造成严重威胁[3]。因此,探究乳腺癌的发生、发展机制,寻找新治疗靶点具有潜在价值。
长链非编码RNA(long non-coding RNA,lncRNA)属于非编码RNA,长度>200个核苷酸,与乳腺癌等多种肿瘤的发生、发展密切相关[4-5]。组织分化诱导非蛋白编码RNA(tissue differentiation inducing non-protein coding RNA,TINCR)属于非典型lncRNA,是体细胞组织分化及肿瘤发生、发展所需的关键lncRNA[6]。microRNA-544a(miR-544a)在肿瘤侵袭、转移中发挥重要作用[7]。F-box/FBXW7是一种经典的抑癌基因,介导多种重要癌蛋白的泛素化降解,其基因表达缺失会导致原癌基因激活[8]。目前,lncRNA TINCR对乳腺癌的影响尚缺少研究。本实验通过研究过表达lncRNA TINCR靶向miR-544a/FBXW7对人乳腺癌MCF7细胞增殖、侵袭等生物学行为的影响,为寻找乳腺癌新治疗新靶点提供参考。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂人乳腺癌MCF7细胞株、胎牛血清、DMEM培养基、蛋白提取试剂盒、BCA蛋白检测试剂盒、FBXW7抗体、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、β-actin抗体(货号:SCC-111011-1、S9030、90113、BC3640、PT0001、K004271P、K000323P、K001437M、K001435M、M1000170)购自上海恒斐生物科技有限公司,Lipofectamine 2000转染试剂(货号:11668030)购自美国Life Technologies公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRTPCR)试剂盒(货号:DEM202-50T)购自北京拜尔迪生物技术有限公司,CCK-8试剂、Annexin VFITC/PI凋亡试剂盒、羊抗兔IgG抗体(货号:QN1293-OIR、WK304、BTN131149)购自北京百奥莱博科技有限公司,MatrigelTM基质胶(货号:354234)购自广州威佳科技有限公司,pcDNA3.1空载体、化学发光试剂盒(货号:ZY790-20、ZY-11256)购自上海泽叶生物科技有限公司,TINCR、miR-544a、β-actin引物由上海生工生物工程股份有限公司合成。
1.1.2 主要仪器恒温培养箱(型号:MIR-162-PC/MIR-262-PC)购自日本松下公司,全自动酶标仪(型号:ELX800)购自美国BIO-TEK公司,流式细胞仪(型号:BD FACSCantoⅡ)购自美国BD公司,显微镜(型号:CX31)购自日本OLYMPUS公司,化学发光成像系统(型号:ChemiDocXRS)购自美国Bio-Rad公司。
1.2 细胞培养与分组
1.2.1 细胞培养将人乳腺癌MCF7细胞株(上海恒斐生物科技有限公司)放置于37℃、5% CO2培养箱内,在含10%胎牛血清、双抗(青霉素、链霉素各100 u/ml)DMEM培养基中培养,当细胞融合至80%左右时,胰酶消化、传代。
1.2.2 细胞分组取对数期MCF7细胞,按1×105个/ml接种于96孔培养板,于37℃、5%CO2培养箱内培养。使用Lipofectamine 2000转染试剂将pcDNA3.1-TINCR表达载体、pcDNA3.1空载体分别转入到MCF7细胞,分别作为TINCR上调组和TINCR NC组,将未转染的MCF7细胞作为空白对照组。转染24 h后正常培养,置入-80℃冰箱冷冻保存。
1.3 qRT-PCR检测MCF7细胞TINCR、miR-544a相对表达量
空白对照组、TINCR NC组及TINCR上调组MCF7细胞培养24 h后提取总RNA,逆转录成cDNA,β-actin为内参基因。反应条件:95℃预变性15 min;95℃变性30 s,63℃退火30 s,72℃延伸40 s,共计45个循环;72℃继续延伸10 min。以2-ΔΔCt法计算相对表达量。引物序列见表1。

表1 qRT-PCR引物序列
1.4 CCK-8法检测MCF7细胞增殖情况
空白对照组、TINCR NC组及TINCR上调组MCF7细胞培养48 h,加入CCK-8试剂,培养2 h。采用全自动酶标仪检测450 nm处的光密度值(optical density,OD)。
1.5 流式细胞术检测MCF7细胞凋亡情况
空白对照组、TINCR NC组及TINCR上调组MCF7细胞培养48 h,PBS洗涤后使用400 μl 1×结合缓冲液制备细胞悬浮液,并调整细胞浓度为1×106个/ml,加入5 μl Annexin V-FITC;15 min后加入10 μl PI孵育1 h,流式细胞仪测定细胞凋亡率。
1.6 Transwell法检测MCF7细胞侵袭情况
使用50 μl Matrigel基质胶(1∶8稀释)铺Transwell小室的微孔膜,用无血清培养液将空白对照组、TINCR NC组及TINCR上调组MCF7细胞稀释至2.5×105个/ml,在Transwell小室上层加200 μl,下室加500 μl含10%胎牛血清的培养液,37℃、5% CO2条件下孵育24 h,擦去膜上细胞,用4%多聚甲醛固定已经穿膜并黏附在微孔膜外表面的细胞10 min,PBS洗涤,0.5%结晶紫染色20 min。在200倍镜的显微镜下随机选取6个视野,统计穿膜细胞数,并计算平均值。
1.7 Western blotting检测MCF7细胞FBXW7、PCNA、Bax、MMP-2蛋白相对表达量
空白对照组、TINCR NC组及TINCR上调组MCF7细胞培养48 h,收集细胞,提取各组细胞总蛋白并定量。电泳分离、转膜、封闭,加FBXW7、PCNA、Bax、MMP-2、β-actin抗体(1∶500)孵育过夜,TBST洗涤,加羊抗兔IgG二抗(1∶1 000,辣根过氧化物酶标记)室温孵育1 h,发光法显色,拍摄图像,分析条带灰度值,以目的蛋白灰度值/β-actin灰度值表示目的蛋白相对表达量。
1.8 回复实验
取TINCR上调组MCF7细胞,按1×105个/ml的密度接种于96孔培养板,于37℃、5% CO2培养箱内培养。使用Lipofectamine 2000转染试剂分别将miR-544a NC、miR-544a mimic转入MCF7细胞,其分别作为miR-544a NC组和miR-544a上调组。转染24 h后正常培养,qRT-PCR检测miR-544a相对表达量验证转染效率,CCK-8法检测MCF7细胞增殖,Transwell法检测MCF7细胞侵袭,Western blotting检测MCF7细胞FBXW7蛋白相对表达量,具体步骤参照1.3、1.4、1.6和1.7。
1.9 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用SNK-q法,P<0.05为差异有统计学意义。
2 结果
2.1 各组MCF7细胞lncRNA TINCR、miR-544a相对表达量
空白对照组、TINCR NC组、TINCR上调组MCF7细胞lncRNA TINCR、miR-544a相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:空白对照组与TINCR NC组比较,差异无统计学意义(P>0.05);与空白对照组和TINCR NC组相比,TINCR上调组MCF7细胞lncRNA TINCR相对表达量升高(P<0.05),miR-544a相对表达量降低(P<0.05)。见表2。
表2 各组MCF7细胞lncRNA TINCR、miR-544a相对表达量比较(±s)
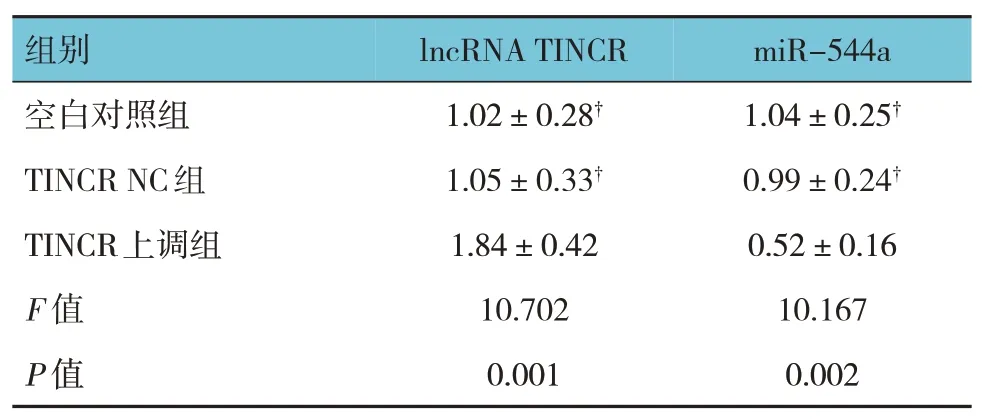
表2 各组MCF7细胞lncRNA TINCR、miR-544a相对表达量比较(±s)
注:†与TINCR上调组比较,P<0.05。
组别miR-544a lncRNA TINCR空白对照组TINCR NC组TINCR上调组F值P值1.04±0.25†0.99±0.24†0.52±0.16 10.167 0.002 1.02±0.28†1.05±0.33†1.84±0.42 10.702 0.001
2.2 各组MCF7细胞增殖情况
空白对照组、TINCR NC组、TINCR上调组MCF7细胞OD值分别为(0.69±0.18)、(0.78±0.22)和(0.35±0.09),经方差分析,差异有统计学意义(F=10.414,P=0.001)。进一步两两比较结果:空白对照组与TINCR NC组比较,差异无统计学意义(P>0.05);与空白对照组和TINCR NC组相比,TINCR上调组MCF7细胞OD值降低(P<0.05)。
2.3 各组MCF7细胞凋亡情况
空白对照组、TINCR NC组、TINCR上调组MCF7细胞凋亡率分别为(11.17±2.04)%、(10.65±1.88)%和(46.82±8.79)%,经方差分析,差异有统计学意义(F=91.083,P=0.000)。进一步两两比较结果:空白对照组与TINCR NC组比较,差异无统计学意义(P>0.05);与空白对照组和TINCR NC组相比,TINCR上调组MCF7细胞凋亡率升高(P<0.05)。见图1。
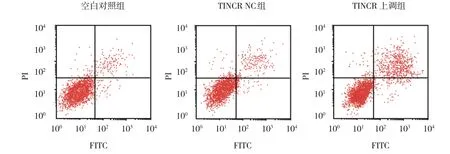
图1 各组MCF7细胞流式细胞图
2.4 各组MCF7细胞侵袭情况
空白对照组、TINCR NC组、TINCR上调组MCF7细胞穿膜细胞数分别为(224.25±28.65)个、(206.76±23.92)个和(146.92±17.55)个,经方差分析,差异有统计学意义(F=17.402,P=0.000)。进一步两两比较结果:空白对照组与TINCR NC组比较,差异无统计学意义(P>0.05);与空白对照组和TINCR NC组相比,TINCR上调组MCF7细胞穿膜细胞数降低(P<0.05)。见图2。
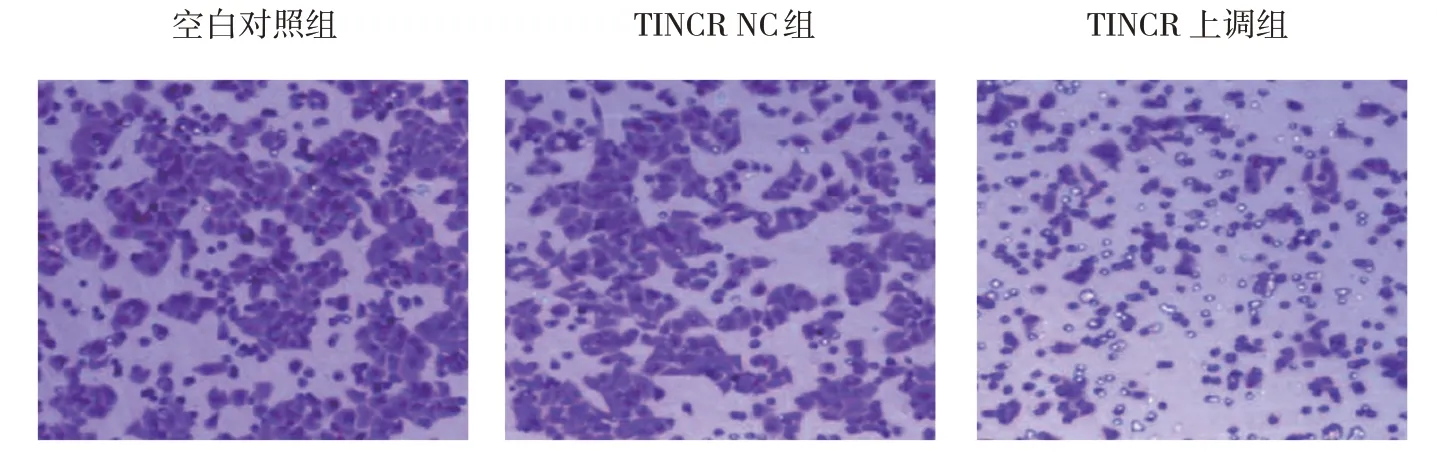
图2 空白对照组、TINCR NC组、TINCR上调组MCF7细胞侵袭情况(×100)
2.5 各组MCF7细胞FBXW7、PCNA、Bax、MMP-2蛋白相对表达量
空白对照组、TINCR NC组、TINCR上调组MCF7细胞FBXW7、PCNA、Bax、MMP-2蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较结果:空白对照组与TINCR NC组比较,差异无统计学意义(P>0.05);与空白对照组和TINCR NC组相比,TINCR上调组MCF7细胞FBXW7、Bax蛋白相对表达量升高(P<0.05),PCNA、MMP-2蛋白相对表达量降低(P<0.05)。见表3和图3。
表3 各组MCF7细胞FBXW7、PCNA、Bax、MMP-2蛋白相对比表达量比较(±s)
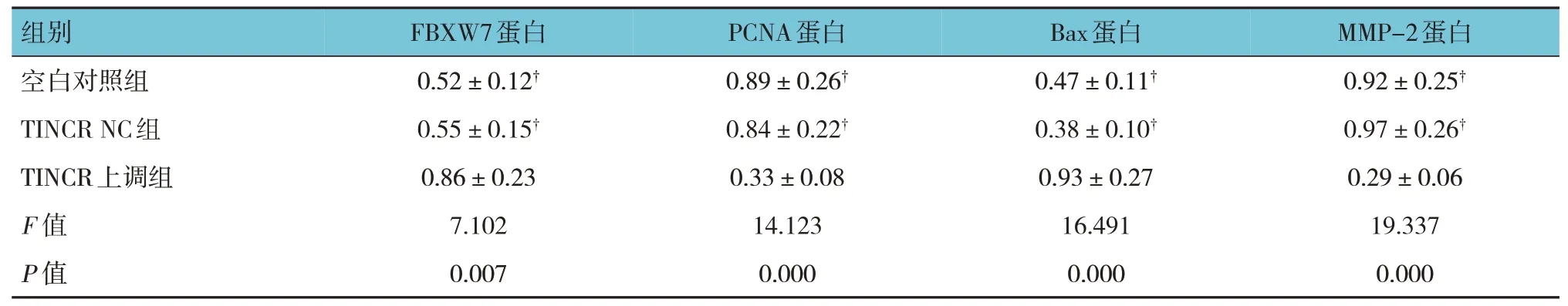
表3 各组MCF7细胞FBXW7、PCNA、Bax、MMP-2蛋白相对比表达量比较(±s)
注:†与TINCR上调组比较,P<0.05。
组别MMP-2蛋白PCNA蛋白Bax蛋白FBXW7蛋白空白对照组TINCR NC组TINCR上调组F值P值0.92±0.25†0.97±0.26†0.29±0.06 19.337 0.000 0.89±0.26†0.84±0.22†0.33±0.08 14.123 0.000 0.47±0.11†0.38±0.10†0.93±0.27 16.491 0.000 0.52±0.12†0.55±0.15†0.86±0.23 7.102 0.007
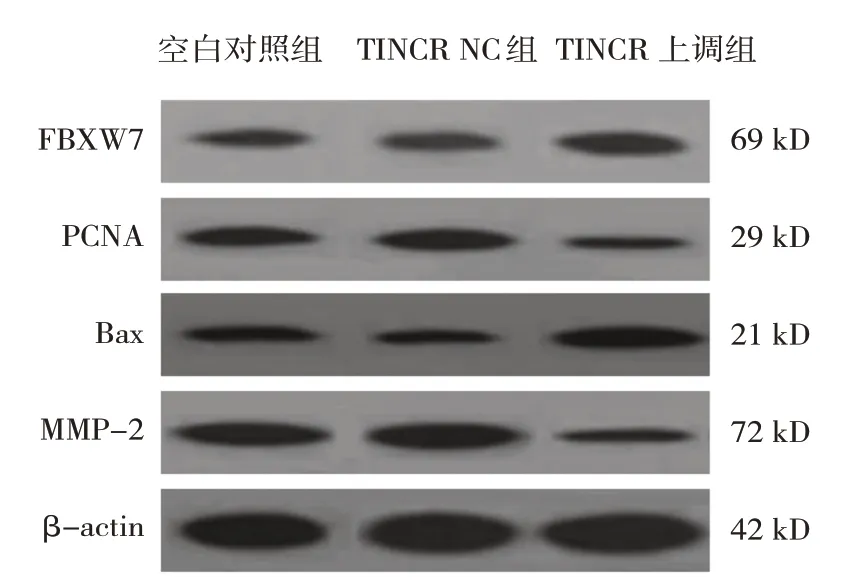
图3 各组MCF7细胞FBXW7、PCNA、Bax、MMP-2蛋白的表达
2.6 lncRNA TINCR通过靶向miR-544a影响MCF7细胞增殖、侵袭及FBXW7蛋白的表达
TINCR上调组、miR-544a NC组、miR-544a上调组MCF7细胞OD值、侵袭细胞数及miR-544a、FBXW7蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:TINCR上调组与miR-544a NC组比较,差异无统计学意义(P>0.05);与TINCR上调组和miR-544a NC组比较,miR-544a上调组MCF7细胞OD值、侵袭细胞数及miR-544a相对表达量升高(P<0.05),FBXW7蛋白相对表达量降低(P<0.05),见表4和图4、5。
表4 各组MCF7细胞OD值、侵袭细胞数及miR-544a、FBXW7蛋白相对表达量比较(±s)

表4 各组MCF7细胞OD值、侵袭细胞数及miR-544a、FBXW7蛋白相对表达量比较(±s)
注:†与TINCR上调组比较,P<0.05。
组别FBXW7蛋白OD值侵袭细胞数/个miR-544a TINCR上调组miR-544a NC组miR-544a上调组F值P值0.83±0.08†0.79±0.08†0.43±0.07 49.356 0.000 0.34±0.07†0.36±0.07†0.62±0.08 27.111 0.000 160.66±15.27†153.84±15.83†212.93±18.40 22.875 0.000 1.01±0.09†1.02±0.08†1.85±0.10 170.767 0.000
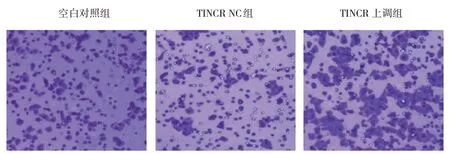
图4 TINCR上调组、miR-544a NC组、miR-544a上调组MCF7细胞侵袭情况(×100)

图5 各组MCF7细胞FBXW7蛋白的表达
3 讨论
乳腺癌在女性肿瘤中排行第1位,具有发病率高、恶性程度高、易产生耐药性及预后差等特点[9]。临床上治疗乳腺癌多采用手术、放射治疗,但容易引起并发症,影响患者生存质量[10]。目前乳腺癌发病机制尚未统一,临床上缺少治疗该病的有效靶向手段。但近年来,越来越多的研究表明乳腺癌的发生、发展与癌细胞增殖、侵袭能力有关[11]。
lncRNA是一类长度>200个核苷酸的RNA,不具有开放阅读框及蛋白质编码功能[12]。近年来研究发现,lncRNA广泛参与机体各种生理病理过程,并作为抑癌或致癌基因在癌细胞增殖、迁移过程中发挥调节作用[13-14]。lncRNA TINCR在人类分化成熟的皮肤组织中异常表达,且lncRNA TINCR可作为致癌基因或抑癌基因,参与多种肿瘤的增殖、侵袭等过程。ZHANG等[15]研究发现,lncRNA TINCR是潜在的致癌基因,上调其表达对食管鳞状癌细胞增殖、迁移、侵袭过程具有促进作用。HU等[16]研究发现,lncRNA TINCR高表达可促进肝癌细胞的浸润和转移。ZHANG等[17]研究发现,TINCR是潜在的抑癌基因,下调其表达对结直肠癌细胞增殖、转移过程具有促进作用。但TINCR在乳腺癌中发挥的作用尚不清楚。
LIU等[18]研究表明,lncRNA TINCR是一种相互竞争的内源性RNA,可通过miR-544a将其从靶基因FBXW7中分离出来,其在肺癌中发挥抑制增殖、侵袭的作用。有研究发现,过表达miR-544a能促进乳腺癌细胞发生迁移和侵袭。FBXW7在许多癌症中发挥抑癌作用[19]。GAO等[20]研究发现,肿瘤抑制因子FBXW7可以通过促进MTDH蛋白水解来抑制乳腺癌细胞的增殖,并诱导细胞凋亡。而本研究中上调TINCR表达后,发现MCF7细胞OD值、穿膜细胞数降低,凋亡率升高,提示lncRNA TINCR对乳腺癌MCF7细胞增殖、侵袭过程具有抑制作用,且TINCR可诱导MCF7细胞凋亡。为探究TINCR对MCF7细胞的影响是否与miR-544a、FBXW7有关,本研究进一步检测miR-544a、FBXW7蛋白相对表达量。结果表明,上调TINCR表达后,MCF7细胞miR-544a相对表达量降低,FBXW7蛋白相对表达量升高,而在上调TINCR的同时上调miR-544a表达后,FBXW7蛋白相对表达量降低,同时细胞OD值、侵袭细胞数升高,提示过表达lncRNA TINCR可能是通过抑制乳腺癌MCF7细胞miR-544a表达,进而促进FBXW7表达,发挥对乳腺癌MCF7细胞增殖、侵袭的抑制作用,以及对凋亡的促进作用。进一步推测,TINCR影响MCF7细胞的机制与在肺癌类似[18],可能通过抑制miR-544a与FBXW7结合,发挥FBXW7对乳腺癌MCF7细胞的抑制增殖、侵袭及促进细胞凋亡作用。
PCNA、Bax、MMP-2分别为参与细胞增殖、凋亡、侵袭过程的常见蛋白,在乳腺癌细胞中亦发挥作用[21-23]。本研究结果表明,与空白对照组和TINCR NC组相比,TINCR上调组MCF7细胞PCNA、MMP-2蛋白相对表达量降低,Bax蛋白相对表达量升高,提示过表达lncRNA TINCR可抑制乳腺癌MCF7细胞PCNA、MMP-2表达,并促进Bax表达,从而抑制乳腺癌MCF7细胞增殖、侵袭,诱导凋亡,推测lncRNA TINCR靶向miR-544a/FBXW7抑制乳腺癌MCF7细胞增殖、侵袭及促进凋亡过程可能是通过调控PCNA、Bax、MMP-2表达来实现的。
综上所述,lncRNA TINCR可能通过靶向miR-544a/FBXW7,抑制人乳腺癌细胞的增殖、侵袭,并促进人乳腺癌细胞凋亡。但乳腺癌发生、发展途径复杂,lncRNA TINCR涉及的其他细胞内信号通路及其在不同乳腺癌细胞中的作用还需进一步探究,以期更全面地评价lncRNA TINCR对乳腺癌的影响,为临床治疗乳腺癌提供新的思路。

