灵芝多糖对阿霉素所致心肌损伤的作用及机制研究*
徐繁,李潇,肖旭,姜海军,李青山,张圣林,张立广
(承德医学院附属医院1.肿瘤科,2.放射科,3.临床药学部,4.血管疝外科,河北 承德067000)
阿霉素(又称多柔比星)是一线抗肿瘤化疗药物,但对心脏有毒性作用,限制其临床应用[1]。研究证实,多柔比星与心脏组织的高亲和力可导致剂量依赖的不可逆转的心肌损害和慢性心力衰竭[2]。右雷佐生是被美国食品药品监督管理局(FDA)批准唯一的临床应用的心脏保护剂,需要通过静脉注射给药,且该药物尚未在国内批准上市。我国临床中应用右丙亚胺,辅酶Q10,维生素C、E等预防阿霉素所致心脏损伤,但效果欠佳。目前,还没有公认有效的抗阿霉素心脏毒性的口服药物,寻找一个方便有效的药物对抗其心脏毒性具有临床意义。
灵芝多糖是灵芝的主要活性成分,具有广泛的药理活性,具有抗氧化、抗癌等保健作用[3]。本研究观察灵芝多糖对阿霉素诱导后大鼠血清及各组织中抗氧化指标的影响,为探讨其抗氧化作用提供依据。灵芝多糖还具有很强的抗炎作用[4]。阿霉素致心肌损伤的机制可能与促炎症细胞因子的产生有关。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)及白细胞介素-10(Interleukin-10,IL-10)是常见的细胞因子,本研究拟通过动物实验和体外实验探讨灵芝多糖对阿霉素所致心脏毒性的作用。
1 材料与方法
1.1 药物及试剂
盐酸阿霉素注射液、灵芝多糖(纯度99%)、DMEM完全培养基、胎牛血清、CCK-8、过氧化氢酶(CAT)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱苷肽(GSH)试剂盒、TNF-α、IL-6及IL-10酶联免疫吸附试验(ELISA)试剂盒均购于北京康泰合元生物技术有限公司,乳酸脱氢酶(LDH)试剂盒、肌酸激酶(CK)试剂盒、天门冬氨酸氨基转移酶(AST)试剂盒均由承德医学院附属医院检验科提供。
1.2 动物分组及模型复制
75只雄性SD大鼠(体重220~250 g),由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:SCXK京2012-0001。将大鼠随机分为对照组、灵芝多糖高剂量组、阿霉素组、灵芝多糖低剂量+阿霉素组及灵芝多糖高剂量+阿霉素组,每组15只。参考文献[5]的方法复制模型:注射用水5 ml溶解阿霉素,加入0.9%生理盐水,配置为1 ml生理盐水含有阿霉素0.8 mg,避光低温存放备用。阿霉素组、灵芝多糖低剂量+阿霉素组和灵芝多糖高剂量+阿霉素组从实验第2天开始以2.5 mg/kg腹腔注射阿霉素,隔天1次,共6次;对照组和灵芝多糖高剂量组同时注射等剂量生理盐水。对照组和阿霉素组从实验第1天起以4 ml/d生理盐水灌胃,连续16 d;灵芝多糖高剂量组和灵芝多糖高剂量+阿霉素组从实验第1天起以100 mg/kg的灵芝多糖溶于4 ml生理盐水中灌胃,连续16 d;灵芝多糖低剂量+阿霉素组从实验第1天起以50 mg/kg的灵芝多糖溶于4 ml生理盐水中灌胃,连续16 d。末次灌胃后10 d,处死大鼠,腹主动脉取血,检测AST、LDH、CK水平。称大鼠体重;解剖取心脏并测量重量,心脏重量指数=心脏重量/体重;将大鼠心脏置于4%多聚甲醛中固定48 h后脱水、透明、浸石蜡,包埋,HE染色,观察心肌组织病理学变化。取心肌组织200 mg,在含50 mmol/L Tris-HCl缓冲液(pH 7.4),150 mmol/L NaCl,5 mmol/L EDTA,1 mmol/L二硫苏糖醇,1%Triton X-100和1%蛋白酶抑制剂的裂解液中匀浆。将匀浆物离心15 min,取上清液,按试剂盒按说明书测定SOD(TBA法)、CAT(钼酸铵法)、GSH(比色法)活性。
1.3 大鼠H9C2心肌细胞培养及分组处理
将大鼠H9C2心肌细胞(由中国科学院细胞库提供)接种于96孔板,每孔细胞量约为1×104个,随机分为对照组(只加培养基)、灵芝多糖高剂量组(100 μg/ml)、阿霉素组(1 μmol)、灵芝多糖低剂量(50 μg/ml)+阿霉素组(1 μmol)、灵芝多糖高剂量(100 μg/ml)+阿霉素组(1 μmol)。灵芝多糖预处理8 h后再与阿霉素共培养24 h,反复漂洗,收集各组细胞,用CCK-8法在波长450 nm处测定光密度(OD)值。细胞存活率(%)=(给药组OD值/对照组OD值)×100%。将收集的细胞离心,1 000 r/min,离心5 min,取离心后的细胞上清液,按试剂盒说明书测定SOD(TBA法)、CAT(钼酸铵法)、GSH(比色法)活性。
1.4 TNF-α、IL-6及IL-10检测
将心脏组织及大鼠H9C2心肌细胞按ELISA试剂盒说明书操作,加入终止液的5~30 min内均在450 nm处检测OD值,根据标准曲线计算TNF-α、IL-6、IL-10的质量浓度。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠的一般情况
对照组及灵芝多糖高剂量组大鼠在整个实验过程中均表现正常,精神状态佳,较活跃,体重增加,皮肤色泽红润,皮下脂肪增厚,饮食、饮水量正常,大小便无异常,对外界灯光、声响等刺激能保持高度警惕。其余3组大鼠在给予阿霉素后出现不同程度的中毒症状,表现为精神差,饮食、饮水量减少,体重下降,呕吐,毛发稀疏、脱落,喜蜷曲,活动少,对外界刺激反应迟缓。严重程度:阿霉素组>灵芝多糖低剂量+阿霉素组>灵芝多糖高剂量+阿霉素组。最终阿霉素组3只大鼠死亡,灵芝多糖低剂量+阿霉素组1只大鼠死亡。
2.2 阿霉素对大鼠心功能的影响
5组大鼠心脏重量指数及心肌酶各项指标比较,差异有统计学意义(P<0.05)。进一步两两比较结果:灵芝多糖高剂量组与对照组比较,差异无统计学意义(P>0.05);阿霉素组与对照组比较,心肌酶各项指标均上升(P<0.05),心脏重量指数降低(P<0.05);灵芝多糖低剂量+阿霉素组、灵芝多糖高剂量+阿霉素组与阿霉素组比较,心肌酶各项指标均下降(P<0.05),心脏重量指数增加(P<0.05)。见表1。
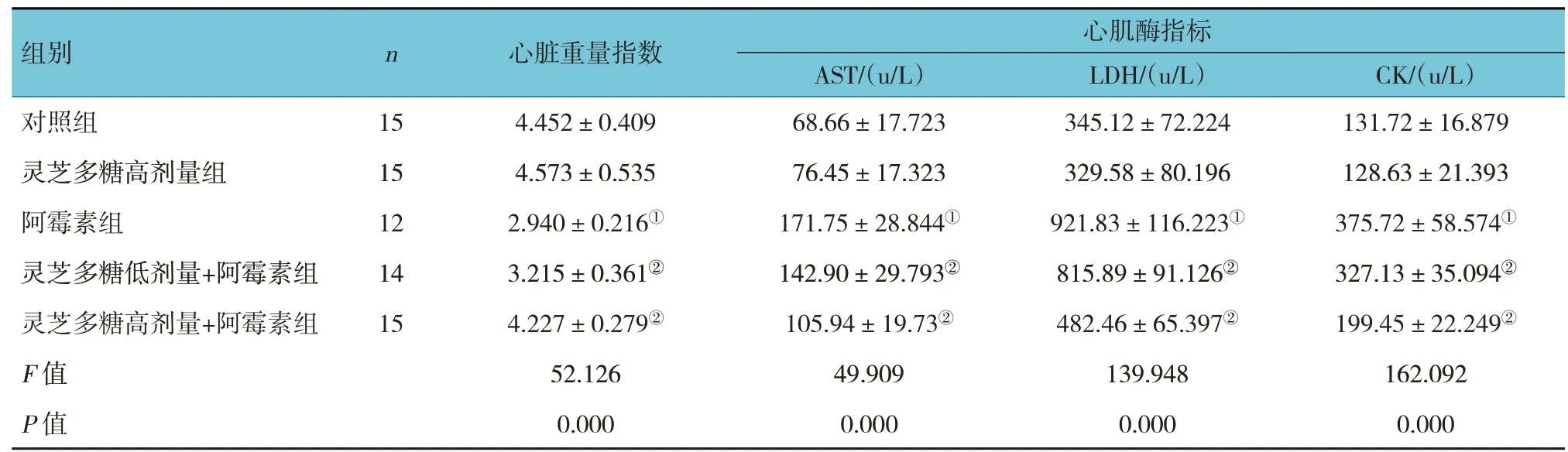
表1 5组大鼠心脏重量指数及心肌酶各指标比较(xˉ±s)
2.3 灵芝多糖对阿霉素诱导后大鼠心肌组织结构的影响
5组大鼠心肌组织的免疫组织化学HE染色结果见图1。对照组及灵芝多糖高剂量组:心肌细胞无变性坏死,心肌纤维排列整齐,横纹清晰,未见炎症细胞浸润,组织学正常。阿霉素组:心肌细胞内大量空泡变性,心肌细胞间隙明显增宽,伴大量炎症细胞浸润,提示模型复制成功。灵芝多糖低剂量+阿霉素组:部分心肌细胞内可见空泡变性及炎症细胞浸润。灵芝多糖高剂量+阿霉素组:心肌细胞内少量空泡变性,伴有少量炎症细胞浸润。

图1 5组大鼠的心肌组织结构(HE染色×400)
2.4 灵芝多糖对阿霉素诱导后H9C2心肌细胞存活率的影响
对照组、灵芝多糖高剂量组、阿霉素组、灵芝多糖低剂量+阿霉素组和灵芝多糖高剂量+阿霉素组H9C2心肌细胞的存活率分别为(100.169±4.071)%、(102.965±5.277)%、(44.610±6.238)%、(51.209±7.791)%及(78.241±7.213)%,经方差分析,差异有统计学意义(F=278.411,P=0.000);进一步两两比较结果:灵芝多糖高剂量组与对照组比较,差异无统计学意义(P>0.05);阿霉素组较对照组降低(P<0.05);灵芝多糖低剂量+阿霉素组较阿霉素组升高(P<0.05);灵芝多糖高剂量+阿霉素组较阿霉素组升高(P<0.05)。
2.5 灵芝多糖对阿霉素诱导后心肌组织及心肌细胞中抗氧化酶水平的影响
5组大鼠心肌组织及心肌细胞SOD、GSH、CAT水平比较,差异有统计学意义(P<0.05);进一步两两比较结果:灵芝多糖高剂量组与对照组比较差异无统计学意义(P>0.05);阿霉素组SOD、GSH、CAT水平较对照组降低(P<0.05);灵芝多糖低剂量+阿霉素组和灵芝多糖高剂量+阿霉素组的SOD、GSH、CAT水平较阿霉素组升高,且呈一定的剂量依赖性(P<0.05)。见表2、3。
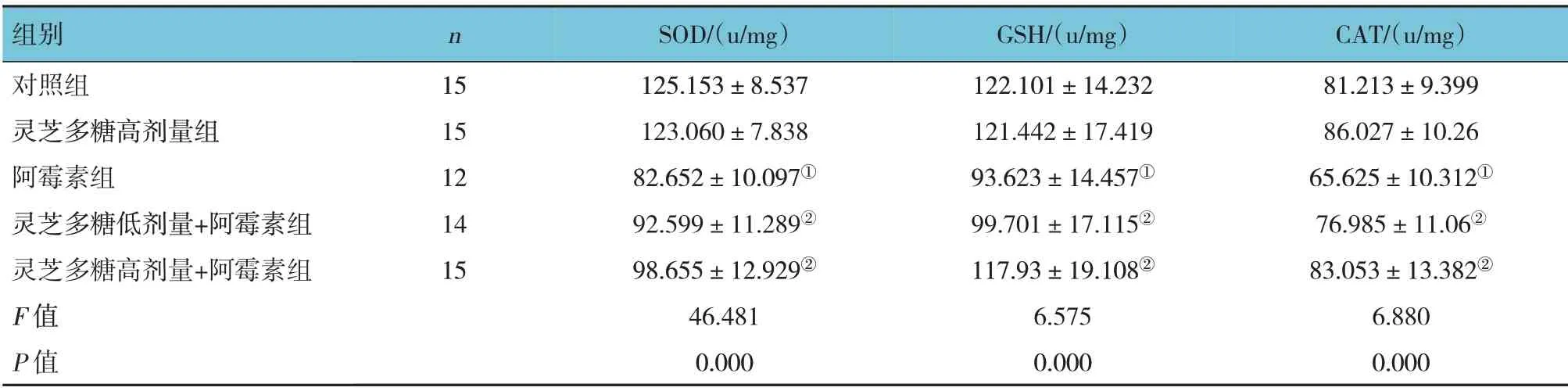
表2 5组大鼠心肌组织中抗氧化酶水平的比较(xˉ±s)
2.6 灵芝多糖对阿霉素诱导后心肌组织及心肌细胞中炎症因子水平的影响
5组大鼠心肌组织及心肌细胞中的炎症因子TNF-α、IL-6、IL-10水平比较,差异有统计学意义(P<0.05);进一步两两比较结果:灵芝多糖高剂量组与对照组比较差异无统计学意义(P>0.05);阿霉素组与对照组比较,TNF-α、IL-6升高(P<0.05)、IL-10下降(P<0.05);灵芝多糖低剂量+阿霉素组、灵芝多糖高剂量+阿霉素组与阿霉素组比较,TNF-α、IL-6下降(P<0.05)、IL-10升高(P<0.05)。见表4、5。
表3 各组大鼠H9C2心肌细胞中抗氧化酶水平的比较(±s)
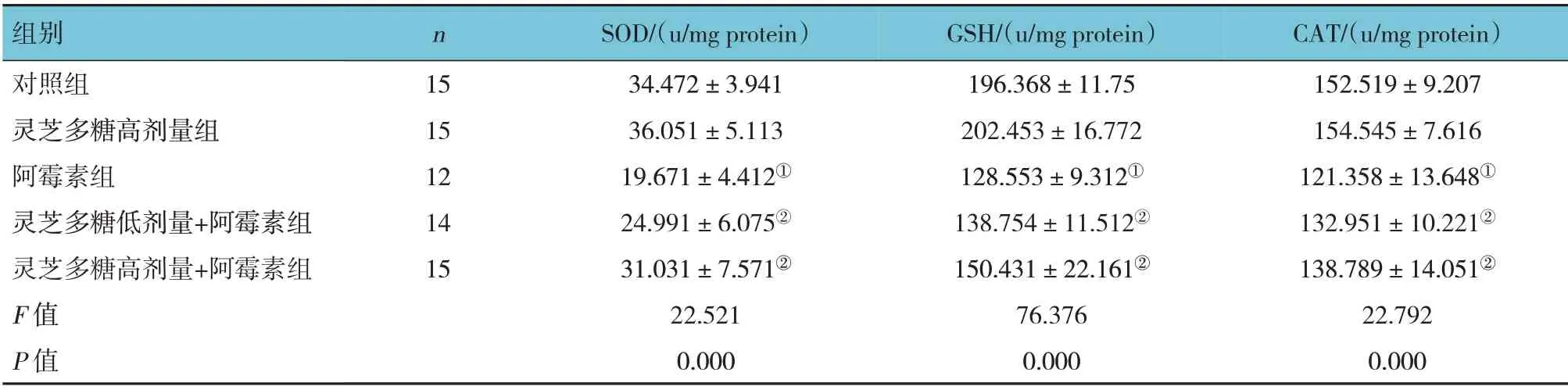
表3 各组大鼠H9C2心肌细胞中抗氧化酶水平的比较(±s)
注:①与对照组比较,P<0.05;②与阿霉素组比较,P<0.05。
组别对照组灵芝多糖高剂量组阿霉素组灵芝多糖低剂量+阿霉素组灵芝多糖高剂量+阿霉素组F值P值CAT/(u/mg protein)152.519±9.207 154.545±7.616 121.358±13.648①132.951±10.221②138.789±14.051②22.792 0.000 n 15 15 12 14 15 SOD/(u/mg protein)34.472±3.941 36.051±5.113 19.671±4.412①24.991±6.075②31.031±7.571②22.521 0.000 GSH/(u/mg protein)196.368±11.75 202.453±16.772 128.553±9.312①138.754±11.512②150.431±22.161②76.376 0.000
表4 5组大鼠心肌组织中炎症因子水平的比较(pg/ml,±s)
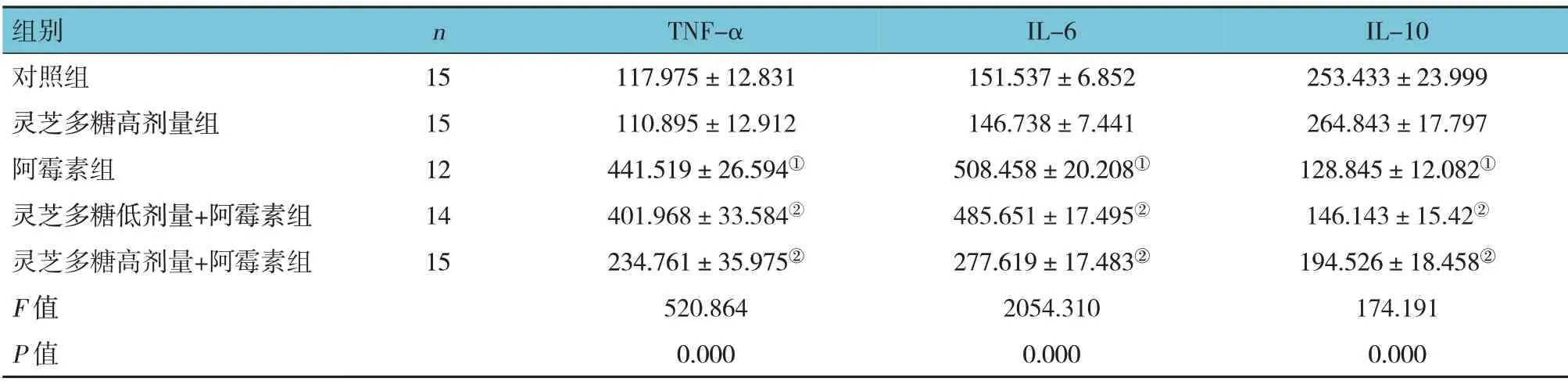
表4 5组大鼠心肌组织中炎症因子水平的比较(pg/ml,±s)
注:①与对照组比较,P<0.05;②与阿霉素组比较,P<0.05。
组别对照组灵芝多糖高剂量组阿霉素组灵芝多糖低剂量+阿霉素组灵芝多糖高剂量+阿霉素组F值P值IL-10 253.433±23.999 264.843±17.797 128.845±12.082①146.143±15.42②194.526±18.458②174.191 0.000 n 15 15 12 14 15 TNF-α 117.975±12.831 110.895±12.912 441.519±26.594①401.968±33.584②234.761±35.975②520.864 0.000 IL-6 151.537±6.852 146.738±7.441 508.458±20.208①485.651±17.495②277.619±17.483②2054.310 0.000
表5 5组大鼠H9C2心肌细胞中炎症因子水平的比较(pg/ml,±s)
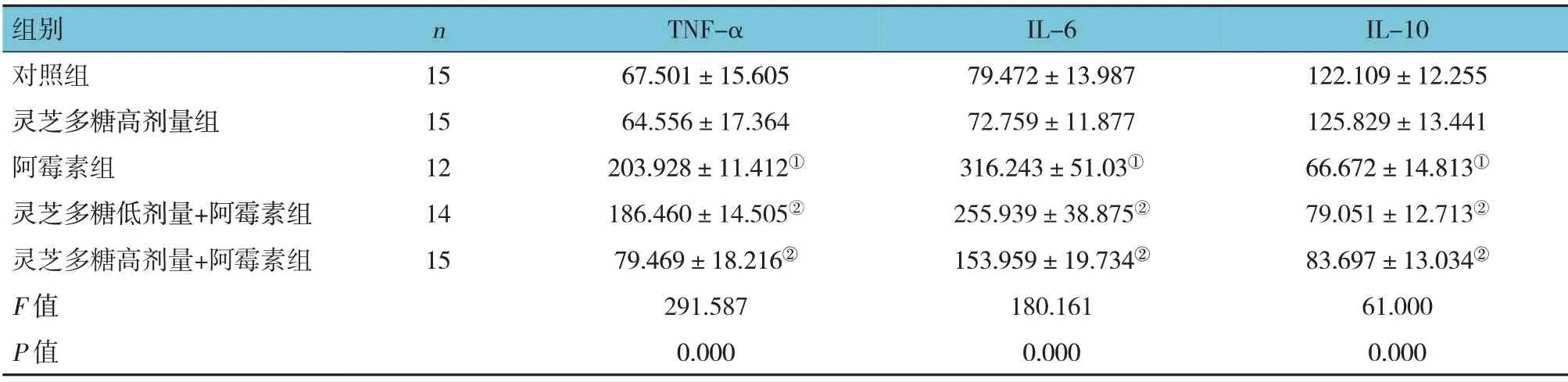
表5 5组大鼠H9C2心肌细胞中炎症因子水平的比较(pg/ml,±s)
注:①与对照组比较,P<0.05;②与阿霉素组比较,P<0.05。
组别对照组灵芝多糖高剂量组阿霉素组灵芝多糖低剂量+阿霉素组灵芝多糖高剂量+阿霉素组F值P值IL-10 122.109±12.255 125.829±13.441 66.672±14.813①79.051±12.713②83.697±13.034②61.000 0.000 n 15 15 12 14 15 TNF-α 67.501±15.605 64.556±17.364 203.928±11.412①186.460±14.505②79.469±18.216②291.587 0.000 IL-6 79.472±13.987 72.759±11.877 316.243±51.03①255.939±38.875②153.959±19.734②180.161 0.000
3 讨论
临床常用的蒽环类药物是一种抗肿瘤抗生素,代表药物为表柔比星、多柔比星、吡柔比星,该类药物可抑制RNA和DNA的合成,广泛应用于实体瘤及血液系统疾病的治疗,主要毒副反应为骨髓抑制、脱发、心脏毒性,如果为了减少心脏毒性而减少阿霉素(多柔比星)的用量,将严重降低对癌症的治疗效果[6]。
目前血清心肌酶指标活力的测定已广泛用于诊断和研究心肌损害性疾病,其中AST、LDH、CK较为特异性地反映心肌细胞的损伤。本研究发现阿霉素可导致大鼠AST、LDH、CK水平升高、心肌组织学结构改变,但经过灵芝多糖处理后的大鼠心肌酶指标水平降低,证实灵芝多糖具有保护心肌作用。
GSH可以把体内有害物质转变成无害物质排出体外,是生物体内重要的活性氧自由基清除剂[7];SOD属于一种源于生命体的重要活性成分,可消除有害物质,维持良好的新陈代谢状态,其水平降低意味着机体抗氧化损伤能力的减弱[8],是体内抗氧化系统的第一道防线。CAT可以清除体内的过氧化氢,是体内抗氧化的关键酶之一[9]。本研究的体内、体外实验均证实经阿霉素处理后的心肌组织及大鼠H9C2心肌细胞的SOD、GSH及CAT活性受抑制,提示阿霉素损伤心肌的机制可能为氧化应激,而经灵芝多糖预处理后SOD、GSH及CAT活性均有一定的提高,说明灵芝多糖可以清除体内部分氧自由基,起到抗氧化作用。
TNF-α、IL-6及IL-10是心肌损伤预后的主要指标[10]。TNF-α可引起组织损伤并调节免疫反应[11],在凋亡途径发挥重要作用。IL-6主要参与炎症反应、调节免疫应答和自身免疫病[12]。IL-10通过多种途径发挥抗炎作用,可通过抑制NF-κB的活化,抑制炎症细胞因子及趋化因子的表达;另外IL-10可抑制多种淋巴细胞的活化,从而减少TNF-α、IL-6的生成[13]。本研究中,阿霉素处理后的大鼠心肌组织及大鼠H9C2心肌细胞TNF-α和IL-6质量浓度升高,提示阿霉素可诱导促炎症细胞因子的产生;灵芝多糖预处理后的大鼠心肌组织及大鼠H9C2心肌细胞中TNF-α、IL-6表达下降、IL-10升高。本研究的体内与体外实验得到相同的结果,灵芝多糖能够抑制TNF-α、IL-6等炎症因子的生成,增加抗炎症因子产生,起保护心肌的作用。
本研究通过体内及体外实验证实灵芝多糖可清除体内氧自由基及减少促炎因子产生,从而对抗阿霉素对心肌的损伤,为临床研究提供理论依据。

