药物基因多态性检测在脑梗死患者抗血小板治疗中的应用*
刘少波,黄灿,钟婉平,刘莹,周婷
(东莞东华医院1.药学部,2.神经内科,广东 东莞523110)
脑梗死又称缺血性卒中,是由于局部脑组织血液供应障碍,引起脑组织缺血、缺氧性坏死;根据发病机制不同可分为脑血栓、脑栓塞和腔隙性脑梗死等[1-2]。近年来,脑梗死发病率逐年上升,是导致我国人口致残、致死的主要疾病之一[3]。氯吡格雷、阿司匹林等抗血小板聚集二级预防药物能有效减慢脑梗死的发生、发展,且氯吡格雷和阿司匹林联合治疗效果优于单药治疗,但其机制尚不明确[4]。目前研究发现,氯吡格雷进入血液后会经细胞色素P450酶代谢转化为活性产物,并与血小板表面受体P2Y12结合,从而起到抗血小板聚集的作用[5-6]。由于外在因素如吸烟、饮酒,或内在因素如代谢酶基因的多态性,部分患者经过氯吡格雷治疗后,血小板聚集功能并未得到抑制,这一现象称为氯吡格雷抵抗[7]。氯吡格雷作为前体药物,在肝脏中须经CYP2C19代谢成活性产物,因此CYP2C19多态性与氯吡格雷抗血小板治疗疗效有关。另据报道,阿司匹林疗效受到阿司匹林抵抗的影响,部分患者服用阿司匹林后血小板抑制效果不佳,出现血栓事件,其原因除与阿司匹林抵抗因素如年龄、性别等有关外,更与相关药物基因多态性有关,如PTGS1、GP1BA[8-10]。因此,本研究旨在通过检测脑梗死患者CYP2C19、PTGS1、GP1BA基因多态性,分析其对抗血小板治疗预后的预测作用。
1 资料与方法
1.1 一般资料
选取2019年1月—2020年3月在东莞东华医院就诊的脑梗死患者298例。其中,男性194例,女性104例;年龄31~89岁,平均(61.63±13.21)岁。本研究经医院医学伦理委员会审批通过,所有患者签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准①经颅脑CT或MRI诊断为脑梗死;②发病时间<24 h;③TOAST分型为大动脉粥样硬化型。
1.2.2 排除标准①氯吡格雷、阿司匹林过敏者;②凝血功能障碍、系统性出血患者;③心、肾、肝功能严重障碍患者;④近2周内有手术史者;⑤有活动性溃疡出血患者;⑥外出血性脑血管疾病患者。
1.3 治疗方法及分组
所有患者给予氯吡格雷联合阿司匹林治疗,连续用药2周。首次用药氯吡格雷300 mg,阿司匹林100 mg,然后氯吡格雷改为75 mg/d,同时联用阿司匹林100 mg/d。2周后,以单药氯吡格雷75 mg/d治疗。治疗14 d后,采用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)对脑梗死患者进行评分;并用改良Rankin量表(modified Rankin scale,mRS)评估患者预后情况。mRS≤2分患者为预后良好组,mRS>2分患者为预后不良组。
1.4 药物基因多态性检测
抽取患者静脉血5 ml,使用氯吡格雷药物代谢基因CYP2C19基因多态性检测试剂盒(济南广音医疗科技有限公司),采用原位杂交荧光染色测序法对CYP2C19*2、CYP2C19*3和CYP2C19*17共3个位点进行多态性的定性检测。使用阿司匹林药物代谢基因检测试剂盒(济南广音医疗科技有限公司)检测PTGS1、GP1BA基因多态性,实验操作均严格按照试剂盒说明书进行。
1.5 统计学方法
数据分析采用SPSS 22.0统计软件。计数资料以率(%)表示,比较用χ2检验;采用Hardy-Weinberg检验等位基因分布的独立性。P<0.05为差异有统计学意义。
2 结果
2.1 基因频率
基因多态性检测结果显示,CYP2C19*2分型:GG 170例(57.05%),GA 87例(29.19%),AA 41例(13.76%),G等位基因频率为71.14%,A等位基因频率为28.86%,差异有统计学意义(χ2=10.865,P=0.004);CYP2C19*3分型:GG 269例(90.27%),GA 29例(9.73%),G等位基因频率为95.13%,A等位基因频率为4.87%,差异有统计学意义(χ2=9.872,P=0.007);CYP2C19*17分型:CC 292例(97.99%),CT 6例(2.01%),C等位基因频率为98.99%,T等位基因频率为1.01%,差异有统计学意义(χ2=10.873,P=0.004);PTGS1基因分型:AA 290例(97.32%),GA 5例(1.68%),GG 3例(1.00%),A等位基因频率为98.15%,G等位基因频率为1.85%,差异有统计学意义(χ2=10.248,P=0.006);GP1BA基因分型:CC 276例(92.62%),CT 22例(7.38%),C等位基因频率为96.31%,T等位基因频率为3.69%,差异有统计学意义(χ2=9.945,P=0.007)。CYP2C19、PTGS1、GP1BA基因均符合Hardy-Weinsberg平衡定律。
2.2 CYP2C19基因型分布
根据CYP2C19不同基因型对氯吡格雷代谢的影响,将脑梗死患者分为快代谢型、中间代谢型以及慢代谢型。脑梗死患者中,快代谢型156例(52.35%),中间代谢型86例(28.86%),慢代谢型56例(18.79%)。见表1。

表1 不同表型患者CYP2C19基因型分布
2.3 阿司匹林药物相关基因型分布
脑梗死患者中,根据PTGS1、GP1BA不同基因型对阿司匹林抵抗的影响,将脑梗死患者分为阿司匹林敏感型、阿司匹林半敏感型、阿司匹林抵抗型。阿司匹林敏感型290例(97.32%),阿司匹林半敏感型5例(1.68%),阿司匹林抵抗型3例(1.00%)。见表2。

表2 不同表型患者阿司匹林药物相关基因型分布
2.4 不同表型患者的疗效比较
mRS评估结果显示,预后良好患者237例(预后良好组),预后不良患者61例(预后不良组)。
预后良好组中,快代谢型140例(59.07%),中间代谢型67例(28.27%),慢代谢型30例(12.66%);预后不良组中,快代谢型16例(26.23%),中间代谢型19例(31.15%),慢代谢型26例(42.62%),经χ2检验,差异有统计学意义(χ2=33.315,P=0.000)。氯吡格雷中间代谢型、慢代谢型比快代谢型更易导致患者预后不良。见表3。
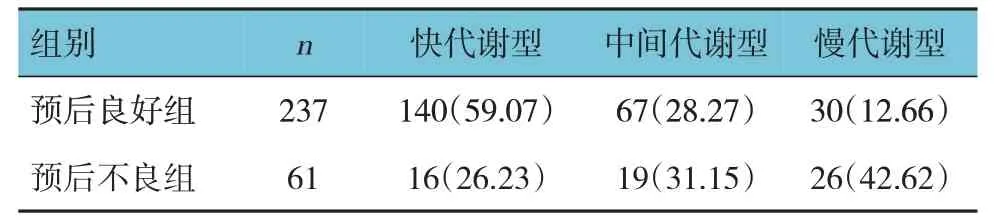
表3 两组患者的不同氯吡格雷表型例(%)
预后良好组中,阿司匹林敏感型234例(98.74%),阿司匹林半敏感型2例(0.84%),阿司匹林抵抗型1例(0.42%);预后不良组中,阿司匹林敏感型56例(91.80%),阿司匹林半敏感型3例(4.92%),阿司匹林抵抗型2例(3.28%),经χ2检验,差异有统计学意义(χ2=6.930,P=0.031)。阿司匹林抵抗与患者预后不良有关。见表4。

表4 两组患者的不同阿司匹林药物表型 例(%)
3 讨论
脑血管疾病是与心脏病、恶性肿瘤并列的世界三大致死疾病,脑梗死作为常见的脑血管疾病,是人们健康的重要威胁[11]。氯吡格雷和阿司匹林常用于脑梗死患者二级预防治疗,以提高疗效,降低复发率,然而氯吡格雷联合阿司匹林用药患者的疗效不尽相同[12-13]。有研究发现,氯吡格雷出现抵抗主要有两方面影响,外在影响因素有患者的生活习惯、药物间相互作用及药物依从性等;内在影响因素则与基因多态性有关[14-15]。阿司匹林抵抗同样与药物代谢及药物作用过程中相关基因的多态性有关。
本研究根据CYP2C19基因多态性检测结果,将表型分为快代谢型、中间代谢型及慢代谢型。在严洁萍等[16]研究表明,快代谢型和中间代谢型患者氯吡格雷抗血小板治疗疗效优于慢代谢型患者。本实验中快代谢型患者在预后良好组中比例高于预后不良组,而预后不良组中间代谢型和慢代谢型患者比例高于预后良好组,说明快代谢型患者的氯吡格雷联合阿司匹林疗效要优于中间代谢型和慢代谢型患者。这一结果可能是由于在快代谢型患者体内,氯吡格雷能够更快地代谢成为活性产物。本研究根据氯吡格雷代谢效率进行分型,验证了CYP2C19基因多态性与脑梗死患者氯吡格雷联合阿司匹林抗血小板治疗的预后密切相关。
阿司匹林主要作用于环氧合酶,抑制其生成血栓素A2,故PTGS1与阿司匹林的药效有关。GP1BA参与血小板膜糖蛋白的合成,其多态性会导致糖蛋白功能和结构异常,从而引起血栓的形成,造成阿司匹林抵抗[17-18]。与单独选取PTGS1或GP1BA基因多态性多个位点进行检测不同,本研究选取PTGS1和GP1BA各一位点基因多态性进行检测,并联合进行阿司匹林抵抗分组,结合基因多态性检测结果及疗效评估,发现阿司匹林敏感型患者氯吡格雷联合阿司匹林治疗效果要优于阿司匹林半敏感型和抵抗型患者,这一结果与CAI等[19]的研究相符,但本研究选择PTGS1、GP1BA基因多态性作为研究对象,与CAI等[19]选择的阿司匹林抵抗相关药物基因不同,为PTGS1、GP1BA基因多态性与阿司匹林抵抗相关研究提供了新的思路。临床使用阿司匹林治疗应考虑阿司匹林药物相关基因多态性对疗效的影响。与阿司匹林药物相关的基因还有PEAR1、ITGB3等,本实验未涉及,有待后续进一步研究。
综上所述,CYP2C19、PTGS1、GP1BA基因多态性对脑梗死患者氯吡格雷联合阿司匹林抗血小板治疗的预后有影响。检测CYP2C19、PTGS1、GP1BA基因多态性对预测脑梗死患者治疗预后具有指导意义。

