源自泡菜的植物乳杆菌产新型广谱抑菌细菌素的特性分析
高兆建,黄亮浩,丁飞鸿,赵宜峰,陈 腾,*
(1.徐州工程学院食品与生物工程学院,江苏 徐州 221018;2.长江桂柳食品睢宁有限公司,江苏 徐州 221000)
近年来,随着社会发展,食品安全问题越来越受到人们的关注。食源性腐败菌及致病菌是导致食品安全事故的重要原因。这些有害微生物导致食品腐败变质、降低食品质量造成经济损失,其有毒代谢物对人体健康造成极大危害[1],特别是某些病原菌,在环境中普遍存在,能适应低温、酸性和高盐的苛刻条件,还能逃避宿主免疫系统[2-3]。这些特性使食品容易受到食源性病原菌的污染,并难以控制。目前,解决食品腐败问题主要依靠化学食品防腐剂,但化学食品防腐剂存在潜在危害,故开发天然生物防腐剂代替化学防腐剂具有重要意义[4]。
乳酸菌是革兰氏阳性菌的一个非分类学类群,它在食品工业中有多种应用,例如用于饮料、肉类、蔬菜、水果和牛奶的发酵[5]。发酵过程中,它能够将糖转化为乳酸,并且有些能够产生抑菌活性代谢物,如过氧化氢、细菌素等[6]。细菌素是由核糖体合成的多肽,能抑制多种耐药的食源性致病菌[7],很多国家在考虑将细菌素用于食品防腐[8]。很多乳酸菌在合适条件下可产生细菌素,且其是正常菌群中存在的对宿主生理有积极影响的非致病性益生菌[9],故从不同材料中分离乳酸菌并进一步寻找新的细菌素成为目前研究的热点。目前,已有从发酵香肠[10]、咸菜[11]、发酵肉[12]、发酵鱼[13]、牛奶产品[14]、啤酒[15]等样品分离到细菌素的报道。但目前应用于商业化生产的细菌素非常有限,开发新型的细菌素对弥补目前商业化使用的Nisin抑菌谱窄的缺陷和防止Nisin耐受菌株的出现具有重要意义。
目前文献报道的乳酸菌细菌素较多,但大多抑菌谱较窄,抑菌范围集中在革兰氏阳性菌、阴性菌或两类都能抑制,但对真核微生物不具有抑菌作用。本研究从中国传统发酵泡菜中筛选出1 株可产生广谱抑菌活性细菌素的植物乳杆菌。为深入研究细菌素特性,通过多种分离方法从发酵液中分离纯化,并确定其抑菌特性,分析细菌素的抑菌效果,旨在为开发一种用于食品防腐的对常见食源性致病菌、腐败菌有广谱抑菌效果的细菌素奠定基础。
1 材料与方法
1.1 材料与试剂
分离产细菌素乳酸菌的泡菜样品购自江苏省徐州市云龙区多处农贸市场;用于检测抑菌活性的参考菌株部分购自中国普通微生物菌种保藏管理中心,部分由徐州工程学院江苏省重点建设实验室保存。
柱层析填充材料DEAE Sepharose Fast Flow、Sephadex G-15 美国Pharmacia公司;胰化蛋白胨、酵母提取物 英国Oxoid公司;细菌基因组DNA提取试剂盒、胶回收试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 宝生物工程(大连)有限公司;蛋白酶K、胃蛋白酶、胰蛋白酶、脂肪酶、α-淀粉酶、β-淀粉酶 上海源叶生物科技有限公司。其他试剂均为国产分析纯。
MRS(Man-Rogosa-Sharpe)培养基用于产细菌素供试菌株培养;LB(Luriae Bertani)培养基用于指示细菌菌株培养;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基用于酵母菌培养。均为实验室配制。
1.2 仪器与设备
GeneAmp 9700 PCR仪 美国应用生物系统公司;JS-680D凝胶成像系统 上海培清科技有限公司;3k15冷冻离心机 德国Sigma公司;UV-2450紫外-可见光分光光度计 日本岛津公司;DYY-6B凝胶水平电泳仪 北京市六一仪器厂;AKTA蛋白纯化系统美国GE Healthcare公司;1260半制备高效液相色谱仪、Zorbax SB-C18高效液相色谱半制备柱(9.4 mm×250 mm,5 μm) 美国安捷伦公司;CascadaTMAN超纯水系统 美国PALL公司。
1.3 方法
1.3.1 产细菌素菌株的筛选鉴定
菌株筛选:适量泡菜汁涂布于含有1% CaCO3的MRS琼脂平板中,在35 ℃培养2~4 d。观察周围是否有透明圈。挑取产生透明圈的112 株菌划线纯化后,过氧化氢酶活性检测为阴性及革兰氏染色为阳性的菌株共82 株,初步认为是乳酸菌株并保存。从初步分离的菌株中筛选产细菌素菌株。以金黄色葡萄球菌为指示菌,琼脂平板打孔扩散法测定产菌素菌株的抑菌活性[16]。初步分离的乳酸菌在MRS培养基中35 ℃发酵24 h,8 000 r/min、4 ℃离心10 min,收集上清液并用0.22 μm滤膜过滤,滤液以4 mol/L NaOH溶液调整至pH 6.0~7.0,80 ℃加热15 min,灭活发酵液中的蛋白酶防止对菌株所产细菌素降解。得到发酵无细胞上清液(cell-free supernatants,CFS),检测得到11 株菌CFS有抑菌活性,再以蛋白酶K处理CFS,有7 株菌抑菌活性受到抑制,挑选1 株抑菌活性较强的菌株深入研究。
菌株形态特征及生理生化特征观察:参照文献[17]方法。
16S rDNA基因扩增测序与系统发育树构建:根据实验室已有的16S rDNA基因通用引物,对分离的产细菌素乳酸菌菌株PCR扩增16S rDNA,扩增产物委托苏州泓迅生物科技股份有限公司测序并通过BLAST在GenBank中进行同源性比较,利用MEGA软件中的Neighbor-Joining构建系统发育树。
1.3.2 菌体生长动力学及细菌素的产生
培养至对数期的种子液按照1%接种量接种于装有100 mL MRS培养基的250 mL锥形瓶中,培养基pH 5.8,35 ℃发酵24 h,每3 h取样,测定OD600nm并绘制菌株生长曲线。同时按照1.3.1节方法制备CFS,以金黄色葡萄球菌为指示菌,检测抑菌活性。抑菌活性单位的定义[18]:以金黄色葡萄球菌为指示菌,样品经最大稀释后,打孔检测仍产生清晰抑菌圈的最大稀释倍数倒数作为1 个抑菌活性单位。
1.3.3 细菌素的制备及部分纯化
筛选到的菌株在MRS培养基培养至对数期后,以1%的接种量接于100 mL MRS液体培养基中,35 ℃培养24 h,离心收集上清液,通过20%~80%饱和度硫酸铵盐析,并透析至检测不到硫酸铵。
透析后的粗抗菌液离子交换层析纯化。以pH 6.5、20 mmol/L磷酸缓冲溶液平衡DEAE Sepharose Fast Flow层析柱,透析完全的样品直接上样,以含0~1.0 mol/L NaCl的磷酸缓冲液线性梯度洗脱,洗脱速率1 mL/min,2 mL/管收集,检测波长280 nm。对收集的各洗脱峰检测抑菌活性。
合并有抑菌活性的洗脱液并用超滤法浓缩后上样于Sephadex G-15凝胶柱,用20 mmol/L pH 6.8磷酸缓冲液洗脱,流速为1 mL/min,2 mL/管收集,检测波长280 nm。收集各峰对应组分,抑菌活性检测。
将经过Sephadex G-15纯化后的活性峰用Zorbax SB-C18色谱柱反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)纯化,流动相为0.1%三氟乙酸(trifluoroacetic acid,TFA)溶液和80%乙腈溶液,采用线性梯度,64 min内0.1% TFA溶液为100%~20%,80%乙腈溶液为0%~80%;流速10 mL/min,柱温25 ℃,214 nm检测,手动接收吸收峰样品,滤纸片法检测抑菌活性。
1.3.4 细菌素的分子测定与抑菌活性检测
纯化后的细菌素分子大小用12%的Tricine十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)测定。电泳结束后,将凝胶一分为二切开,一半染色,另一半经充分洗涤脱去SDS后,覆盖LB培养基做抑菌活性检测。
1.3.5 细菌素抗菌谱测定
采用琼脂平板打孔扩散法检测细菌素的抗菌谱[19]。具体方法如下:制备对应不同指示菌的琼脂培养基平板,并在平板上涂布150 μL培养至对数期并稀释到106CFU/mL的指示菌菌液,表面晾干后在培养基上打孔。将100 μL纯化后的细菌素加入到不同指示菌对应的培养基平板孔中,在不同指示菌的最适作用温度下培养1~5 d,检查平板抑菌圈情况,测定抑菌圈直径大小。
1.3.6 酶、温度和pH值对细菌素抑菌活性的影响
将部分纯化的细菌素样品分别与蛋白酶K、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、脂肪酶、α-淀粉酶及β-淀粉酶在37 ℃孵育2 h。所有酶终质量浓度5 mg/mL。酶处理后,样品70 ℃加热10 min,使酶失活。
探究温度对细菌素抑菌活性的影响,将细菌素分别置于37、60、80、100、121 ℃等不同温度下处理10~30 min。
探究pH值对细菌素抑菌活性的影响,将细菌素样品使用HCl或NaOH将pH值调整至2、3、4、5、6、7、8、9,在室温孵育4 h。
上述分析均采用部分纯化的细菌素样品。用琼脂孔扩散法以金黄色葡萄球菌为指示菌进行抑菌活性分析,以未处理的细菌素为对照。
1.3.7 对金黄色葡萄球菌的抑制模式分析
为分析细菌素对金黄色葡萄球菌的抑菌模式做液体抑菌实验。在2 支试管中分别接种金黄色葡萄球菌,37 ℃、180 r/min振荡培养至对数生长期,测定其OD600nm达到约0.5,向其中一支试管中添加部分纯化的细菌素,使其浓度达到最低抑菌浓度,另一支试管添加相同体积的无菌水作对照,在37 ℃条件下继续培养至26 h。每间隔1~5 h测定菌体OD600nm值,绘制金黄色葡萄球菌生长曲线。
1.4 数据统计与分析
2 结果与分析
2.1 产细菌素菌株筛选鉴定
经反复筛选选择菌株Hlh32作为深入研究出发菌株。该菌株在MRS培养基平板上进行平板划线35 ℃培养,菌落为圆形、凸起、表面光滑、白色。在25~40 ℃菌体可以生长,pH 4.5~7.0和NaCl 10%条件下菌株可生长。镜检及生理生化实验显示,菌株革兰氏阳性、棒杆状、无芽孢、过氧化氢酶阴性、明胶液化阴性、硝酸盐还原阴性、吲哚实验阴性。菌株16S rDNA序列BLAST同源性比对发现其与植物乳杆菌菌株(Lactobacillus plantarum)(MH571418)同源性高达99.5%,在系统发育树中位于同一分支(图1)。结合菌株的形态和生理生化特征,认为Hlh32为植物乳杆菌。近年来,Lv Xinran[16]、Wang[20]、Liu Hui[21]等也从植物乳杆菌发酵液中分离得到细菌素,但菌株来源不同其细菌素特性有所不同,因此从不同来源的样品中分离产细菌素菌株对丰富产细菌素资源、寻求更有应用价值的细菌素具有重要意义。

图1 基于16S rDNA的菌株Hlh32系统发育树Fig.1 Phylogenetic tree of strain Hlh32 based on 16S rDNA gene sequence
2.2 菌株生长动力学及细菌素的产生
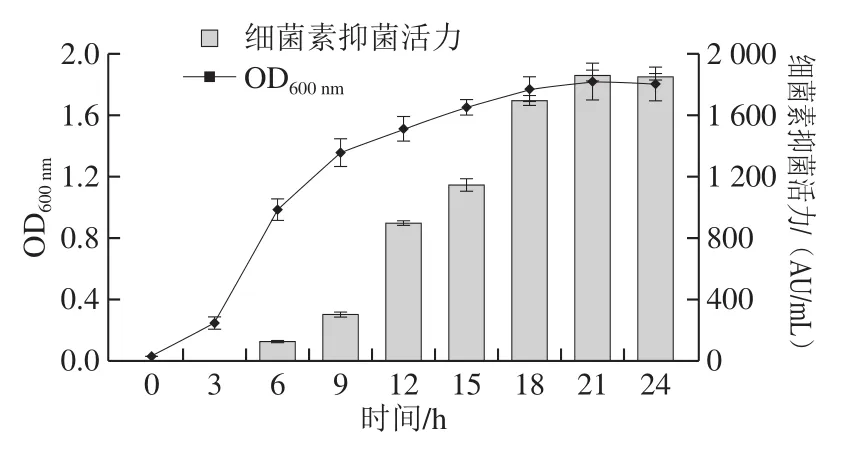
图2 植物乳杆菌Hlh32生长动力学及细菌素的合成Fig.2 Growth kinetics and bacteriocin production of Hlh32
如图2所示,植物乳杆菌Hlh32呈现典型的细菌生长曲线特性,0~3 h处于延迟期;3~9 h OD600nm快速升高,处于对数生长期;9~24 h菌体逐渐从对数生长期过渡到稳定期。细菌素BacH32的合成从接种6 h开始,6~18 h BacH32抑菌活性急剧上升,18~24 h BacH32抑菌活性增加变得缓慢,21 h达到最大抑菌活性1 850 AU/mL且对应OD600nm也达到最高。24 h抑菌活性略有下降。可以看出BacH32从指数期开始合成,稳定期到达最大抑菌活性,由此判断植物乳杆菌Hlh32合成的BacH32属于初级代谢产物且最佳培养时间为21 h,这与Yi Lanhua[22]、Perumal[23]等报道的细菌素合成曲线一致。而Lü Xin等[7]报道的干酪乳杆菌TN-2在发酵18 h后才开始产生细菌素,72 h达到最大抑菌活性。由此推测不同菌株其合成细菌素的机制不同。
2.3 细菌素BacH32的纯化
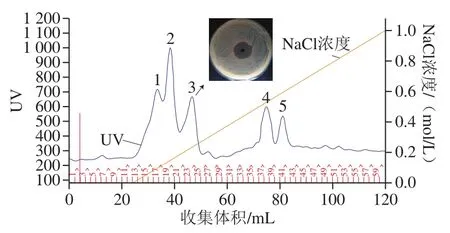
图3 植物乳杆菌Hlh32所产细菌素DEAE Sepharose Fast Flow洗脱曲线Fig.3 Elution curve of bacteriocin Hlh32 on DEAE Sepharose Fast Flow gel
如图3所示,离子交换层析洗脱得到5 个洗脱峰,但只有洗脱峰3(对应NaCl浓度0.18~0.28 mol/L)对指示菌有显著抑菌活性。在该分离条件下,实现了蛋白组分与杂质分子的初步分离,展现了该色谱分离的良好纯化效果。

图4 植物乳杆菌Hlh32所产细菌素Sephadex G-15洗脱曲线Fig.4 Elution curve of bacteriocin Hlh32 on Sephadex G-15 gel
如图4所示,分子筛凝胶过滤层析分离出5 个洗脱峰,对每个洗脱峰打孔检测抑菌活性,显示最大的洗脱峰4,即对应收集管35~40 管具有抑菌活性。通过洗脱图谱看出,分子筛层析分离效率高,可以将其和大多数杂蛋白分开。
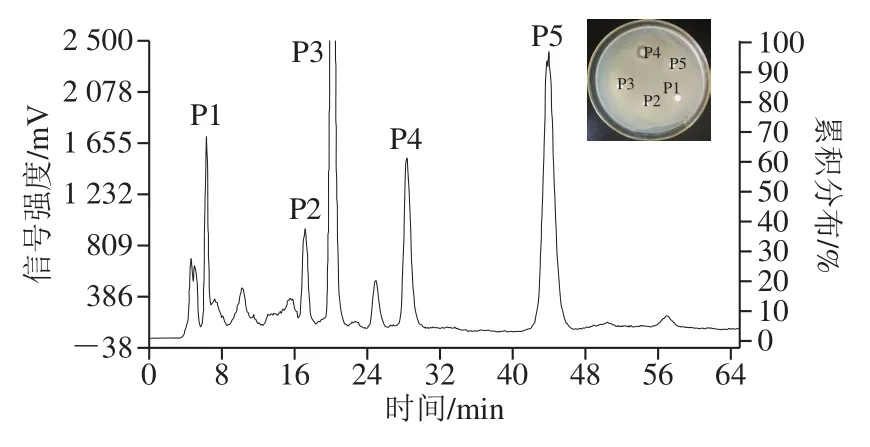
图5 植物乳杆菌Hlh32产细菌素的HPLCFig.5 HPLC chromatogram of bacteriocin Hlh32
最后采用制备型RP-HPLC法对细菌素深度纯化,洗脱曲线如图5所示。得到多个洗脱峰,说明通过前面的两种柱层析技术还不能完全将杂质分开,制备液相分离效率较高。选择较大的洗脱峰,通过滤纸片法检测抑菌活性,保留时间28.4 min的收集峰P4具有明显抑菌活性。
2.4 细菌素分子质量测定结果
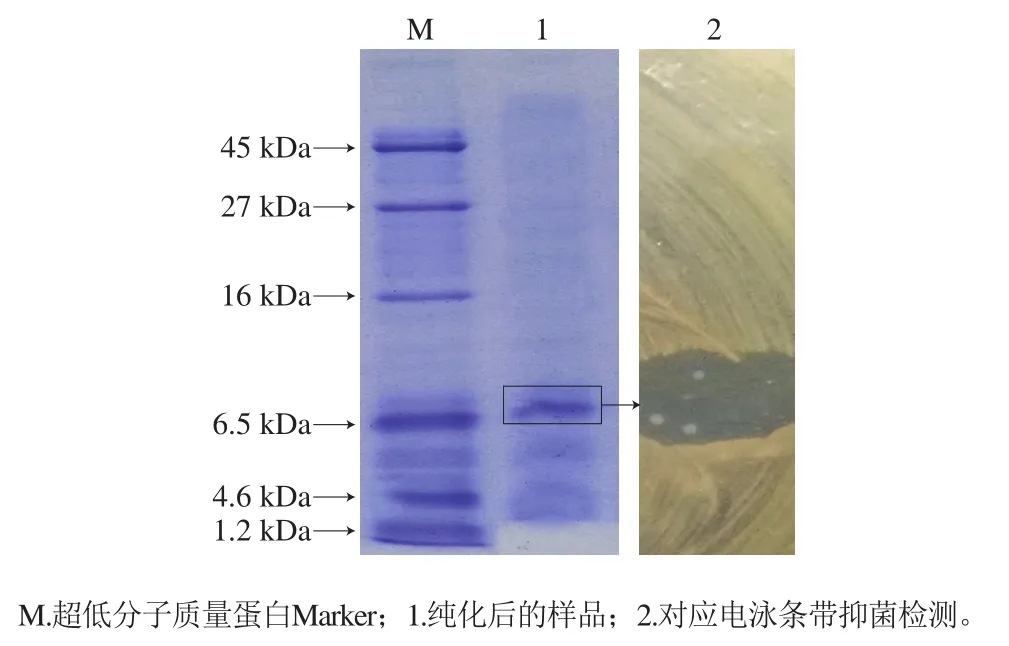
图6 纯化BacH32的Tricine SDS-PAGE分析及直接抑菌检测结果Fig.6 Tricine SDS-PAGE analysis and antimicrobial activity of the purified bacteriocin
如图6所示,在凝胶检测平板上得到显著抑菌条带,该抑菌条带对应位置的凝胶上显示相对单一的染色条带,对照标准分子质量蛋白,BacH32分子质量约为6.7 kDa。通过凝胶分离原位抑菌检测方法,能够清楚、容易地显示抑菌纯化物位置,不需要通过额外的鉴定步骤,不仅简化了实验操作,而且有助于准确判断纯化细菌素分子质量,使得结果更加直观。本研究BacH32分子质量在目前所报道的大部分细菌素分子质量范围内,但比有些文献报道的细菌素分子质量大,如An Yu等[10]报道的植物乳杆菌细菌素M1-UVs300为3.4 kDa,Barbosa等[24]从意大利香肠中发现的植物乳杆菌MBSa4产生的细菌素2.3 kDa,Ahn等[25]从麦芽中发现的乳杆菌HW01产生的细菌素为6.0 kDa。将细菌素BacH32与其他植物乳杆菌细菌素分子质量相比较未发现相同大小的细菌素,推测本研究的BacH32可能为新型的细菌素。
2.5 细菌素BacH32抑菌谱
如表1所示,BacH32对所有指示菌都具有不同程度的抑菌活性,但BacH32对于革兰氏阳性菌的抑制活性显著高于革兰氏阴性菌。对于革兰氏阳性菌中的金黄色葡萄球菌、藤黄微球菌、表皮葡萄球菌抑菌活性最强,其次对于蜡样芽孢杆菌、枯草芽孢杆菌、单核细胞性李斯特菌也表现出了良好的抑菌活性。对革兰氏阴性菌的抑制作用稍弱,对于铜绿假单胞菌和伤寒沙门氏菌的抑菌活性强于大肠杆菌和副溶血性弧菌的抑菌活性。除此之外,BacH32对真菌类菌株也显示了良好的抑制能力。对白色念珠菌、假丝酵母及酿酒酵母都有一定的抑制活性。整体显示,BacH32具有广谱抑菌活性,而目前应用于商业化生产的Nisin[25-26]主要抑制革兰氏阳性细菌,因此其在使用中需要配合其他抗菌剂。近年来,具有良好的广谱抑菌活性的细菌素较少,具备抑制单独一类细菌的较多,如De Kwaadsteniet等[27]对革兰氏阴性菌有抑制作用,但对革兰氏阳性菌无活性;而Lee[28]、Hwanhlem[29]等报道的细菌素只对革兰氏阳性的食品腐败菌和食源性致病菌有抑制作用,而对革兰氏阴性菌无效果。食品容易受到不同种类的腐败菌和致病菌的污染,开发具有广谱抑菌活性的细菌素更具有实际应用价值。BacH32对本实验供试菌株革兰氏阳性菌、阴性菌及真核微生物均表现出抑菌活性,具有较好的开发天然食品防腐剂的潜力。
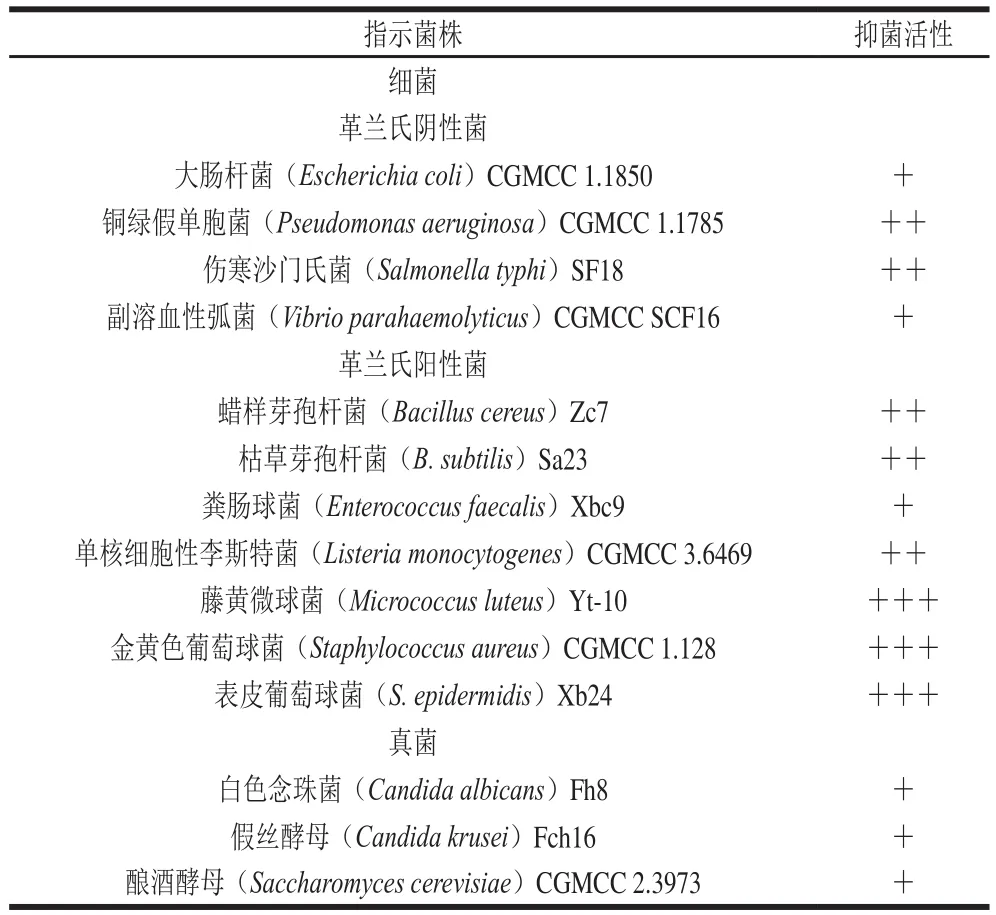
表1 细菌素BacH32的抗菌谱Table 1 Antimicrobial spectrum of bacteriocin BacH32
2.6 酶、温度和pH值对BacH32抑菌活性的影响
BacH32在经过蛋白酶K、胃蛋白酶、胰蛋白酶、木瓜蛋白酶等蛋白水解酶处理后,完全丧失抑菌活性(表2),而其抑菌活性不会受到脂肪酶和淀粉酶的作用,表明分子中不含有脂肪链或淀粉糖链结构,这与Gao Yurong[30]、Wen[31]等报道的细菌素特性一致。细菌中发现的还有一类抗菌物质——脂肽,其主要来源于芽孢杆菌,分子中多含由几个非普通的氨基酸构成的环状多肽,大都不能被蛋白酶降解,同时分子中含有脂肪酸链[28]。而本研究BacH32容易被不同蛋白酶降解,没有脂类或碳水化合物,故可以判断本研究植物乳杆菌Hlh32菌株产生的抗菌物质是细菌素类。细菌素的蛋白质特性使它可在人和动物的胃肠道中降解,因此可以在食品中用作天然防腐剂。
表2显示,BacH32在37、60 ℃和80 ℃处理30 min ,抑菌活性几乎保持不变,在121 ℃处理15 min,相对抑菌活性仍能保持74.5%。BacH32表现出良好的热稳定性。若将BacH32添加到食品中,对食品进行常规的巴氏杀菌或短时间的121 ℃灭菌,BacH32都可保持良好的活性。与文献报道的细菌素相比[4,25,32],本研究的BacH32在热稳定性方面更有优势。
植物乳杆菌Hlh32细菌素具有较好的pH值稳定性,pH 2.0~9.0范围,抑菌活性逐渐降低,在pH 7.0以下,相对抑菌活性都在93%以上,在pH值达到9.0时,抑菌活性显著降低,但相对抑菌活性仍接近80%。本研究BacH32在酸性条件下稳定性更好,这与Lv Xinran[16]、Castro[33]、Wayah[34]等报道的细菌素pH值稳定性相类似;但相比于Zhu Xuan[35]、Zhang Ying[36]等报道的细菌素pH值稳定性好。BacH32在酸性条件(pH 2~7)及碱性条件(pH 8~9)的优良的稳定性使其在食品防腐方面有更好更广的应用。
2.7 细菌素BacH32对金黄色葡萄球菌的抑制模式
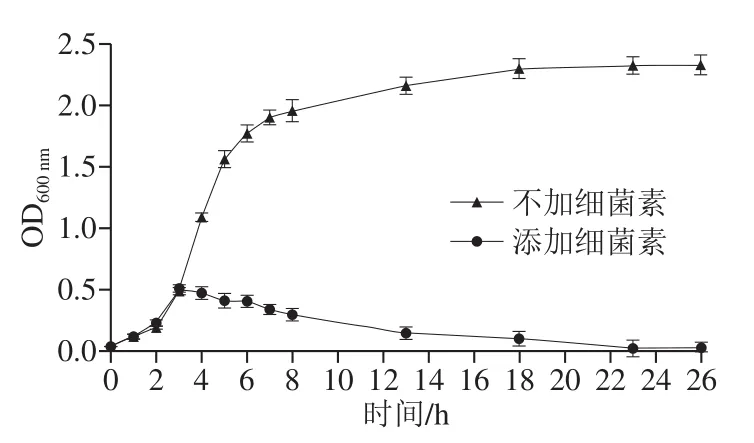
图7 细菌素BacH32对金黄色葡萄球菌的抑制作用Fig.7 Bacteriostatic effect of BacH32 on S. aureus
如图7所示,实验2 支试管在不添加BacH32之前(即培养3 h之前),生长曲线基本一致,在3 h时其中一支试管添加BacH32,随后两者生长曲线完全不同。不添加BacH32的金黄色葡萄球菌快速生长,进入指数期,到8 h后生长逐渐缓慢进入稳定期,在培养到第26小时达到最大生长量,OD600nm为2.325。添加BacH32的指示菌3 h后即出现生长抑制,OD600nm随后进入缓慢下降阶段,培养26 h,OD600nm几乎为0。表明BacH32不仅完全抑制了菌体的生长,而且使前期现存的菌体细胞裂解,说明BacH32对金黄色葡萄球菌有强烈的抑制作用。具有相似抑制作用的还有Lü Xin[7]、Abramsb[37]、Todorov[38]等报道的细菌素。
3 结 论
从泡菜中分离筛选得到1 株产细菌素的乳酸菌菌株Hlh32。通过菌体形态、生理生化实验及16S rDNA基因序列比对分析确定该菌株为植物乳杆菌。采用两种柱层析技术及RP-HPLC制备液相分离得到电泳纯的BacH32,其分子质量与文献报道的植物乳杆菌来源的细菌素不同。抑菌实验显示BacH32对常见的食源性腐败菌、致病菌如大肠杆菌、铜绿假单胞菌、伤寒沙门氏菌、副溶血性弧菌、蜡样芽孢杆菌、单核细胞性李斯特菌、藤黄微球菌、金黄色葡萄球菌等革兰氏阴性菌与革兰氏阳性菌都具有抑菌活性,其中对革兰氏阳性菌抑菌活性高于革兰氏阴性菌,并且对供试菌株白色念珠菌、假丝酵母及酿酒酵母都有一定的抑制活性。多种蛋白酶分别处理BacH32,其抑菌活性完全丧失,表明纯化的抗菌物质是细菌素。稳定性研究表明,BacH32在较高的温度、酸性、中性环境下能保持很高的稳定性,抗逆性较强。以上整体特性与文献报道的细菌素相比,存在一定差异,由此推断本研究从泡菜中分离的植物乳杆菌Hlh32所产生的BacH32可能为一种新的细菌素,其在食品防腐方面具有较好的优势,有潜力进一步开发为天然食品添加剂。

