通过式SPE-UPLC-MS/MS测定植物油中的9 种酚类抗氧化剂
张艳侠,赵慧男,孙珊珊,徐向军,郑文静,薛 霞,王明栋,刘艳明,*,祝建华,*
(1.山东省食品药品检验研究院,山东省特殊医学用途配方食品质量控制工程技术研究中心,山东省食品药品安全检测工程技术研究中心,山东 济南 250101;2.中国石化天然气分公司榆济管道公司,山东 济南 250101)
富含不饱和双键的植物油易发生氧化变质,为防止植物油酸败,产生对人体有害的物质,添加抗氧化剂防止或减慢油脂氧化作用,达到油脂原有的性质和营养价值[1-2]。没食子酸丙酯(propyl gallate,PG)、2,4,5-三羟基苯丁酮(2,4,5-trihydroxybutyrophenone,THBP)、叔丁基对苯二酚(tert-butylhydroquinone,TBHQ)、去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA)、叔丁基对羟基茴香醚(butylated hydroxyanisole,BHA)、2,6-二叔丁基-4-羟甲基苯酚(Ionox-100)、没食子酸辛酯(octyl gallate,OG)、2,6-二叔丁基对甲基苯酚(butylated hydroxytoluene,BHT)及没食子酸十二酯(dodecyl gallate,DG)等常用人工合成抗氧化剂因抗氧化效果好、价格低廉被广泛应用于植物油的防腐败变质,存在过量或违规使用的食品安全问题。毒理学研究表明,抗氧化剂具有一定的毒性和致癌作用,如TBHQ能导致DNA损伤[3-4]。许多国家对该类抗氧化剂的使用及限量作了明确规定,日本及欧盟等国家禁止任何食品中添加TBHQ等抗氧化剂。我国的GB 2760—2014《食品添加剂使用标准》对部分抗氧化剂的最大使用限量做出了严格规定[5]。食品中人工抗氧化剂的控制成为食品安全问题的焦点。
食品中抗氧化剂常用的检测方法有薄层色谱法、比色法[6]、毛细管电泳法[7]、电化学法[8]、气相色谱法[9-11]、气相色谱-串联质谱法[12-13]、高相液相色谱法[14-17]和液相色谱-串联质谱法[18-19]。其中,薄层色谱法和比色法在定性、定量方面存在不准确问题。气相色谱法和气相色谱-串联质谱法对前处理要求高,方法相对复杂且抗干扰能力差。高效液相色谱法存在灵敏度差,定性不足等问题。液相色谱-串联质谱法因其高灵敏度、高选择性及定量定性准确等特性,已广泛应用于各种农兽药残留及添加剂的检测中[20-21]。植物油的化学成分复杂,基质干扰严重,常用的前处理方法有液液萃取法[22-23]、固相萃取柱法[24]、凝胶色谱净化技术[25-26]、基质固相分散法等[27-28],这些方法存在前处理过程复杂、耗时,需要大量有毒有机溶剂,回收率低及不能兼顾多种抗氧化剂等问题。Oasis®PRiME HLB为通过型固相萃取柱,其特点是出色的除磷脂、蛋白及油脂等杂质的作用,已有报道将其用于肉及肉制品、水产品、禽副产品等基质中兽药残留的检测[29-30]。现行GB 5009.32—2016《食品中9 种抗氧化剂的测定》中第二法为液相色谱-串联质谱法,方法只包括PG、THBP、NDGA、OG及DG共5 种抗氧化剂,9 种抗氧化剂只能用高效液相色谱法检测,极大限制了标准方法的使用[31]。将通过式固相萃取与液相色谱-串联质谱法结合,分析植物油中酚类抗氧化剂的研究尚鲜见报道。
本研究对植物油样品经酸化乙腈提取,通过式Oasis PRiME HLB净化,超高效液相色谱-三重四极杆串联质谱检测,建立同时检测植物油中9 种酚类抗氧化剂的快速检测方法。采用的通过式Oasis PRiME HLB固相萃取柱无需活化和洗脱步骤,操作简单、效率高,可以有效去除磷脂、脂肪和蛋白等干扰,降低基体效应,提高回收率。该方法简便快捷、灵敏度高、通量性好、检测效率高,特别适合植物油中酚类抗氧化剂的定性、定量检测。
1 材料与方法
1.1 材料与试剂
所用油样品均为市售。
THBP、TBHQ、NDGA、BHA、Ionox-100、OG、BHT及DG标准品(纯度≥98%) 北京曼哈格生物科技有限公司;PG(纯度≥95%) 德国Dr. Ehrenstorfer公司;L-抗坏血酸棕榈酸酯(L-ascorbgyl palmitate,AP)(纯度>97%) 美国TCI公司;甲醇、乙腈、正己烷(均为色谱纯) 德国默克公司;甲酸(色谱纯) 美国Sigma-Aldrich公司;超纯水为Milli-Q超纯水机制备;氮气(>99.999%) 美国Millipore公司;标准品均于4 ℃保存。
1.2 仪器与设备
ACQUITYTMUPLC I-Class超高效液相色谱仪、Xevo TQ-S质谱仪(配有电喷雾电离源和MasslynxTM色谱工作站)、HSS T3色谱柱(100 mm×2.1 mm,1.8 μm)美国Waters公司;3-18K高速冷冻离心机 德国Sigma公司;SB-800DTD型超声波清洗器 宁波新芝生物科技有限公司;MS3涡旋混合器 德国IKA公司;N-EVAP-45位氮吹仪 美国Organomation公司;SQP-电子天平 美国塞多利斯科学仪器有限公司;Oasis®PRiME HLB固相萃取柱(200 mg/6 mL)、0.22 μm有机微孔滤膜 上海安谱科学仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制
准确称取10 mg(精确至0.01 mg)各抗氧化剂标准物质,用甲醇溶于10 mL棕色容量瓶中,定容至刻度,分别配制成质量浓度为1 mg/mL的标准储备液,于-18 ℃避光保存。移取各标准储备液用甲醇(含50 μg/mL AP)稀释到适当的质量浓度得到抗氧化剂混合标准工作液,冷冻避光保存。
1.3.2 样品前处理
提取:称取均匀油样品1 g(精确至0.000 1 g)于50 mL聚丙烯具塞离心管中,加入10 mL含50 μg/mL AP的0.5%甲酸-乙腈溶液,涡旋5 min,超声10 min,8 000 r/min离心5 min,将上层提取液移出,残留油样再加入8 mL含50 μg/mL AP 的0.5%甲酸-乙腈溶液重复提取一次,合并2 次提取液。加入10 mL乙腈饱和正己烷,涡旋除脂后弃去正己烷层,取乙腈层定容至20 mL,待净化。
净化:准确取5 mL提取液上Oasis PRiME HLB固相萃取柱,再加3 mL乙腈进一步淋洗,合并所用流出液,流出液于40 ℃氮吹浓缩至近干,用1 mL甲醇复溶后,加1 mL水稀释,涡旋混匀离心,过0.22 μm微孔滤膜,供液相色谱-串联质谱仪测定。
1.3.3 基质效应
取空白基质样品,按1.3.2节前处理步骤制备空白基质溶液。分别用空白基质溶液和定容溶剂稀释标准储备液,得到同质量浓度水平的测定液。通过分别测定样品空白基质溶液与纯溶剂中添加同水平目标成分的响应值,计算二者的相对比值评价基质效应,按下式计算:

基质效应为负值表示存在基质抑制效应;基质效应为正值表示存在基质增强效应,0为无基质效应,绝对值越大基质效应越强。
1.3.4 色谱条件
HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相:乙腈(A)和水(B);梯度洗脱程序:0~3 min,10%~30% A,90%~70% B;3.0~5.0 min,30% A,70% B;5.0~10.0 min,30%~95% A,70%~5% B;10.0~12.0 min,95% A,5% B;12.0~12.1 min,95%~10% A,5%~90% B;12.1~14.0 min,10% A,90% B。流速:0.3 mL/min;柱温35 ℃;进样体积2 μL。
1.3.5 质谱条件
电喷雾离子源,负离子模式;毛细管电压2.4 KV;锥孔电压40 V;脱溶剂气温度500 ℃;离子源温度150 ℃;脱溶剂气流速850 L/h;锥孔气流速150 L/h;碰撞气流速0.12 mL/min;扫描方式为多反应监测;抗氧化剂的定性定量离子对、裂解电压、驻留时间及碰撞能量见表1。
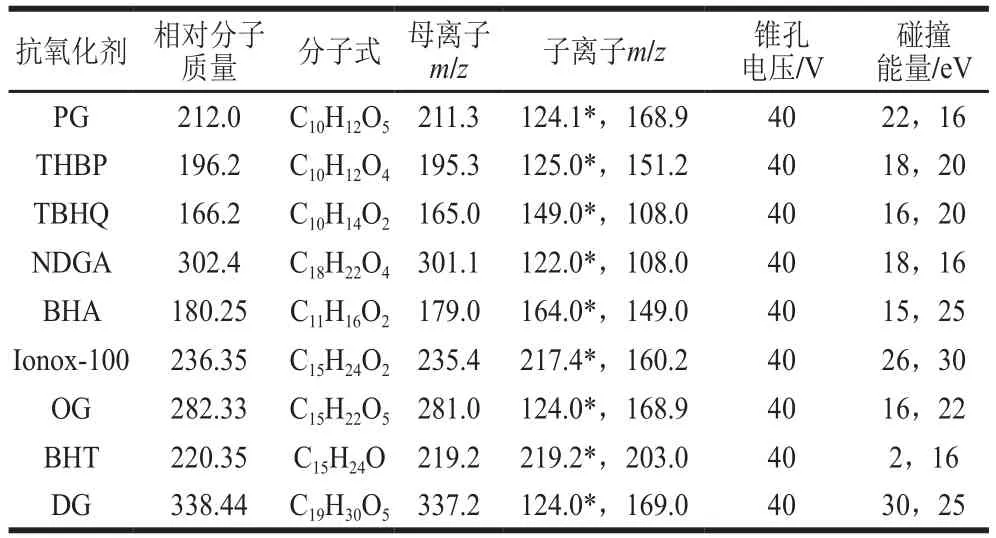
表1 9种抗氧化剂的质谱参数Table 1 Optimal MS parameters for nine antioxidants
1.4 数据处理
通过与仪器配套的MasslynxTM色谱数据处理系统完成数据采集与处理,以及Origin 8.0软件进行绘图。
2 结果与分析
2.1 仪器条件优化
2.1.1 质谱条件优化
9 种抗氧化剂均为含有不同酚羟基的化合物,在电喷雾离子源下易电离形成负离子。将1 μg/mL的9 种抗氧化剂标准溶液通过蠕动泵注入质谱仪,通过一级质谱扫描获得相应的母离子,优化喷雾电压、喷雾器温度等质谱参数获得最优离子源参数;随后通过子离子扫描选择信号强且稳定的碎片离子,分别确定定性离子及定量离子,进一步优化裂解电压、碰撞能量等参数,得到目标化合物的MRM质谱参数,具体见表1。
分析抗氧化剂结构式及质谱图发现,9 种酚类抗氧化剂均易失去H+形成[M-H]-的准分子离子峰,以THBP为例,见图1。因结构式中有多个酚羟基,使准分子离子峰成簇状(与同位素分布有所不同),这种簇状碎片离子峰有助于对酚类抗氧化剂的辅助定性。实验发现目标化合物丢1 个H+的[M-H]-碎片离子更稳定,推测原因应该是丢失1 个H+的带电碎片若进一步丢失离子或碎片在能量需求上会提高。二级碎裂方面,二级碎片均为丢掉其支链结构,产生信号较强的碎片离子、其他几种抗氧化剂虽母体骨架不同,主要裂解规律均是丢失不同的支链结构得到信号强且稳定的碎片离子。此外BHT只有1 个酚羟基,结构稳定,不易电离,[M-H]-碎片响应最高、最稳定碎片,确定为定量离子,[M-OH]-为其定性离子。总之,通过对不同抗氧化剂裂解规律分析发现,化合物的质谱裂解表现同其结构特征密切相关,对于化合物准确定性具有较好确证作用。

图1 THBP二级全扫描质谱图Fig.1 MS2 spectra of THBP
2.1.2 色谱条件优化
9 种抗氧化剂极性差异大,在色谱柱上保留行为有较大区别。常规C18色谱柱即对所有化合物保留,但不同色谱柱在分离度和峰形上有较大的差别。分别对BEH C18(50 mm×2.1 mm,1.7 μm)、BEH C18(75 mm×2.1 mm,1.7 μm)、BEH C18(100 mm×2.1 mm,1.7 μm)、HSS T3(100 mm×2.1 mm,1.8 μm)进行考察。在相同色谱条件下,BEH C18短柱对9 种抗氧化剂不能很好的分离,且峰拖尾严重,BEH C18(100 mm×2.1 mm,1.7 μm)虽然分离上达到了要求,对于含酚羟基较多的PG、THBP、OG及DG等化合物仍存在较严重的拖尾。HSS T3色谱柱具有消除酚类化合物或有机酸等化合物拖尾严重的作用。流动相方面,分别考察甲醇-水、乙腈-水、乙腈-10 mmol/L醋酸铵溶液、乙腈-0.05%甲酸溶液几种流动相对目标物的影响,结果发现乙腈较甲醇有更好的洗脱效果和峰形。加入醋酸铵后峰形拖尾严重,响应降低,加入适当甲酸在修饰峰形上效果较好,但加入酸后部分抗氧化剂响应降低,特别是BHT响应下降明显,最终选择乙腈-水为流动相。通过优化梯度洗脱程序,使目标物与杂质组分有效地分离,峰形良好,满足要求,结果见图2。
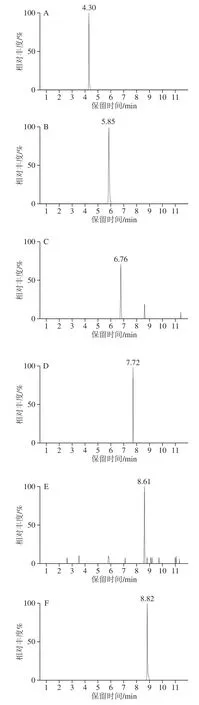
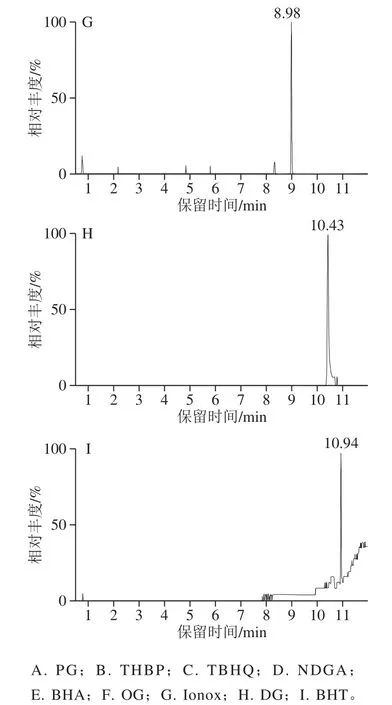
图2 9种抗氧化剂标准溶液多反应监测色谱图Fig.2 MRM chromatograms of nine antioxidant standard solutions
2.2 提取条件优化
2.2.1 提取剂的优化
食用油脂肪含量高,基质复杂,且9 种酚类抗氧化剂性质差异较大,如何高效率、低杂质的提取是实验的关键第一步。分别考察甲醇、乙腈、0.1%酸化乙腈、0.2%酸化乙腈、0.5%酸化乙腈、1%酸化乙腈作为提取剂的提取效果。结果发现,纯甲醇提取效率明显高于乙腈,但对提取液进行全扫描发现,甲醇提取的总离子响应为乙腈的2 倍以上,且干扰峰更多,这应该是质子性溶剂甲醇对酚类抗氧化剂提取效果提升的同时对植物油中的杂质共提取率也提高。
如何将提取效率与降低共萃物同时兼顾,实验考察在乙腈中加入不同浓度的甲酸,以期达到改变目标物化学行为的目的。由图3A可以看出,加入甲酸后,抗氧化剂提取效率有明显的提高,应该是对于弱酸性抗氧化剂,酸度的提高提高其分子状态所占比,表现为在非质子溶剂乙腈中溶解度提高。为较直观比较几种提取溶剂提取效率,设定乙腈提取效率为1,其他提取溶剂的提取效率与其比值为比较因子f,见图3B。通过分析比较因子发现,随着甲酸含量的提高,提取效率提升,不同酸度提取溶剂提取效率趋势一致,其中DNGA变化最为明显,结构分析可能是含有4 个酚羟基受酸的影响大。当酸体积分数达到1%后,部分化合物回收率反而有所降低,可能是酸含量过高对质谱响应有一定的抑制作用。综合考虑,选择0.5%甲酸-乙腈为提取溶剂。
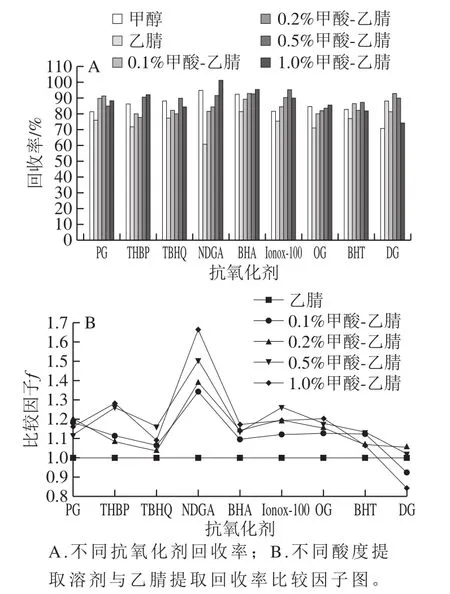
图3 不同提取溶剂对抗氧化剂提取效率的比较Fig.3 Recoveries of nine antioxidants with different extraction solvents
2.2.2 提取次数的优化
以0.5%甲酸-乙腈为提取剂,考察提取次数对不同抗氧化剂提取效率的影响。分别对提取1、2、3 次进行考察,发现提取2 次回收率明显高于1次,进一步增加提取次数,回收率无明显提高,因此以0.5%甲酸-乙腈提取2 次对植物油中抗氧化剂进行处理。
2.2.3 稳定剂的确定
抗氧化剂标准溶液及前处理检测过程中,部分抗氧化剂存在含量下降的现象,参考文献[32]在抗氧化剂的标准溶液及提取溶液中加入AP改善标准溶液的存储及前处理过程中抗氧化剂的不稳定性。实验发现质量浓度为50 μg/mL的AP即可保证9 种抗氧化剂含量稳定。因此本研究在标准溶液和提取溶剂中加入50 μg/mL的AP作为稳定剂。
2.2.4 除脂方式的选择
正己烷为一种常用除脂溶剂,并被用于现行国家标准。然而本实验发现,当乙腈作为提取溶剂时,正己烷除脂后部分氧化剂会产生一定的损失。将正己烷萃取液氮吹,复溶后检测,如图4所示,折线为正己烷中溶解的抗氧化剂所占比例,发现BHT损失20%以上,其他抗氧化剂也有不同程度的损失。分析发现损失明显的BHA、Ionox-100、BHT、DG几种抗氧化剂,在结构上因苯环上有不同数量的叔丁基或烷基长链而极性相对较低,更易溶于低极性的正己烷。当提取溶剂中加入酸后,除脂步骤没有引起回收率降低,部分回收率反而有所提高,推测原因应该是酸度的提高使酚羟基以更高比例成分子状态而参与自身的电荷传递,提高了极性,减少了目标物的损失。因此,本实验选择酸性乙腈提取后,正己烷进行除脂净化。

图4 不同除脂方式对抗氧化剂回收率的影响Fig.4 Effect of defatting solvents on recoveries of nine antioxidants
2.2.5 固相萃取柱的选择
本实验对直接提取、C18、HLB固相萃取柱、中性氧化铝柱、氨基柱及PRiME HLB固相萃取柱几种前处理净化手段进行比较。选择空白花生油基质分别在加标回收、净化液全扫描及基质效应等方面进行比较。直接提取不经净化容易污染仪器,堵塞色谱柱,带来严重基质效应,影响定量结果的准确性。GB 5009.32—2016中所用的C18固相萃取柱对9 种抗氧化剂的保留不强,超过50%含量的目标物在上样过程中损失,在洗脱步骤仅有6.95%~53%含量的目标物。同样,实验发现氨基柱和中性氧化铝柱对不同抗氧化剂保留上表现出了不同的选择性,分别对BHA、Ionox-100、BHT和BHA、Ionox-100、BHT、TBHQ有一定的回收率,其他抗氧化剂几乎无回收率,分析原因是2 种正相模式固相萃取柱对极性稍强抗氧化剂作用力太强,不容易洗脱下来。
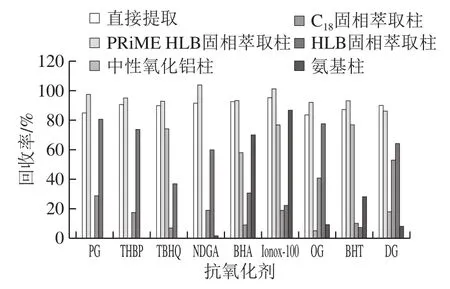
图5 不同净化方式对抗氧化剂回收率的影响Fig.5 Effect of cleanup solvents on recoveries of nine antioxidants
由图5可以看出,HLB固相萃取柱对所有抗氧化剂都有一定的保留,但回收率有一定的差别,TBHQ、BHA、BHT、Ionox-100四种抗氧化剂回收率小于40%,PG、THBP、NDGA、BHA、OG、DG回收率在60%~80%,分析原因可能是HLB为亲水亲脂平衡共聚合填料,含有特定比例的亲水基和疏水基,HLB的保留强弱与抗氧化剂的极性有关。PRiME HLB填料是在HLB基础上开发的反相固相萃取净化材料,无需活化和平衡步骤,净化过程只吸附杂质,目标成分不保留。PRiME HLB对所有抗氧化剂回收率满意,体现了其较好的通量性。此外,基质效应考察发现PRiME HLB净化效果较C18和HLB好。对PRiME HLB净化过程优化,直接上样收集后几种抗氧化剂有小于10%的损失,需要进一步的乙腈洗脱,因此本净化过程合并两次洗脱液后回收率和净化效果均满意。因此本研究选择用酸化乙腈提取后PRiME HLB固相萃取柱净化。
2.2.6 样品定容液的选择
分别对乙腈、甲醇、甲醇-水(80∶20,V/V)、甲醇-水(50∶50,V/V)、甲醇-水(20∶80,V/V)几种定容溶剂进行考察。结果发现不同的溶剂定容液,色谱峰形和质谱信号有一定差异。质谱响应上,甲醇与乙腈相比目标物响应高,不同比例甲醇-水响应变化不大。峰形方面,以色谱峰的不对称因子对色谱峰进行评价,不对称因子为同高度处后半峰的宽度与10%峰高处前半峰的宽度之比,当不对称因子大于1时为拖尾峰,当不对称因子小于1时前延峰。从表2可以看出,以PG、THBP、TBHQ、NDGA几种保留弱的抗氧化剂受溶剂效应影响大,在高比例有机相中有明显前延峰,降低有机相比例,前延峰得到较好改善。综合考虑,选择甲醇-水(50∶50,V/V)溶液作为样品定容液。
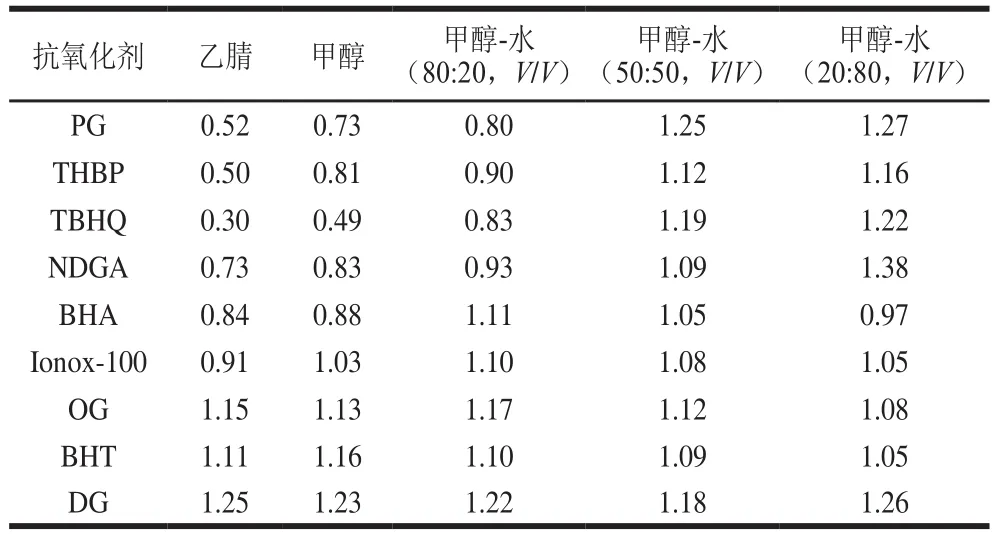
表2 9种抗氧化剂不同定容溶液中色谱峰不对称因子Table 2 Asymmetry factors (As) of different solvents to nine antioxidants
2.3 线性范围、相关系数及定量限
将标准储备液用空白样品溶液稀释质量浓度为1.0、2.0、5.0、10.0、25.0、50、100、250、500、1 000 ng/mL的系列标准工作溶液(含50 μg/mL AP)。按质量浓度由低到高依次测定,以各物质定量离子对的峰面积(Y)对其质量浓度(X)作标准曲线,其线性相关系数均大于0.994。采用空白基质加标的方法,以信噪比为10得到目标物的定量限,以信噪比为3得到目标物的检出限。结果见表3,9 种抗氧化剂检出限在0.003~0.02 mg/kg之间,定量限在0.01~0.05 mg/kg之间,与现行方法比较具有较高灵敏度(表4)。

表3 9种抗氧化剂的回归方程、线性相关系数、线性范围、检出限及定量限Table 3 Calibration equations, correlation coefficients, linear ranges, and limits of detection and quantitation of nine antioxidants
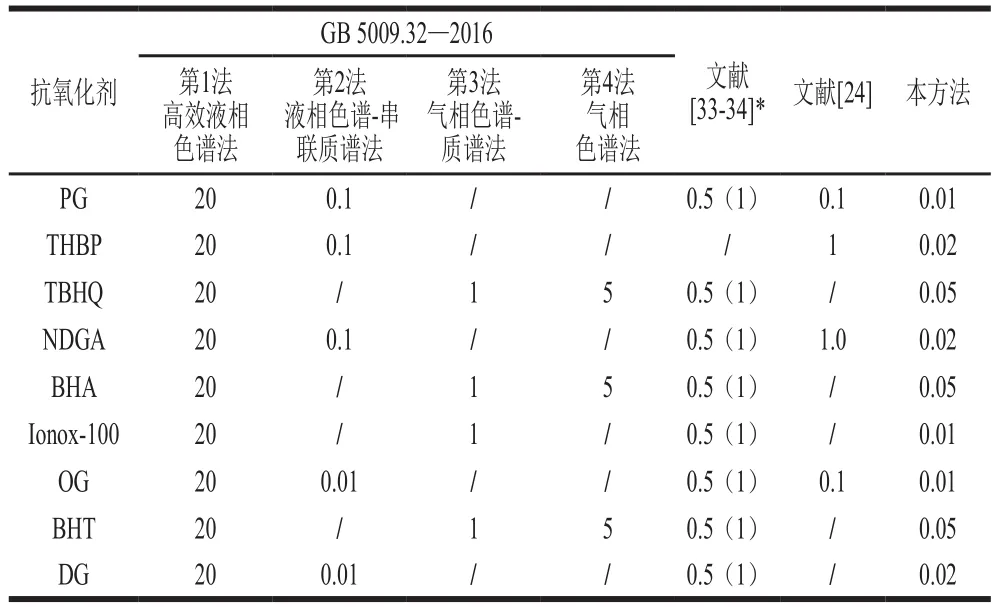
表4 9种抗氧化剂在现有标准及文献中的定量限Table 4 LOQs specified in the national standard and reported in the literature for nine antioxidants mg/kg
2.4 回收率和精密度结果
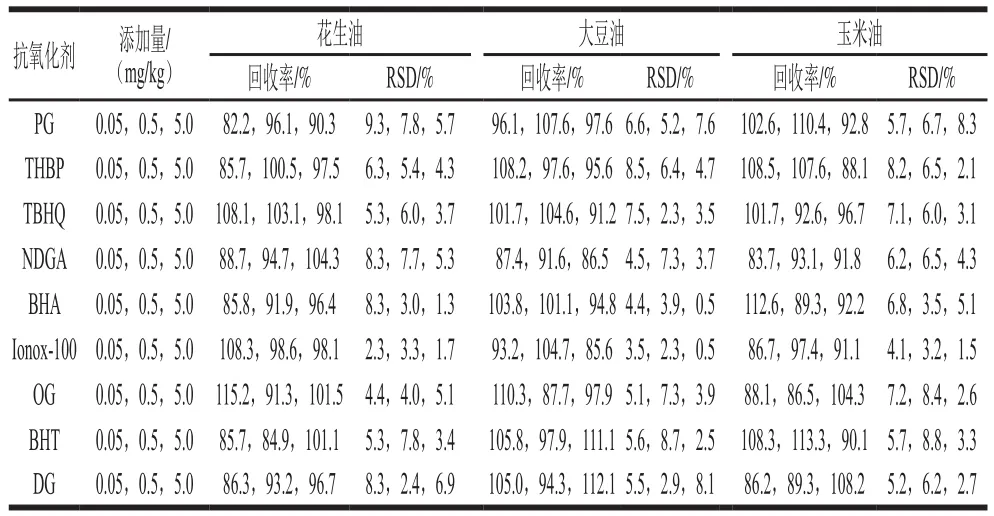
表5 不同食用油中9种抗氧化剂加标回收率及精密度(n=6)Table 5 Average recoveries and RSDs of nine antioxidants in spiked vegetable oil samples (n= 6)
分别在花生油、玉米油、大豆油中添加0.05、0.5、5.0 mg/kg三个水平的9 种抗氧化剂标准溶液,每个水平重复测定6 次,按照1.3.2节前处理方法进行提取净化,经超高效液相色谱-串联质谱测定,结果如表5所示。加标回收率在82.2%~115.2%范围内,相对标准偏差(relative standard deviation,RSD)均小于9.3%。
2.5 基质效应
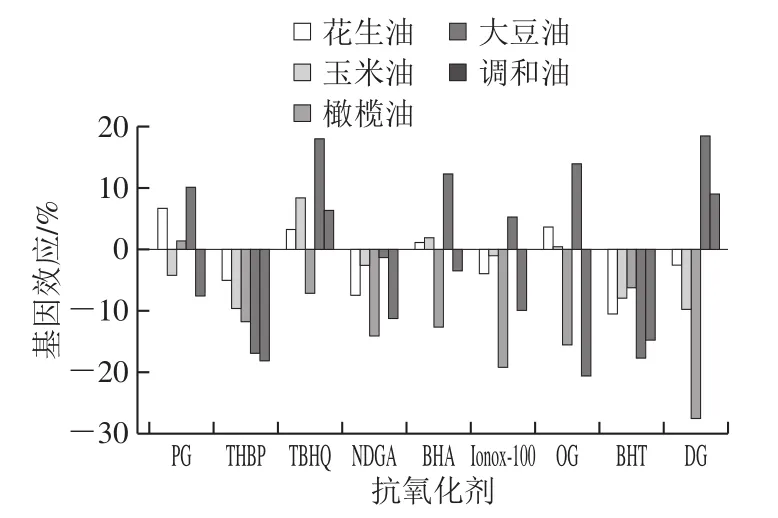
图6 植物油中9 种抗氧化剂基质效应评价图Fig.6 Matrix effects in HPLC-MS analysis of nine antioxidants in vegetable oil
液相色谱-串联质谱法具有较高的灵敏度,但基于其检测原理,存在一定的基质效应,通过正己烷除脂结合PRiME HLB对样品提取液净化,可以较好去除盐、蛋白、脂肪及磷脂等干扰成分,降低样品的基质效应。按1.3.3节方法对花生油、玉米油、橄榄油、大豆油及调和油5 种植物油中9 种抗氧化剂的基质效应进行评价。如图6所示,不同抗氧化剂在不同植物油中基质效应存在一定的差异,基质效应较小的为花生油和玉米油,基质效应稍严重的为橄榄油和调和油,分析原因可能与不同植物油中化学成分差异有关。不同抗氧化剂在不同植物油中受影响程度不同,色谱上出峰晚的抗氧化剂基质效应更明显,应该是植物油中主要干扰物为低极性化合物,随着洗脱强度的提高,更多共流出物被洗脱下来。综合考虑,本实验采用空白基质匹配校正曲线定量,以减少基质干扰对结果的影响。
2.6 实际样品测定
采用本实验建立的分析方法对市场上购买的玉米油、调和油、花生油等20 批次样品进行分析,有6 批次植物油检出抗氧化剂,1 批次花生油中PG 、Ionox-100、DG含量分别为0.05、0.12、0.15 mg/kg;2 批次胡麻油中Ionox-100含量分别为3.15 mg/kg和27.6 mg/kg;1 批次牡丹籽油中BHT含量为36.0 mg/kg;2 批次紫苏油中NDGA含量分别为6.03 mg/kg和14.8 mg/kg。
3 结 论
本实验建立采用新型通过式固相萃取柱净化,超高效液相色谱-串联质谱法分析植物油中9 种抗氧化剂的通量检测方法。该方法通过保留杂质的通过式净化手段,结合高灵敏度的超高效液相色谱-串联质谱检测方法,实现不同植物油基质中9 种抗氧化剂的同时检测。该方法样品前处理简便快速,定性、定量准确,可满足植物油中9 种抗氧化剂的快速检测,大幅提高了检测效率,降低了检测成本。

