在线固相萃取-液相色谱-串联质谱法测定鸡肉和鸡蛋中5 种抗病毒类药物残留量
马俊美,何亮娜,孙 磊,王 东,张雷雷,张 岩,*,康文艺
(1.河北省法医学重点实验室,河北医科大学法医学院,河北 石家庄 050017;2.河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050227;3.河南大学 国家食用菌加工技术研发专业中心,河南 开封 475004)
病毒感染是威胁人类及动物生命健康的主要问题之一[1],为解决流感问题,人们研发了多种抗病毒类药物,如金刚烷胺[2]、金刚乙胺[3]、美金刚、奥司他韦和阿比多尔等。历史上爆发的多次流感事件造成大量畜禽死亡[4],给养殖业带来严重的经济损失,为降低畜禽发病率,不少养殖户将人用抗病毒类药物添加至畜禽饲料中[5]。金刚烷胺、金刚乙胺、美金刚、奥司他韦、阿比多尔等抗病毒药物作为人类治疗病毒性疾病的专用药,移作兽用缺乏科学依据,且长期使用会造成动物中毒、药物残留、病毒抑制或变异[6-7]等,进而影响人类的身体健康。2005年我国农业部发布了560号公告,规定禁止将金刚烷胺等人类抗病毒类药物用于禽类饲养过程中[8],但目前我国禽类饲养过程中滥用抗病毒类药物现象严重,禽类产品中的抗病毒类药物高效率检测方法较少。因此,建立禽类产品中高效、准确的抗病毒类药物多残留检测方法[9],对于有效监控抗病毒药物的使用、保障我国动物源性食品安全具有重要意义[10]。
1 材料与方法
1.1 材料与试剂
MCX在线固相萃取小柱(10 mm×1 mm) 美国Waters公司;乙腈、甲醇(均为色谱纯) 德国Merck公司;丙酮、乙酸乙酯、二氯甲烷(均为色谱纯)美国Fisher公司;甲酸(色谱纯) 美国Sigma公司;盐酸、乙酸(均为分析纯) 天津科密欧化学试剂厂;超纯水 广州屈臣氏公司;阿比多尔、金刚烷胺、金刚乙胺、美金刚、奥司他韦、金刚烷胺-D6、美金刚-D6标准品德国Dr. Ehrenstorfer GmbH公司。
1.2 仪器与设备
Symbiosis(Pico)在线固相萃取-液相色谱系统荷兰Spark Holland公司;Triple Quad 6500三重四极杆串联质谱仪 美国SCIEX公司;3K15高速冷冻离心机德国Sigma公司;Elmasonic P300H超声波清洗仪 德国Elma公司;MS3-旋涡混合器 德国IKA公司。
1.3 方法
1.3.1 样品前处理及标准溶液配制
称取5.00 g搅碎的鸡肉和鸡蛋样品,置于50 mL聚丙烯离心管中,加入100 μL内标混合中间溶液和10 mL 1.0%甲酸-乙腈溶液,涡旋混合1 min,超声提取20 min,9 500 r/min离心5 min,上清液过0.22 μm聚醚砜微孔滤膜,待测。
标准溶液的配制:称取适量的阿比多尔、金刚烷胺、金刚乙胺、美金刚、奥司他韦、金刚烷胺-D6、美金刚-D6标准品,用甲醇分别配制成100 μg/mL的标准储备溶液和内标储备溶液,于-20 ℃保存,有效期6 个月。量取适量的阿比多尔、金刚烷胺、金刚乙胺、美金刚、奥司他韦标准储备溶液和金刚烷胺-D6、美金刚-D6内标储备溶液,用甲醇稀释成1.00 μg/mL的5 种抗病毒药物混合标准中间溶液和2 种内标混合中间溶液,于-20 ℃保存,有效期3 个月。
1.3.2 色谱条件
MCX在线固相萃取柱(10 mm×1 mm);色谱分析柱:XBridge C18色谱柱(4.6 mm×150 mm,5 μm);流动相A为0.1%甲酸溶液;流动相B为乙腈;柱温40 ℃,进样量50 μL;经过在线固相萃取净化的样品直接注入色谱分析柱进行色谱分离。色谱分离程序见表1,在线净化程序见表2。

表1 色谱分离程序Table 1 Procedures of chromatographic separation

表2 在线固相萃取程序Table 2 Procedures of on-line SPE
1.3.3 质谱条件
(1)将配置好的黑色橡胶混合料运至摊铺区域,开始人工摊铺,控制好摊铺速度,以确保塑胶面层的密实度和平整度,将搅拌好的黑色橡胶颗粒用送料车送到铺设地点,用刮尺摊铺,均匀摊平。
扫描模式:电喷雾离子源正离子模式;检测方式:多反应离子监测;离子喷雾电压5 500 V;雾化器压力55 psi;辅助气压力60 psi;气帘气压力30 psi;碰撞气压力9 psi;离子源温度500 ℃;驻留时间50 ms。抗病毒类药物质谱检测参数见表3。

表3 抗病毒类药物的质谱参数Table 3 MS parameters for antiviral drugs
2 结果与分析
2.1 质谱参数优化
用蠕动泵以5 μL/min的流速向质谱仪中注入500 ng/mL的5 种抗病毒类化合物及2 种内标化合物标准溶液,分别在正、负离子模式下对目标物进行一级母离子扫描,实验发现,目标物在正离子模式下的灵敏度远高于负离子模式,这是由于抗病毒类化合物均含有胺基基团,容易被质子化,带正电荷。故确定目标化合物以[M+H]+作为母离子,对母离子进行子离子全扫描,确定其定性和定量离子。优化离子对的去簇电压、碰撞能量等参数。抗病毒类药物的质谱参数见表3,液相色谱-串联质谱图见图1。
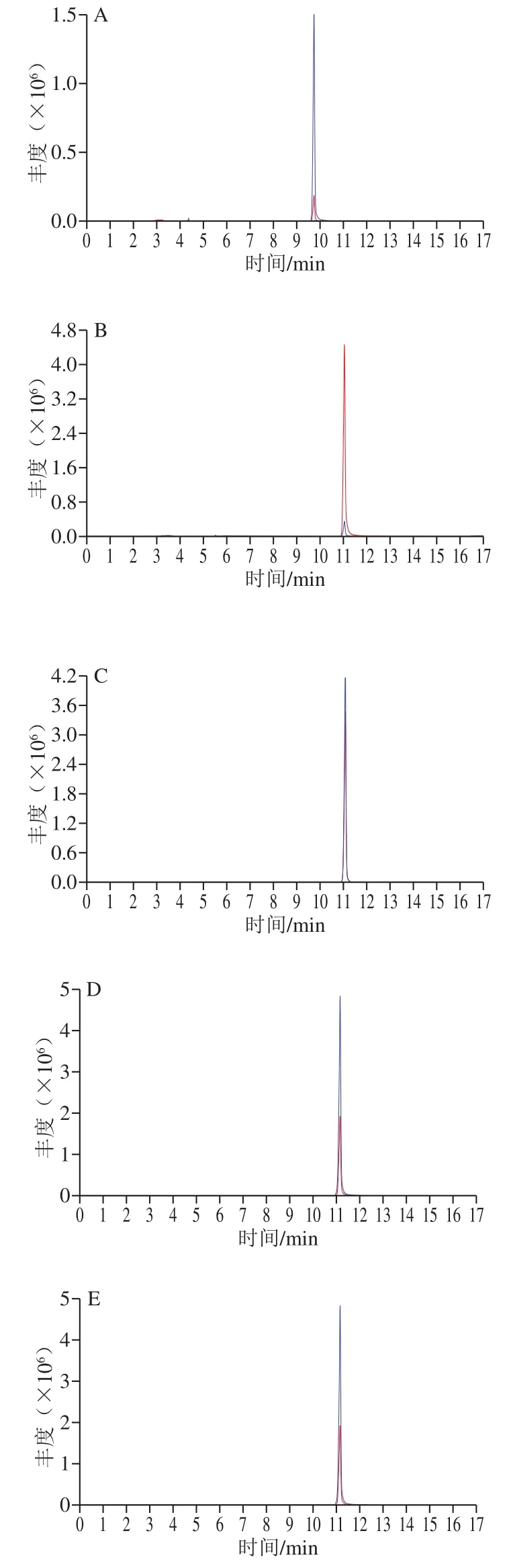

图1 抗病毒类药物的液相色谱-串联质谱图Fig.1 LC-MS/MS chromatograms of antiviral drugs
2.2 液相色谱条件优化
在线固相萃取过程中的洗脱液为5%氨水-甲醇溶液,洗脱液直接注入色谱分析柱,为使洗脱液中的目标化合物在色谱分析柱入口聚集,不发生扩散,色谱分离的初始流动相要保持高比例水相。实验比较了初始流动相中水相比例为90%、95%、97%和98%时,目标化合物在色谱柱上的保留情况,结果显示:水相比例为90%、95%时,目标化合物有扩散现象,峰形较差;水相比例增加至97%、98%时,目标化合物无扩散现象,峰形较好,考虑到水相比例为98%时,系统压力较高,故选取水相比例为97%。此外,在线固相萃取过程的洗脱流速为100 μL/min,为使整个系统流速之和保持不变,避免系统压力波动较大,出峰异常,需改变液相洗脱流速(0.6 mL/min→0.5 mL/min)。
实验考察不同流动相体系:水-乙腈、0.1%甲酸-乙腈、水-甲醇、0.1%甲酸-甲醇对目标化合物的色谱响应和峰形的影响。在电喷雾离子源正离子模式下,加入适量的甲酸能够提供更多的H+,有助于增强目标化合物的响应强度。流动相体系中有机相为甲醇和乙腈时,目标化合物的色谱响应和峰形差别不大,但甲醇作为流动相时,需要较长的平衡时间,且系统压力波动较大。故选择0.1%甲酸-乙腈作为流动相。
2.3 在线固相萃取条件的优化
2.3.1 洗脱流速
在线固相萃取过程中的洗脱流速直接影响洗脱效果。实验考察洗脱流速分别为100、150、200、250 μL/min对目标化合物的洗脱效果。如图2所示,洗脱流速为100 μL/min时,目标化合物的峰面积最高,色谱峰峰形良好;洗脱流速继续增大时,目标化合物的峰面积下降,这是由于洗脱流速过大,洗脱液与填料接触不充分导致洗脱不完全,故确定洗脱流速为100 μL/min。
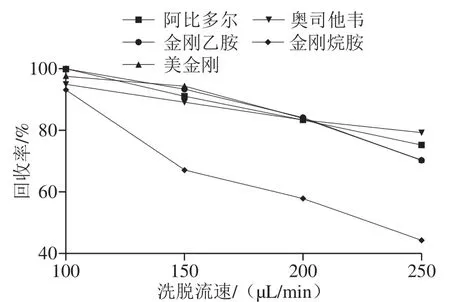
图2 洗脱流速对5 种抗病毒类化合物回收率的影响Fig.2 Effect of eluent flow rate on the recoveries of five antiviral drugs
2.3.2 洗脱体积
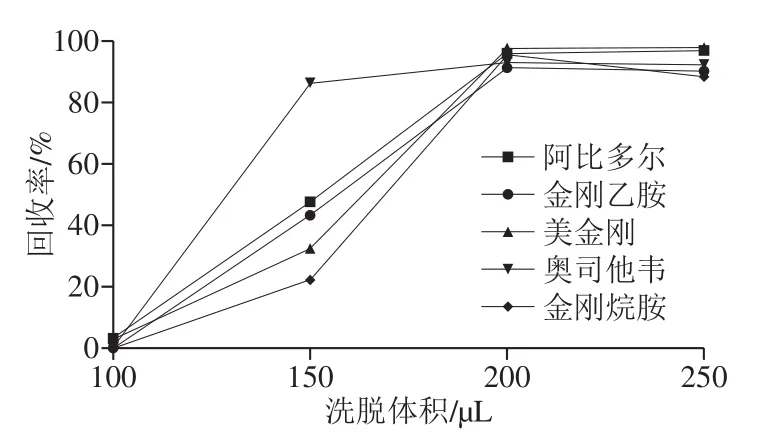
图3 洗脱体积对5 种抗病毒类化合物回收率的影响Fig.3 Effect of elution volume on the recoveries of five antiviral drugs
实验考察洗脱体积分别为100、150、200、250 μL对目标化合物的洗脱效果。如图3所示,洗脱体积为100 μL时,目标化合物峰面积为零;洗脱体积为150 μL时,洗脱液对目标化合物的洗脱不充分;洗脱体积为200 μL时,目标化合物的峰面积最大,峰形良好;洗脱体积250 μL时,目标化合物的峰面积保持不变,故确定洗脱体积为200 μL。
2.4 提取溶剂的选择
2.4.1 提取溶剂种类

图4 5种抗病毒药物在不同提取溶剂下的回收率Fig.4 Recoveries of five antiviral drugs extracted using various neat solvents
金刚烷胺、金刚乙胺、美金刚、奥司他韦和阿比多尔均含有极性基团,易溶解于极性有机溶剂中,据文献报道,抗病毒类药物残留检测常用的提取溶剂为甲醇、乙腈、丙酮、乙酸乙酯、二氯甲烷[28-31]等,实验考察上述有机溶剂对5 种抗病毒类药物的提取效果。如图4所示,乙腈作为提取溶剂时的提取效果较好,且乙腈可有效去除鸡肉和鸡蛋基质中的蛋白质,故乙腈可作为提取鸡肉和鸡蛋中5 种抗病毒类药物的首选溶剂。
2.4.2 提取溶剂配比
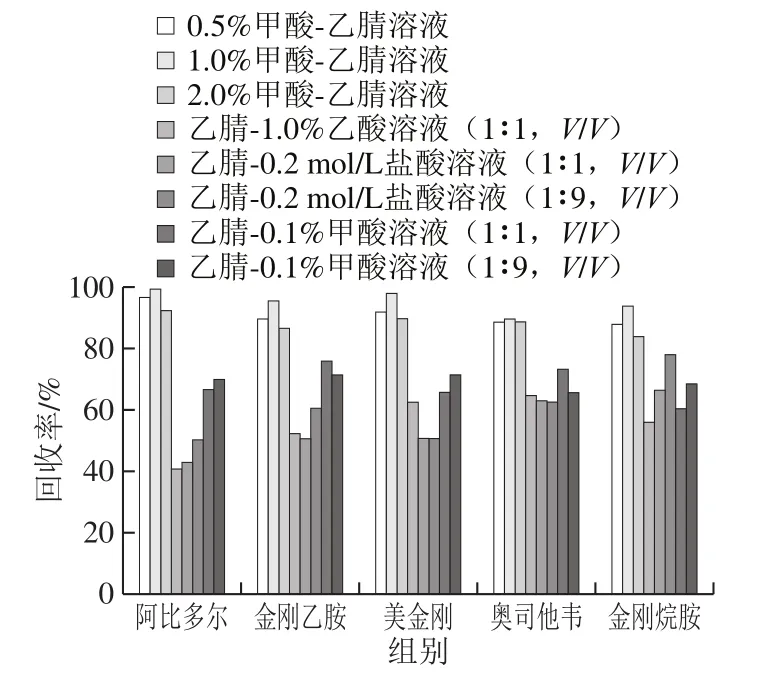
图5 5种抗病毒药物在不同提取溶剂下的回收率Fig.5 Recoveries of five antiviral drugs extracted using mixed solvent systems
此外,考虑到鸡肉基体杂质多,蛋白质、油脂含量较高,考察不同比例的甲酸、乙酸、盐酸与乙腈的提取效果。如图5所示,1.0%甲酸-乙腈溶液对5 种抗病毒药物的提取效果最好,回收率在89.75%~99.46%之间。这是因为质子化结构与酸根离子形成离子对后中和了目标化合物的电荷,促进了目标化合物向有机相迁移[32],且酸性提取有助于目标化合物离子化的形成,便于后续采用离子交换机理的在线固相萃取小柱净化[33]。故选用1.0%甲酸-乙腈溶液作为提取溶剂。
2.5 方法的线性关系、检出限和定量限结果
准确吸取5 种抗病毒药物混合标准中间溶液和2 种内标混合中间溶液,用乙腈配制系列标准溶液,内标质量浓度为10 ng/mL,美金刚-D6作为美金刚、金刚乙胺的内标物质,金刚烷胺-D6作为其余3 种抗病毒药物的内标物质,采用空白基质加标的方法确定方法的检出限(limit of detection,LOD)和定量限(limit of quantification,LOQ),RSN≥3和RSN≥10时对应的质量浓度分别作为LOD和LOQ。由表4可知,金刚烷胺在0.10~100 ng/mL质量浓度范围内线性关系良好;金刚乙胺、美金刚、奥司他韦、阿比多尔在0.05~100 ng/mL质量浓度范围内线性关系良好。金刚烷胺的LOD为0.10 μg/kg,LOQ为0.20 μg/kg;金刚乙胺、美金刚、奥司他韦、阿比多尔的LOD为0.05 μg/kg,LOQ为0.10 μg/kg,远低于我国行业标准SN/T 4253—2015《出口动物组织中抗病毒类药物残留量的测定 液相色谱-质谱/质谱法》[34]中抗病毒类药物的检测低限(1.0 μg/kg)和食药监食监三便函[2014]73号中金刚烷胺的检测低限(5.0 μg/kg)。

表4 5种抗病毒类药物的线性关系、LOD和LOQTable 4 Calibration equations, LOD and LOQ of five antiviral drugs
2.6 加标回收率结果

=6)Table 5 Recoveries and RSD of five antiviral drugs in spiked chicken meat and eggs (n= 6)表 5 鸡肉和鸡蛋中5 种抗病毒类药物的回收率和精密度(n
在空白鸡肉和鸡蛋基质中添加5 种抗病毒类药物进行加标回收率实验,共添加3 个水平,每个水平重复6 次。如表5所示,5 种抗病毒类药物在鸡肉基质中加标回收率在80.03%~93.61%之间,相对标准偏差(relative standard deviation,RSD)在0.2%~8.8%之间,在鸡蛋基质中加标回收率在80.82%~93.96%之间,RSD在0.7%~9.2%之间,回收率和精密度符合残留分析方法的要求。
2.7 实际样品检测
采用本方法,对市售20 份鸡肉和20 份鸡蛋样品进行检测,其中2 份鸡蛋样品检出金刚烷胺,含量为1 402 μg/kg和1 103 μg/kg。对于阳性样品,采用标准方法SN/T 4253—2015[34]再次进行检测,结果表明,本方法与标准方法的测定结果基本一致。但本方法在检测效率、检测成本、灵敏度等方面优于标准方法,SN/T 4253—2015中样品经提取后,采用离线固相萃取方法净化,净化步骤用时约2 h,步骤繁琐、耗时费力,容易引入人为误差,且固相萃取柱不能反复使用。本研究采用的在线固相萃取技术从净化到完成分析所用时间小于25 min,极大缩短了检测时间,操作简便,同一根固相萃取柱反复进样5 次,重复性和灵敏度仍然良好,有效降低了检测成本。仪器可自行更换固相萃取柱,过程中流量、流速可控,自动化和简便化的操作更好的提高了方法的回收率和准确度。
3 结 论
本研究建立鸡肉和鸡蛋中5 种抗病毒类药物的全自动分析方法。样品经1.0%甲酸-乙腈溶液提取,采用在线固相萃取-液相色谱系统完成净化与分离,串联质谱结合同位素内标法定量。该方法提高了检测效率,降低了检测成本,为鸡肉和鸡蛋中金刚烷胺、金刚乙胺、美金刚、奥司他韦和阿比多尔的批量检测提供技术支持,也可为其他基质中其他抗病毒类药物的快速检测提供方法参考。

