内镜黏膜下剥离术治疗早期胃食管交界处癌与胃癌的比较研究
宋雪梅,沙林玉,倪 永,李培培,于莲珍
南京医科大学第一附属医院消化科,江苏 南京 210029
内镜黏膜下剥离术(endoscopic submucosal dis⁃section,ESD)是治疗癌前病变、无淋巴结转移的早期胃癌的首选方法。ESD的应用提高了早期胃癌治愈性切除率,并使治愈性切除在特殊部位(如胃食管交界处和幽门)的肿瘤成为可能。与早期胃癌相比,ESD 在治疗早期胃食管交界处癌的治愈性切除率较低、手术时间较长、手术难度较大,因此,ESD在早期胃食管交界处癌的切除仍是一个技术难题。胃食管交界处是一个特别狭窄的区域,由于其尖锐的角度和狭窄的管腔,使得内镜操作难度大。早期胃食管交界处癌患者常选择外科手术治疗。外科手术治疗风险大,并发症多,术后生活质量降低。ESD治疗不仅可以避免外科手术风险,并发症少,还可以通过保留胃腔的完整性来提高患者的生活质量。目前少有研究关于ESD治疗早期胃食管交界处癌的疗效分析,本研究通过ESD治疗早期胃食管交界处癌和胃癌临床病理特征分析、ESD术后疗效分析及随访,旨在筛选早期胃食管交界处癌ESD治疗的高危人群,并为其治疗方案的选择提供参考,具体报道如下。
1 对象和方法
1.1 对象
收集南京医科大学第一附属医院消化科2013年1 月—2019 年2 月收治的338 例经ESD 术后病理证实为早癌的临床病理资料,并进行电话随访。根据患者的病灶位置分为早期胃食管交界处癌组157例,早期胃癌组181 例。纳入标准:①入院前未行相关治疗,ESD治疗后术后病理诊断为早癌;②既往无胃切除手术史或ESD治疗史;③随访资料较完整。排除标准:①合并其他恶性肿瘤;②凝血功能障碍;③妊娠期妇女。所有早癌患者在ESD 前均行腹部计算机断层扫描(computer tomograph,CT)及超声内镜检查(endoscopic ultrasond,EUS)。本研究经院伦理委员会批准,入选患者均签署手术知情同意书及获取临床资料知情同意书。
1.2 方法
收集所有患者临床病理特征、ESD 术后疗效及并发症等资料,通过电话、门诊系统进行随访以了解患者的生存、复发情况。
1.2.1 早期胃食管交界处癌的定义
早期胃食管交界处癌的定义为中心位于食管胃交界处2 cm以内的、局限于黏膜层及黏膜下层的肿瘤,不论其大小和有无淋巴结的转移[1]。
1.2.2 疗效评估相关定义
治愈性切除:病灶整块切除、垂直切缘与水平切缘阴性且无脉管浸润的满足以下条件的早癌:①直径>2 cm,无溃疡的分化型黏膜内癌;②直径≤3 cm,可伴溃疡的分化型黏膜内癌;③直径≤2 cm,无溃疡的未分化型黏膜内癌;④直径≤3cm,分化型浅层黏膜下癌。完全切除:水平和垂直切缘均为阴性的整块切除;手术时间是指从标记开始到肿瘤完全切除的时间。复发:术后在原切除部位以及周围1 cm 内发现肿瘤病灶[2]。
1.2.3 随访
自ESD术后第1天随访至2019年4 月30 日,ESD术后第3、6、12个月至门诊复查胃镜、腹部CT、肿瘤标志物,以后每年复查1 次胃镜。随访过程中发现肿瘤复发则根据个人情况行内镜下治疗或外科手术治疗。
1.3 统计学方法
采用SPSS 25.0 软件进行统计学分析。连续变量满足正态分布者采用独立样本t检验;分类变量两组间比较采用χ2检验或Fisher精确概率法。早期胃食管交界处癌临床病理特征的多因素分析采用Logistic 回归分析。生存率采用Kaplan⁃Meier 法计算,Log⁃rank检验用于单因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 早期胃食管交界处癌的临床病理特征
2.1.1 单因素分析
本研究共纳入338 例患者,其中早期胃食管交界处癌组157 例,早期胃癌组181 例。单因素分析显示,两组在年龄、性别、大体分型、病灶直径大小、病理类型、浸润深度、淋巴脉管浸润方面差异均有统计学意义。与早期胃癌组相比,早期胃食管交界处癌组年龄大(≥62.5 岁)(72.0%vs.51.9%,P<0.001),好发于男性(86.6%vs.71.8%,P<0.001),多见于平坦型(49.7%vs.27.6%,P<0.001),切除病灶直径大(≥3.6 cm)(62.4%vs.51.4%,P=0.041),多为分化型腺癌(93.0%vs.85.1%,P=0.022),黏膜下层浸润(27.4%vs.13.8%,P=0.002),不易淋巴脉管浸润(1.3%vs.5.5%,P=0.035)。而吸烟、饮酒、合并高血压、糖尿病、冠心病、有溃疡两者无统计学差异(表1、2)。
2.1.2 多因素分析
将提示有组间差异的指标纳入多因素分析,结果显示,年龄≥62.5 岁(OR 2.182,95%CI:1.330~3.581,P=0.002)、男 性(OR 2.299,95%CI:1.239~4.265,P=0.008)、平坦型(OR 2.497,95%CI:1.309~4.764,P=0.005)、分化型腺癌(OR 2.425,95%CI:1.029~5.714,P=0.043)及黏膜下层浸润(OR 2.939,95%CI:1.567~5.512,P=0.001)为早期胃食管交界处癌的独立危险因素。而切除病灶直径及淋巴脉管浸润不是早期胃食管交界处癌的独立危险因素(表3)。
2.2 ESD治疗早期胃食管交界处癌疗效分析
2.2.1 短期疗效
早期胃食管交界处癌组手术时间较胃癌组长[(104.14 ± 58.49)minvs.(73.39 ± 45.06)min,P<0.001],治愈性切除率低于胃癌组(70.7%vs.80.7%,P=0.032),差异有统计学意义;而整块切除率(99.4%vs.99.4%,P=1.000)、完全切除率(91.1%vs.90.6%,P=0.880)两者无统计学差异(表4)。

表2 早期胃食管交界处癌与胃癌患者的内镜下特征资料Table 2 Endoscopic characteristics of patients with early gastroesophageal junction carcinoma and gas⁃tric cancer
2.2.2 长期疗效
2.2.2.1 总生存率及总复发率
早期胃食管交界处癌组和胃癌组两组平均随访时间为69.7 个月,5 年总生存率分别为97.8%和94.6%,Kaplan⁃Meier分析显示,两组总生存率差异无统计学意义(Log⁃rankP=0.889,图1)。早期胃食管交界处癌组与胃癌总复发率分别为5.1%(8/157)和4.4%(8/181),两组差异无统计学意义(P=0.770。
2.2.2.2 治愈性切除患者中生存率及复发率
早期胃食管交界处癌组和胃癌组两组中治愈性患者分别有111 例和146 例,两组治愈性切除患者5 年生存率分别为97.2%和97.9%,Kaplan⁃Meier分析显示,两组差异无统计学意义(log⁃rankP=0.712,图2)。早期胃食管交界处癌组与胃癌治愈性切除患者复发率分别为3.9%(4/111)和4.1%(6/146),两组差异无统计学意义(P=1.000)。
2.3 早期胃食管交界处癌非治愈性切除的影响因素
单因素分析显示,早期胃食管交界处癌非治愈性切除与病灶直径≥2 cm(91.3%vs.67.6%,P=0.002)、未分化腺癌(21.7%vs.0.9%,P<0.001)、黏膜下层浸润(60.9%vs.13.5%,P<0.001)、淋巴脉管浸润(4.3%vs.0,P=0.027)、有溃疡(23.9%vs.5.4%,P<0.001)相关,差异有统计学意义;非治愈性切除率与大体分型无关(表5)。
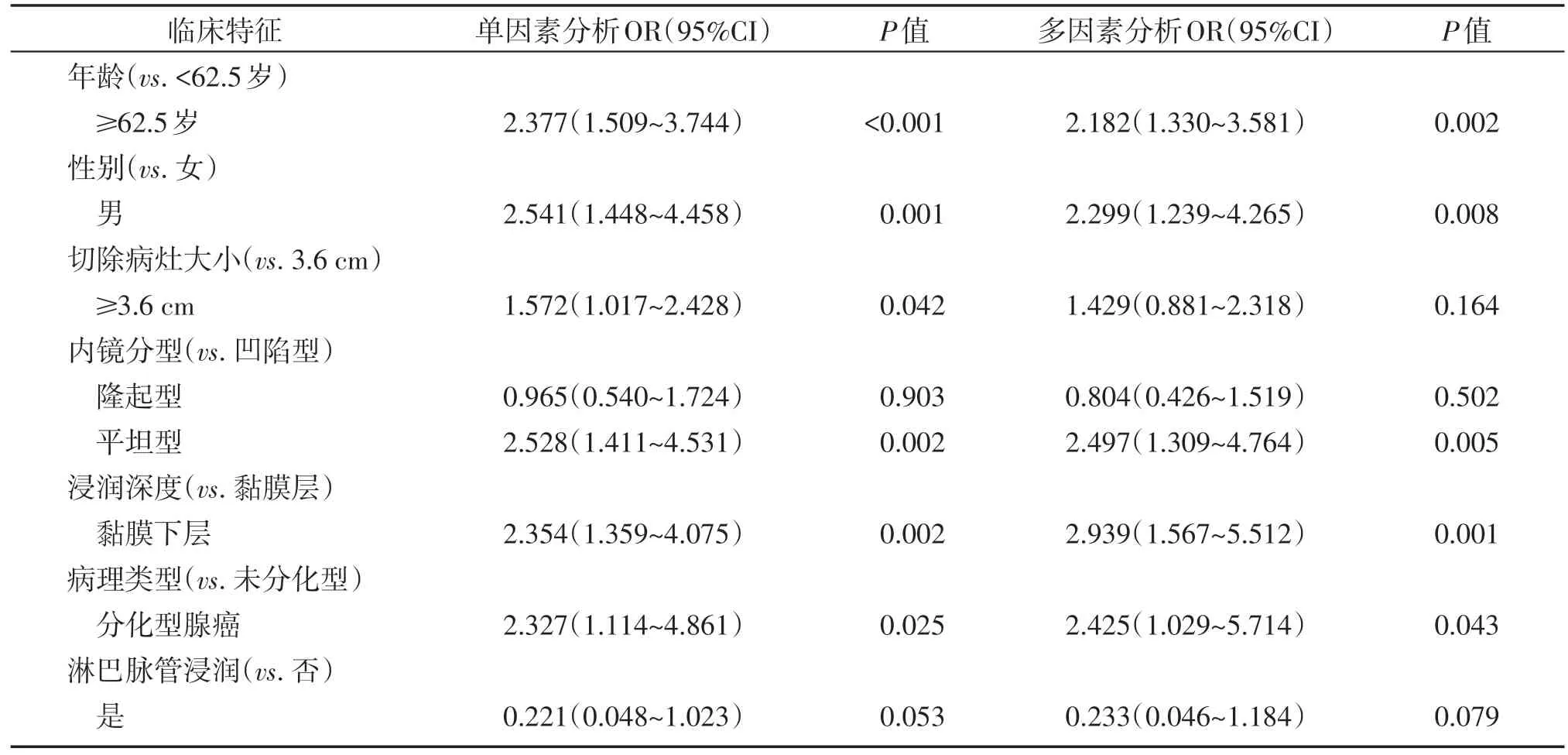
表3 早期胃食管交界处癌临床特征的单因素及多因素分析Table 3 Univariate analysis and multivariate analysis of clinical characteristics of early gastroesophageal junction carcinoma
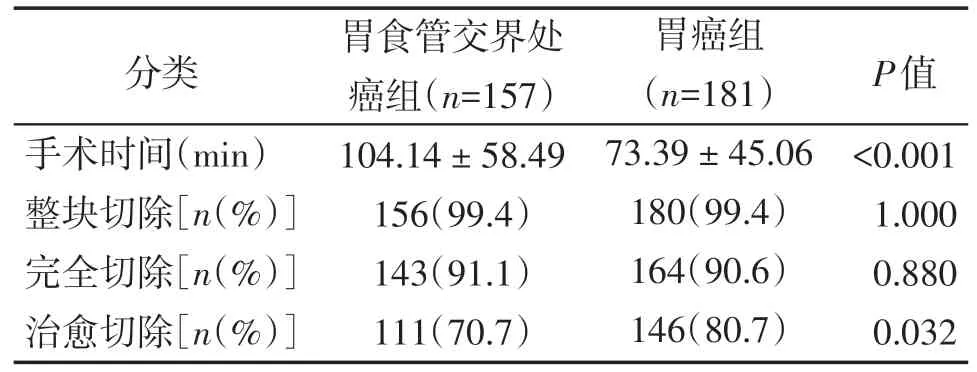
表4 ESD 治疗早期胃食管交界处癌与胃癌患者的短期疗效比较Table 4 Comparison of short⁃term efficacy of ESD in the treatment of early gastroesophageal junction car⁃cinoma and gastric cancer

图1 早期胃食管交界处癌与胃癌患者的K⁃M生存分析比较Figure 1 Comparison of K⁃M survival analysis between patients with early gastroesophageal junction carcinoma and gastric cancer
2.4 早期胃食管交界处癌ESD治疗的并发症分析
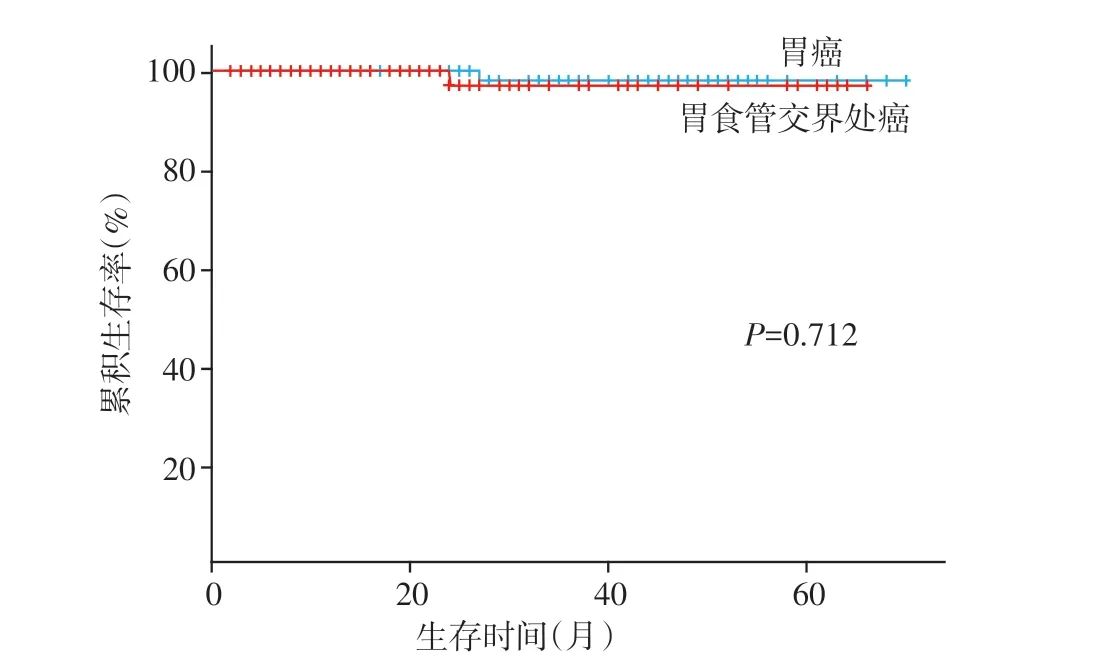
图2 早期胃食管交界处癌与胃癌治愈性切除患者的K⁃M生存分析比较Figure 2 Comparison of K⁃M survival analysis between patients with early gastroesophageal junction carcinoma and patients with gastric cancer cured by resection
早期胃食管交界处癌组术后出血率是3.2%,穿孔率是0.6%,狭窄率是2.5%;早期胃癌组术后出血率是5.0%,穿孔率是0.6%,狭窄率是0.6%,两组在出血、穿孔及狭窄差异无统计学意义(表6)。所有并发症均经保守及内镜治疗成功。
3 讨论
全球范围内胃癌的发病率呈稳定下降趋势。与胃癌的下降模式相反,胃食管交界处癌的发病率有所上升[4]。然而,我国对早期胃食管交界处癌的研究较少。随着内镜技术的飞速发展,早期胃食管交界处癌检出率逐步提高。多年来,食管切除术加部分胃切除术或全胃切除术是早期及进展期胃食管交界处癌患者的治疗方法,能达到肿瘤及淋巴结的治愈性切除。然而,外科手术治疗早期胃食管交界处癌严重影响了患者的生活质量,随着内镜发展,与外科手术相比,ESD创伤小、住院时间短、住院费用少、保留脏器结构完整性且术后并发症少[3,5],越来越多的患者选择ESD治疗早期胃食管交界处癌。

表5 非治愈性切除率的影响因素Table 5 Risk factors of non⁃curative resection rate [n(%)]

表6 ESD 治疗早期胃食管交界处癌与胃癌患者的并发症比较Table 6 Comparison of complications of ESD treatment in patients with early gastroesophageal junction carcinoma and gastric cancer [n(%)]
本研究根据患者的临床特征、内镜及组织病理结果发现,年龄≥62.5岁、男性、平坦型、分化型腺癌及黏膜下层浸润为早期胃食管交界处癌的独立危险因素。Kim 等[4]回顾性分析了829 例早癌患者的临床病理资料,多因素分析显示年龄≥60岁、男性与胃食管交界处癌的发生相关。Heidl等[6]纳入354例胃食管交界处癌与1 256例胃癌,对比发现胃食管交界处癌好发于男性,更易黏膜下层浸润;Osumi等[7]研究发现,早期胃食管交界处癌具有年龄大、直径大、大体类型非隆起型等特点。年龄≥62.5岁的男性行胃镜检查时,因早期胃食管交界处癌平坦型易被漏诊,尤其需要仔细观察胃食管交界部,以达到早期诊断。早期胃食管交界处癌虽病理分化良好,但更易黏膜下层浸润,因此应尽早行ESD治疗。
本研究中,早期胃食管交界处癌的治愈性切除率为70.7%,手术时间为(104.14±58.49)min,Omae等[8]对44 例患者进行的回顾性研究表明早期胃食管交界处癌的治愈性切除率为68%;Li 等[9]对41 例直径≥3 cm 的早期胃食管交界处癌患者的治愈性切除率为81.7%,手术时间为(69.3±32.7)min。Jang等[10]进行的单中心研究表明早期胃食管交界处癌的治愈性切除率为71%。早期胃食管交界处癌,由于其位置特殊,该部位的内镜治疗操作复杂,使得切除难度增加,这可能是导致早期胃食管交界处癌的治愈性切除率较低、手术时间过长的原因。本研究中,病灶直径≥2 cm、未分化腺癌、黏膜下层浸润、淋巴脉管浸润及有溃疡是早期胃食管交界处癌非治愈性切除的危险因素。Omae 等[8]对44 例患者进行的回顾性研究表明早期胃食管交界处癌患者中黏膜下层浸润、淋巴脉管浸润以及低分化腺癌在非治愈性切除病例中更为常见。Jang等[10]提出病理类型差、病灶位于贲门前壁,肿瘤直径≥2 cm、黏膜下层浸润的早期胃食管交界处癌治愈性切除率降低。因此,本文建议病灶直径≥2 cm、病理类型分化差、黏膜下层浸润、淋巴脉管浸润、有溃疡的早期胃食管交界处癌在行ESD治疗时需格外关注,在ESD操作过程中可扩大标记范围,以尽可能达到治愈性切除。
本研究中尽管早期胃食管交界处癌的治愈性切除率低,手术时间长,但其总复发率及5年总生存率分别为5.1%、97.8%,在治愈性切除患者中复发率及5年生存率分别为3.9%、97.2%,与早期胃癌组相比差异无统计学意义。有研究报道了ESD 用于治疗早期胃食管交界处癌的总复发率及5年总生存率分别为0.5%~7.7%、94.2%~99.1%[11-12],但是没有进行早期胃食管交界处癌与胃癌的比较,亦没有进行治愈性切除患者的比较。Hoteya 等[13]分析了Barrett食管腺癌、胃食管交界处癌和胃癌的长期预后,5年总生存率分别为74.3%、94.3%和93.6%,差异无统计学意义(P=0.078)。基于早期胃食管交界处癌ESD 有较好的长期疗效,更应使用ESD 治疗早期胃食管交界处癌。
本研究结果显示,年龄≥62.5岁、男性、平坦型、分化型腺癌及黏膜下层浸润为早期胃食管交界处癌的独立危险因素;早期胃食管交界处癌与胃癌相比,虽然ESD 治疗治愈性切除率较低、手术时间较长,但是并发症、总复发率、总生存率、治愈性切除患者复发率及生存率两者差异无统计学意义。因此ESD 是治疗早期胃食管交界处癌的安全有效治疗方法,但病灶直径≥2 cm、病理类型分化差、黏膜下层浸润、淋巴脉管浸润、有溃疡的早期胃食管交界处癌ESD治疗治愈性切除率降低,在行ESD治疗时需格外关注,在ESD 操作过程中可扩大标记范围,以尽可能达到治愈性切除。

