CT引导下经皮穿刺肺活检对肺门部结节的诊断价值
王 芬,朱佳佳,张 伟,徐 海,张 腾,仲 艳,刘希胜,袁 梅,俞同福
南京医科大学第一附属医院放射科,江苏 南京 210029
CT引导下经皮穿刺肺活检术(CT⁃guided percu⁃taneous lung biopsy,CT⁃PTLB)目前在肺部周围性肺结节的诊疗应用较广泛。CT⁃PTLB 和支气管内超声(endobronchial ultrasound,EBUS)引导经支气管活检(transbronchial biopsy,TBB)可用于诊断肺门部病变[1],鉴于肺门部位肿块的特殊性,纤维支气管镜检查应用较多,但对管外型结节诊断率低[2]。EBUS⁃TBB 后肺部病变的不可诊断结果发生率为24%~50%[3-4]。CT⁃PTLB 肺门部位较大肿块的穿刺活检成功率高[3-4],既往报道活检阳性率可达100%,并发症发生率约45%[2,4],但对于肺门部结节的穿刺报道较少。本研究旨在探讨CT⁃PTLB 对肺门部结节(直径≤3 cm)的诊断价值及安全性、可行性。
1 对象和方法
1.1 对象
选取南京医科大学第一附属医院2016 年7 月—2020 年2 月65 例肺门部结节行CT⁃PTLB 患者进行回顾性分析,缺失活检结果1例,予以排除后入组患者64例,其中,男48例,女16例,年龄17~81岁,平均年龄(61.2±11.5)岁;所有患者具有纤维支气管镜检术病理检查阴性病史,其中2例3 次检查阴性,所有患者术前均有胸部CT 增强检查资料提示结节与心脏大血管关系密切,结节最大径1.9~3.0 cm,平均直径(2.5±0.4)cm。本研究经医院伦理委员会批准,患者知情同意。
1.2 方法
1.2.1 CT⁃PTLB
扫描设备采用Siemens 16排螺旋CT机,穿刺用具包括自制体表定位不透光金属栅栏、一次性18 G半自动活检针及17 G同轴定位针。
入组患者穿刺活检前均行胸部CT增强检查,术前完善血常规、凝血功能、心电图、血压等检查。明确禁忌证包括有导致凝血功能障碍且无法纠正的疾病、有剧烈咳嗽或其他情况不能配合检查过程、病灶与肺门部大血管关系紧密无法取材等。确保患者凝血功能无异常及未服用抗凝药或停用抗凝药1 周情况。术前告知患者术中、术后相关风险及并发症,征得患者知情同意后,训练患者术中特殊情况的配合方式并检查患者术中配合性,选择合适体位,双手臂上举,充分暴露穿刺部位。操作区域置备好相关急救用品。
CT⁃PTLB都是由有5 年以上活检经验的胸部放射科医师进行。操作步骤:术者根据患者术前增强CT 资料,明确病灶与肺门血管及支气管之间的关系,指导患者摆好穿刺体位,贴好体表定位不透光金属栅栏,根据栅栏所固定的范围行部分胸部CT连续扫描,根据体表定位不透光栅栏确定穿刺点、进针角度、穿刺径路及其长度,确定穿刺点后消毒、铺洞巾,2%的盐酸利多卡因5 mL 皮下逐层局部浸润至胸膜后,进17 G同轴定位针,过程中需CT扫描监测并确定针尖与病灶的关系,调整针尖至合适位置后,抽出针芯,沿针套固定途径进一次性18 G 半自动活检针,再根据针尖与病灶延长线上针尖点与临近血管组织结构或结节远处交点距离设置弹射深度(通常取1.0~2.0 cm),切割取材时需避开大血管、气管及坏死、囊变等部位,必要时调整活检针尖角度行多点取材,尽量使活检组织包含肿瘤组织。取材时留意患者疼痛反应及并发症等情况决定取材数量,基因检测者取材至少3 条。取材样本置于10%福尔马林溶液固定送至病理科。穿刺结束后,针对穿刺部位周围层面再行检查,观察术后即刻并发症情况,若有中大量气胸(同侧肺组织受压程度超过30%)或气胸导致呼吸不畅、严重咯血、针道周围渗血不止、胸膜反应等相关严重并发症,需采取抽气引流、止血、吸氧等相应对症治疗措施,明确患者一般情况良好,嘱托其穿刺后注意事项准予患者离开。
1.2.2 数据收集及评估标准
收集数据包括:患者年龄、性别;结节形态特征、轴位最大径;切割次数、穿刺径路长度、进针角度(针尖穿刺径路与胸膜切线的锐角角度[5],分为≤60°和>60°)、肺气肿情况及病灶与叶间裂关系;标本病理结果、免疫组化、基因检测等;并发症情况及报告中提及的处理措施。
病理结果根据文献中提及未明确诊断病变包括存在正常肺组织成分、非典型细胞、非特异性炎症细胞、不能解释及无具体诊断的病例,未明确诊断病理后期需随访或手术证实良恶性[5]。良性病变包括良性肿瘤(错构瘤)、肉芽肿性病变、机化性肺炎或培养阳性的细菌、真菌等[5]。恶性病变为第一次活检组织证实的肺癌。假阴性率(漏诊率)=(未明确诊断病例再次活检标本、外科手术后证实为恶性病变例数)/(活检样本确诊恶性病变例数+未明确诊断病例再次活检标本、外科手术后证实为恶性病变例数)×100%;穿刺准确率=(入组例数-漏诊例数)/入组例数×100%;灵敏度=(活检样本确诊恶性病变例数)/(活检样本确诊恶性病变例数+漏诊恶性病变例数)×100%。
并发症出血的严重程度评估根据Tai 等[6]提及的肺出血分级标准:无出血灶为0 级;针道周围≤2 cm 出血范围为1 级;2 cm 以上和近基底部出血灶为2 级;出血范围至少达1 个肺叶为3 级;形成血胸为4级。2级或以上出血灶为高级别出血,即术后即刻CT上出血灶的长轴和短轴直径均≥2 cm。
1.3 统计学方法
通过SPSS22.0 软件对观察指标相关数据资料进行统计分析。均数±标准差()表示计量资料;计数资料及等级资料以百分比(%)表示。通过二元Logistic回归对并发症(气胸、出血)的影响因素进行统计分析,并以二元Logistic回归的可视化森林图表现并发症的危险因素,P<0.05 为差异有统计学意义。
2 结果
2.1 病变活检
64例患者穿刺活检过程进展顺利,穿刺活检标本病理检测诊断为恶性病变55例,其中腺癌29例、鳞癌14例、小细胞肺癌5例、混合性癌6例及转移癌1例。2例特异性感染、7例未明确诊断。本研究中7例未明确诊断性病变有6例非特异性炎症细胞,1例后经手术证实为恶性病变(穿刺标本诊断结果及评估标准见表1)。29 例腺癌患者中12 例行EGFR 各位点、ALK 及ROSI 融合基因检测、KRAS 等基因检测;其中7 例表现为EGFR 基因突变,4 例19 外显子突变型、3 例21 外显子(p.L858R)位点突变。2 例表现为ALK 融合基因突变型。在最终的病理结果中本研究中非明确诊断病变中6 例在后期CT 随访中病灶变小或未见明显变化而归为良性,而另1 例行外科手术切除后,病理证实为鳞形细胞癌。

表1 穿刺标本诊断结果及评估标准Table 1 Diagnostic results and evaluation criteria of puncture specimens
2.2 并发症
术后即刻胸部CT复查发现10例患者出现并发症气胸及28例患者出现肺内出血灶,10例气胸患者仅1 例有中等量气胸,出现呼吸不畅,术后即刻CT复查时予以抽气后,气胸量增加则行胸腔置管引流治疗,另1例出现少量咯血(表现为痰中带血),给予止血药蛇毒血凝酶肌注后缓解,其余患者未予特殊处理措施。所有患者均无胸膜反应、空气栓塞等严重并发症的发生。并发症情况除从放射学报告中获取外,另由2 名胸部影像学诊断医师综合分析穿刺术后即刻CT图像所得(穿刺过程见图1)。
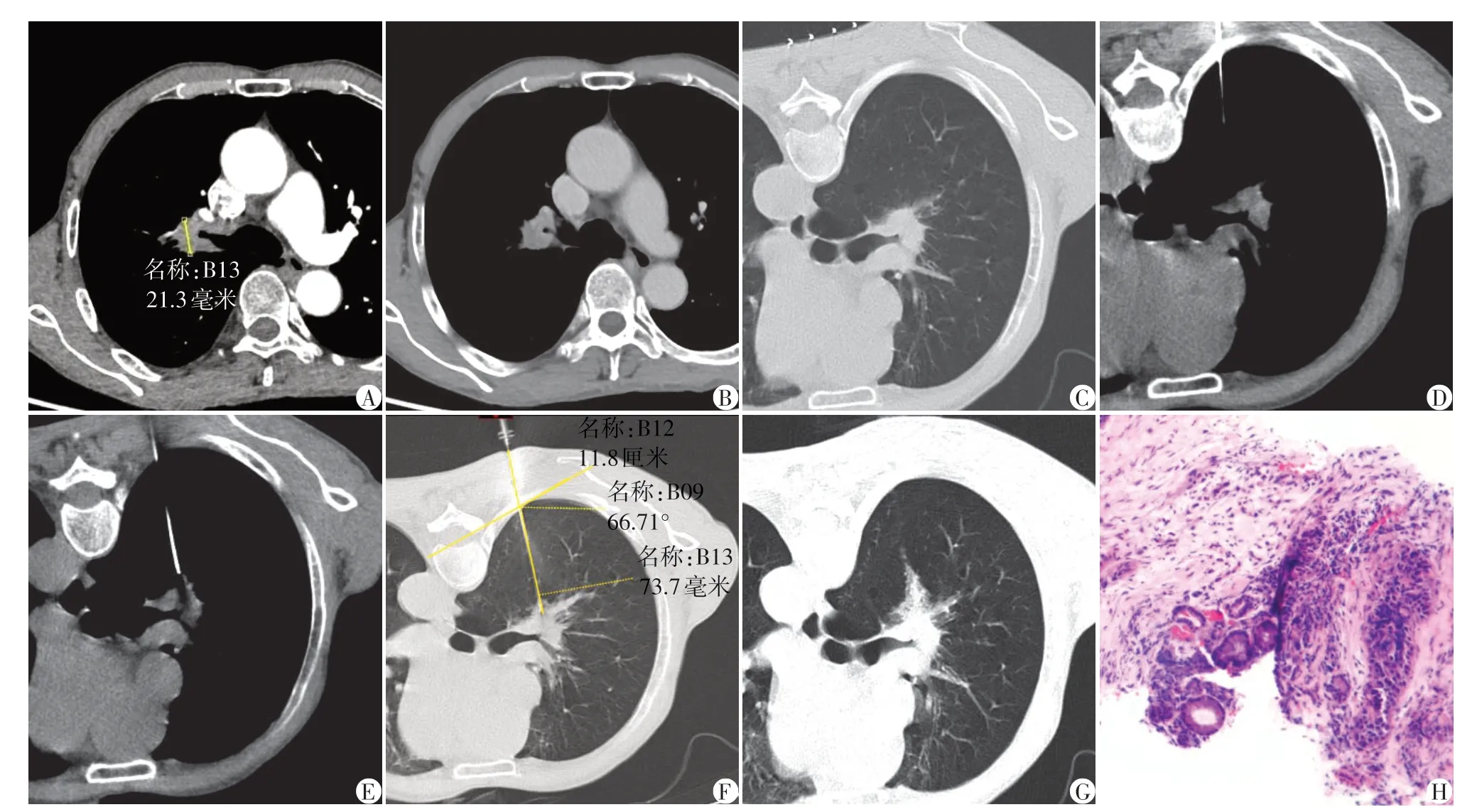
图1 1例73岁男性患者右肺门结节CT引导下经皮肺穿刺活检过程及病理结果图Figure 1 The process of CT⁃PTLB of right hilar nodule and histology for a man aged 73
并发症情况见表2,分析观察指标中与并发症气胸及出血发生的关系见图2、3。

表2 CT引导下经皮穿刺肺活检术后并发症的发生情况Table 2 The complications of CT⁃PTLB
3 讨论
作为一种安全有效的非血管介入术,对不符合外科手术要求的肺癌患者,穿刺活检的小样本病理检查为放化疗及靶向等替代治疗提供了帮助[7],随着CT 设备及穿刺操作器械的更新换代[8],CT 引导下经皮穿刺肺活检在肺部病变中的应用得到推广,使肺门部病变的检查不再局限于纤维支气管镜检查及气管内超声引导下经支气管活检等侵入性检查[9]。
3.1 肺门部结节穿刺活检可行性及诊断价值
肺门部疾病因其独特的占位效应可致临近肺组织伴有阻塞性肺炎或肺不张改变,可导致纤维支气管镜及气管内超声引导下经支气管针吸活检术的不足。由于肺门部结节周围为大血管,穿刺容易造成大血管损伤。肿瘤组织也可包埋肺门部血管,出血通过邻近主气道易致咯血或窒息[10],纤维支气管镜及气管内超声引导下经支气管针吸活检术对管外型生长的中央型肺癌的诊断价值较差[11],CT引导下经皮穿刺肺活检术正好弥补了以上技术的不足,但术前需仔细评估患者的胸部增强CT 图像,明确病灶与血管的关系,确定好穿刺进针路径,避免对邻近大血管损伤,术后即刻CT肺窗下观察肺组织的变化情况。相对于周围型病变,呼吸对中央型病变的影响小[10],留意患者肺气肿情况,选择较好的穿刺路径、减少切割次数等措施可减少并发症的发生。本研究穿刺过程中64例中出现1例假阴性,术后证实为鳞形细胞癌,穿刺技术准确率为98.44%,灵敏度达98.21%,准确率与廖江荣等[2]报道的取材准确率达97.10%较一致。
3.2 并发症气胸
CT 引导下经皮穿刺肺活检术在临床应用中的并发症以气胸及肺内出血常见[2,6,16]。YIN等[10]所报道的48 例肺门部肿块的穿刺活检术后气胸发生率27.10%(13/48)、14 例发生肺内出血(29.10%,14/48)。本次研究中并发症主要为少量气胸(15.60%,10/64)及肺内出血灶(43.80%,28/64)。由于本研究中符合入组要求的男性老年患者居多,这在一定程度上影响与性别、年龄相关的结果,Sattar 等[12]单因素分析气胸发生的影响因素时,男性患者气胸发生率为85%,本组研究发现男性患者与气胸发生具有相关性(P=0.003)。检查体位对气胸产生的影响在多数报道意见不一[12-13],本研究未发现具有相关性,与部分报道结论一致[13]。穿刺路径长度合理选择对气胸的影响较大(OR 值>1)。以往研究认为较大的穿刺路径或病变深度与气胸的风险增加有关。最大径≤2 cm 的病变气胸发生率高[13],但也有部分研究未能发现气胸发生和病变大小之间的相关性[13-14]。本组研究结论与既往部分研究中提及病灶大小导致气胸发生的结论不一致,主要可能为病灶大小相关的选择性偏倚及技术操作的差异所致。穿刺活检后发生气胸的机制多数认为是穿刺过程中呼吸等原因引起胸膜和正常肺组织撕裂,撕裂处的空气泄漏所致[13]。
3.3 并发症肺内出血
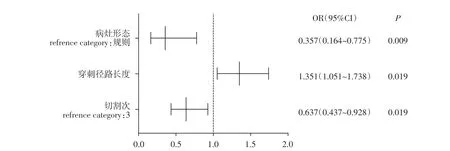
图2 肺门部结节穿刺活检术后并发症肺内出血发生的影响因素二元Logistic回归分析可视化森林图Figure 2 The forest plot of binary logistic regression on factors of intrapulmonary hemorrhage after hilar nodule biopsy

图3 肺门部结节穿刺活检术后并发症气胸发生的影响因素二元Logistic回归可视化森林图Figure 3 The forest plot of binary logistic regression on factors of pneumothorax after hilar nodule biopsy
既往相关研究表明女性、年龄较大、肺气肿患者、采用同轴技术、距胸膜较远病灶、病变大小≤3 cm和亚实性结节更易发生高级别出血[5]。高级别肺内出血灶为穿刺术后病灶周围或沿针道的片状磨玻璃实变影。而本研究中高级别出血灶11 例(2.2 cm×2.9 cm~3.8 cm×4.9 cm),低级别出血灶17例(1.6 cm×1.2 cm~2.0 cm×1.6 cm),所有出血灶分级均不超过2 级。在二元Logistic 回归可视化森林图分析中发现,病灶形态和切割次数为发生高级别出血灶并发症的保护因素(OR=0.115<1),穿刺路径长度为独立危险因素,即穿刺路径越长越危险。由于以往研究选择的病灶以最大径3 cm[6]或最大径4 cm[12]作为参考点,此次研究中纳入较多最大径2~3 cm 的病灶,故未能与以往报道中病灶大小为肺内出血影响因素这一观点契合,但发现穿刺活检术后发生病灶及针道周围出血的比例较高(43.8%,28/64),可能与病灶位置较深、穿刺路径长度较大有关。有报道仅从单变量分析发现CT 穿刺活检术后女性患者更容易发生出血[6,15],本组未发现穿刺术并发症出血与性别的相关性,主要与入组患者以男性为主有关。既往研究少有发现病灶形态对出血发生的影响,但Khan等[13]曾提出病灶形态与并发症出血相关的假设:与光滑规则的病变相比,毛刺样不规则病变可使周围血管密度较高而导致活检术后出血。由于肺门部支气管血管束丰富,且肺门部结节的穿刺路径通常较长,穿刺针会切断穿刺路径的一些小血管引起出血后发生支气管堵塞,后期体位变动后出血可出现咯血。虽然同轴技术固定了穿刺路径,不必反复进针取材,但是切割次数的增加也会引起穿刺点周围小血管被损伤引起出血。本研究发现边缘光滑规则的病变和较少的切割次数为保护因素,边缘毛刺、形态不规则的病灶易发生出血(68.80%,44/64),与Khan 等[13]假设贴近,但由于病例数太少,仍需进一步前瞻性研究加以证实并研究病灶形态对出血分级的影响。术后严重咯血者可能会导致窒息,故穿刺术后需密切关注术后病情变化。对于并发症出血情况的处理需综合患者穿刺术后的表现,迟发性咯血或顽固性咯血现象则进行对症处理及观察。本组1例患者发生肺内出血后休息观察期间出现轻微咯血,后予止血剂肌肉注射后缓解。所有入组患者并未发生严重咯血及气胸、胸膜反应、血胸、空气栓塞等并发症。
3.4 研究局限性
本次研究为一项回顾性研究,难以避免选择偏倚的存在;一些最终诊断结果也是基于影像和临床随访定论,其中未能明确诊断病变中的部分良性病变缺少手术切除后标本的病理确诊。针道周围出血灶的观察测量具有一定主观性,可能导致偏差。
综上所述,肺门部病变的定性诊断方法不再局限于支气管镜下活检等技术,CT引导下经皮穿刺肺活检技术对于肺门部结节的应用是可行的,其高准确性、微创性等特点可为患者的早期诊断提供依据。临床工作中减少切割次数,控制好穿刺路径长度,选择较大的病灶层面,避开较大的血管支气管,注意患者配合性等措施对并发症的控制有一定作用。

