体部弥漫大B淋巴瘤PET⁃CT脑葡萄糖代谢改变情况分析
李洋洋,丁重阳,郭 喆
南京医科大学第一附属医院核医学科,江苏 南京 210029
众所周知,很多肿瘤患者存在神经精神症状,而且现代神经生物学也认为大脑与肿瘤的发生发展有着潜在的关联。临床工作及相关研究也发现很多肿瘤存在特定的脑代谢改变模式[1-3],即使是脑部MRI未发现任何异常;脑代谢改变多以皮层代谢不同程度的减低为主,这种情况在血液系统疾病中最为常见,而血液系统恶性病变中以体部弥漫大B淋巴瘤(diffuse large B⁃cell lymphoma,DLBCL)最为常见,因此,为了避免入组对象对研究结果的影响,本研究选择无神经系统受累的DLBCL 患者作为研究对象,采用统计参数图(statistical parametric map⁃ping,SPM)方法分析患者脑葡萄糖代谢改变模式。肿瘤总体积(whole⁃body metabolic tumor volume,MT⁃Vwb)及肿瘤糖酵解总量(whole⁃body total lesion gly⁃colysis,TLGwb)是18氟⁃脱氧葡萄糖(18F⁃fluorodeoxy⁃glucose,18F⁃FDG)正电子发射计算机断层显像(PET⁃CT)葡萄糖代谢的重要参数,研究同时分析体部MTVwb、TLGwb与脑代谢的相关性。
1 对象和方法
1.1 对象
入选南京医科大学第一附属医院2017 年1 月—2020 年7 月确诊的DLBCL 患者52 例作为DLBCL组,其中男33 例,女19 例,年龄20~85 岁,平均(59.96±14.01)岁。纳入标准:①年龄>18 岁,首次发现病变,未进行任何治疗。②影像学检查无颅内病变,如肿瘤、外伤及血管性病变等。③重要脏器无器质性病变,无糖尿病及精神疾病。同时对照组选择52 例年龄、性别匹配的健康体检者,男33例,女19 例,年龄21~83 岁,平均(57.63±12.41)岁,所有健康对照组均来自本院健康体检受试者,入选标准为:无高血压、糖尿病病史,无头外伤、神经精神疾病、代谢性疾病以及其他可能会影响神经系统的全身性疾病。本研究经院伦理委员会批准,所有入选患者及健康对照受试者均签署知情同意书。
1.2 方法
1.2.118F⁃FDG PET⁃CT显像
入选患者及健康对照组均接受德国Siemens公司Biograph 16 True Point 型PET⁃CT 体部及脑部扫描。PET 显像剂18F⁃FDG 由本院PET⁃CT 中心生产合成,放射化学纯度>95%,受试者检查前禁食4~6 h,注射前空腹血糖水平3.9~6.1 mmol/L,按3.70~5.55 MBq/kg 静脉注射18F⁃FDG 后安静环境休息50~60 min,排尿后进行图像采集。采集PET⁃CT体部及脑部图像,采用滤波反投影重建得到横断面、冠状面、矢状面断层图像。
1.2.2 脑部视觉分析
由2 名主治以上PET⁃CT 诊断医师通过工作站软件独立完成,视觉分析内容包括:①横断面、冠状面、矢状面断层图像重建及位置校正是否正确;②是否存在脑萎缩,大脑皮层放射性分布是否均匀、对称;③皮层下核团结构是否完整、清晰,放射性分布是否均匀,放射性摄取程度是否增高或减低;小脑放射性分布是否对称。
1.2.3 体部病灶半定量测量
采用肿瘤代谢评估程序对采集的体部PET 和CT 数据进行处理,将最大标准摄取值(standardized uptake value,SUV)高于1.5 倍肝脏平均SUV 值和2倍肝脏平均SUV 值标准差之和的病灶设为体部可测量病灶,沿体部每个18F⁃FDG 可测量病灶勾画感兴趣区(region of interest,ROI),采用相对阈值法,以SUVmax 的40%为阈值[4],软件自动进行容积分隔,得到体部每个可测量高代谢灶的MTV和TLG,并计算体部总MTVwb和TLGwb。
1.3 统计学方法
将两组受试者的脑PET 图像数据采用MRI⁃cro1.4 软件由DICOM 格式转化为Analize 格式。在MATLAB R2013b 平台上采用SPM8 软件对图像进行标准化和平滑处理,然后进行参数估计,对无效假设进行检验及统计推断。DLBCL 组与对照组间的脑葡萄糖代谢水平比较利用SPM8进行基于每个像素SUV 的t检验。并采用SPM8 软件对DLBCL 组脑代谢程度与体部可测量高代谢病灶MTVwb、TLG⁃wb 的相关性进行多元回归分析。均在显著性水平(P<0.001)和体素阈值(K=100体素)下进行分析[6]。SPM8分析后给出t检验及相关分析中t值有统计学意义的每个体素点,并将每个像素点转化为Talai⁃rach坐标点,用MRIcro1.4软件将有统计学意义的坐标点以彩色色阶显示在灰色色阶的MRI模板上,以直观显示统计分析结果。
2 结果
2.1 视觉分析
部分患者视觉分析即可见弥漫性、对称性的皮层放射性摄取减低,因此双侧基底节区放射性摄取程度视觉表现为相对于皮层摄取水平增高。也有部分患者的放射性摄取减低范围更为广泛,双侧基底节区亦可见对称性放射性摄取减低(图1)。
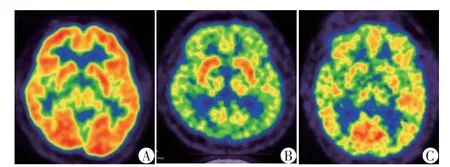
图1 健康对照与DLBCL患者脑18F⁃FDG PET⁃CT图像Figure 1 18F⁃FDG PET⁃CT imagings of health control and DLBCL patients
2.2 DLBCL 组和健康对照组18F⁃FDG PET⁃CT 图像SPM分析
部分DLBCL 患者视觉分析即可见脑皮层弥漫性、对称性的代谢减低,基底节区代谢相对增高。在显著性水平(P<0.001)和体素阈值(K=100体素)下进行组间t检验,相对于健康对照组,DLBCL患者葡萄糖代谢减低的脑区较为广泛(表1,图2),包括:双侧额叶(双侧额下回为主)、双侧直回及眶回、双侧顶叶、双侧颞叶、双侧枕叶、左侧楔前叶、扣带回,皮层下核团葡萄糖代谢减低的区域位于右侧丘脑枕核。中央前后回未受影响。
而与健康对照组相比,DLBCL患者脑葡萄糖代谢增高的区域则广泛地分布于皮层下白质区,但双侧枕叶皮层下白质代谢无明显改变;双侧海马杏仁核区、双侧苍白球及双侧小脑扁桃体区灰质部分代谢较健康对照组增高(表1,图2)。
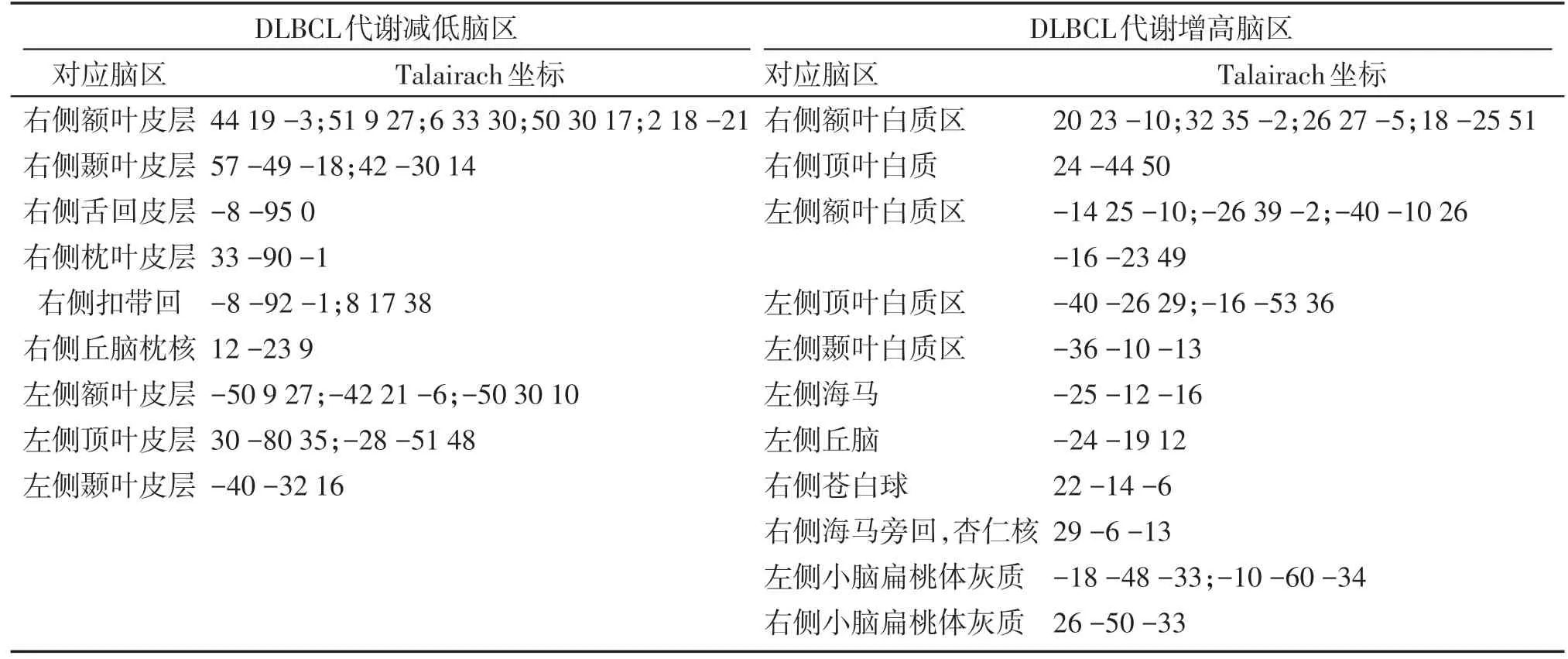
表1 DLBCL与对照组脑FDG PET图像SPM组间分析结果Table 1 The SPM analysis results of the FDG metabolism comparison between health controls and DLBCL patients

图2 DLBCL组与健康对照组局部脑葡萄糖代谢SPM分析结果Figure 2 SPM analysis results of the regional cerebral glucose metabolism in health controls and DLBCL patients
2.3 DLBCL 组脑代谢程度与体部MTVwb、TLGwb相关性SPM分析
在显著性水平(P<0.001)和体素阈值(K=100体素)下在MATLAB R2013b 平台上采用SPM8 软件进行基于脑SUV与体部MTVwb、TLGwb相关性的多元回归分析。将SPM8 相关分析中t值有统计学意义的每个体素点转化为Talairach 坐标点,并以彩色色阶显示在灰色色阶的MRI 模板上直观显示统计分析结果。从相关性统计分析图(图3)可以看出,部分脑区的SUV 值与MTVwb、TLGwb 呈负相关,与MTVwb呈负相关的脑区主要位于左侧顶上小叶及顶下小叶、左侧枕叶及角回、右侧颞中回等部位,与TLGwb 呈负相关的脑区与上述脑区分布大致相当,主要位于双侧角回、左侧颞叶下回后部、左侧额叶眶回等皮层部位。SPM 分析未发现存在正相关脑区。
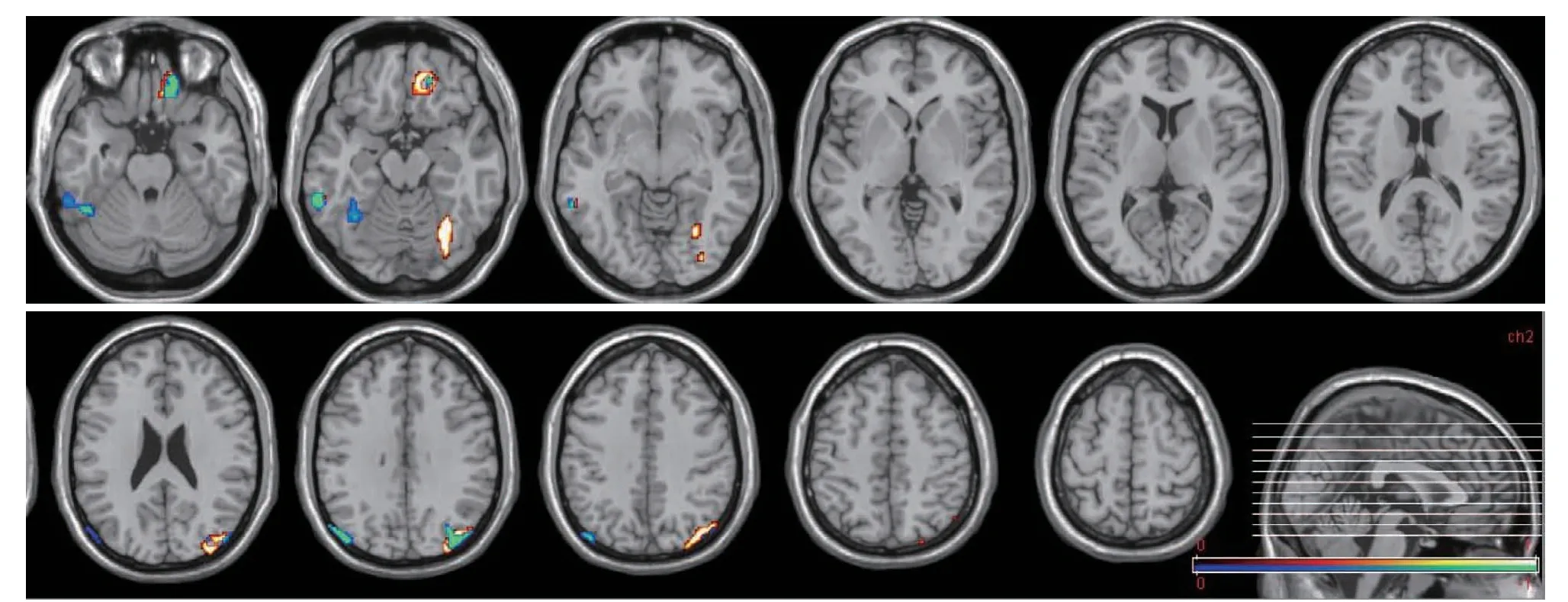
图3 脑代谢程度与体部MTVwb、TLGwb相关性的SPM分析结果Figure 3 SPM analysis of the correlation between regional cerebral glucose metabolism and MTVwb,TLGwb
3 讨论
PET⁃CT 作为一种“一站式”全身扫描的检查方式,在临床应用时经常会发现一些主要病灶之外的临床现象,比如,在很多未累及神经系统的体部疾病的检查过程中,可能会发现脑部的一些改变。一些实体肿瘤、血液系统疾病、风湿免疫性疾病、甚至心肌缺血等疾病的临床检查中,都能看到脑实质葡萄糖代谢的改变,一般以皮层代谢的减低为主,部分皮层下核团可表现为代谢的增高[5-7]。血液系统恶性疾病患者更容易见到这种脑葡萄糖代谢改变的表现,因此本文选择血液系统最常见的DLBCL进行分析,所有病例均无神经系统受累,但为了避免ROI 分析造成的主观影响,因此我们采用SPM 法分析DLBCL组脑葡萄糖代谢改变特点,并采用SPM法进行脑葡萄糖代谢改变情况与体部肿瘤负荷之间的相关性分析。
视觉分析即可见到部分DLBCL 患者存在大脑皮层弥漫性、对称的FDG 代谢减低,部分患者基底节区FDG代谢视觉可见相对增高,但皮层代谢减低程度进一步加重后,皮层下核团叶也表现为明显的FDG 代谢减低。SPM 分析也发现,相对于健康对照组,DLBCL 患者葡萄糖代谢减低的脑区较为广泛,几乎累及除中央前后回外的所有皮层,皮层下核团葡萄糖代谢减低的区域位于右侧丘脑枕核。中央前后回未受影响。这与一些文献报道结果一致[2,8],引起这种改变的可能机制目前普遍认可的主要有两个:①自身免疫机制,也就是副肿瘤综合征(para⁃neoplastic neurological syndromes PNS),虽然所有的肿瘤患者只有约0.01%出现临床PNS,但该发病率可能被低估,而且淋巴瘤或骨髓瘤患者的PNS 的发生率约有10%[9-10]。可能是由于肿瘤抗原与神经系统表达蛋白发生自身交叉免疫反应。②血管内肿瘤细胞造成的脑内小血管的阻塞引起的脑代谢改变减低及神经功能受损[2]。除此之外,肿瘤患者的神经精神问题可能也是引起脑代谢改变的原因之一,尤其是额叶的代谢改变[7]。
崔瑞雪等[11]利用PET检查评价PNS患者脑代谢改变,同样发现最常见的改变模式也是皮层的FDG代谢弥漫性减低。但是值得注意的是,与基本的感觉运动相关的脑区中央前后回(感觉运动皮质)葡萄糖代谢活性基本保留,这与阿尔兹海默症、PNS、风湿免疫性疾病等脑FDG 代谢改变情况基本一致[11-12]。海马和杏仁核区的代谢增高,肿瘤患者伴发的抑郁状态和一些心理问题可能与这些部位有关,功能磁共振(fMRI)证实海马和杏仁核区活动增加,边缘叶可能参与情绪反应[8]。本研究也发现双侧海马区代谢增高。
临床工作中还发现脑葡萄糖的代谢减低程度似乎与体部的肿瘤负荷高低无明显关联,文献报道也认为脑葡糖糖代谢改变与体部肿瘤负荷所造成的血糖水平的改变无关[2];临床常用于反映肿瘤负荷的PET⁃CT 葡萄糖代谢指标主要包括MTV 和TLG。本研究仅涉及体部瘤负荷,采用指标MT⁃Vwb、TLGwb,MTVwb 是体部SUVmax 在给定阈值范围内全部像素的体积,主要反映肿瘤负荷;TLGwb是MTVwb与SUV平均值的积,同时反映了肿瘤负荷和肿瘤的葡萄糖代谢水平。因此,采用这两个指标来评价体部肿瘤的负荷情况。基于SPM 的相关分析发现,体部MTVwb、TLGwb 与各脑区的葡萄糖代谢水平相关性统计分析图显示,只有小范围脑区的代谢减低与体部肿瘤葡萄糖代谢负荷有潜在的关联。孙伟等[9]关于治疗前后弥漫大B 淋巴瘤治疗前脑葡萄糖代谢改变的研究认为,治疗前DLB⁃CL 患者脑葡萄糖代谢减低可能与较差的预后相关,但脑代谢目前还不能代替NCCN⁃IPI 的预后评价指标,关于脑代谢改变在预后评价方面的应用目前研究尚少,需要进一步更长期以及更多病例的研究探讨。
关于体部DLBCL 脑内葡萄糖代谢情况的分析结果,提醒临床医生及核医学医生DLBCL脑内葡萄糖代谢改变有特征性的脑区分布特点,并且一些文献认为这些特征性的改变或许与分期、预后等临床指标相关。更进一步的前瞻性研究,比如不同类型淋巴瘤的脑代谢改变分析、加入患者的心理状态评价、探讨脑代谢改变与疾病临床指标相关性的研究也是非常有意义的,或将有助于临床医生更深入地理解疾病、指导治疗。

