大鼠S100A8 基因启动子质粒的构建及其SOX7 结合元件的初步鉴定
彭明玉,何庆玲,王文博,赵 聃,张 婧,王迎伟,邱 文
南京医科大学免疫学系,江苏 南京 211166
大鼠Thy⁃1 肾炎(Thy⁃1 nephritis,Thy⁃1N)是一种公认的研究人类系膜增生性肾小球肾炎(mesan⁃gial proliferative glomerulonephritis,MsPGN)的动物模型[1-2],给大鼠注射抗Thy⁃1抗原的抗体后,该抗体能与大鼠肾小球系膜细胞(glomerular mesangial cells,GMC)表面的Thy⁃1抗原结合,继而激活补体,引起炎症反应和GMC 增生病变。已知补体作用靶细胞可分为全溶解型(lytic)和亚溶解型(sublytic),sublytic C5b⁃9 虽不能导致细胞溶破,但能促发多种生物学反应[3]。本课题组以往研究证实,Thy⁃1N 病变具有补体C5b⁃9 依赖性,尤其是sublytic C5b⁃9 依赖性。Thy⁃1N大鼠肾组织内和体外受sublytic C5b⁃9刺激的大鼠GMC 中,多种炎症因子如白介素(inter⁃leukein,IL)⁃6、IL⁃23和IL⁃36a表达显著上调,且参与肾组织炎性病变[4-9]。但是,其他炎症因子或介质在Thy⁃1N发病过程中发挥何种作用目前尚不知晓。
本课题组前期实验发现,Thy⁃1N大鼠肾组织中和体外受sublytic C5b⁃9刺激的大鼠GMC中,炎症介质S100A8 的mRNA 和蛋白表达均显著上调。S100蛋白家族是仅存在于脊椎动物中的低分子量蛋白[10],于1965年由Moore 等[11]在牛脑中首次发现,因其可100%溶于饱和硫酸铵而得名。S100 蛋白家族共计20 余个成员,包括S100A1⁃A18、S100B、S100P等[12-13],且具有组织和细胞特异性以及结合Ca2+的能力[12]。在损伤或应激等因素的作用下,S100蛋白被释放到细胞外,促发组织炎症反应[13]。已发现,S100 在类风湿关节炎(rheumatoid arthritis,RA)、炎症性肠病(inflammatory bowel disease,IBD)和狼疮肾炎(lupus nephritis,LN)等免疫性疾病中发挥了重要的促炎作用[14]。另有研究报道,在心肌梗死后发生的炎症中,梗死灶中的中性粒细胞释放的S100A8可与TLR⁃4结合,促进NLRP3炎症小体释放IL⁃1β,后者可增强骨髓中粒细胞的分化,进而加重炎症反应[15]。
为了研究Thy⁃1N 大鼠GMC 中S100A8 基因表达的转录调控机制,本课题组前期又筛查了Thy⁃1N大鼠肾组织内和体外受sublytic C5b⁃9 刺激的大鼠GMC中上调的转录因子,发现性别决定区Y框蛋白7(SRY⁃related HMG⁃box gene 7,SOX7)的mRNA 和蛋白表达均显著上升(资料未发表)。SOX7是一种含有高迁移率族框结构域的转录因子,可与启动子区DNA序列结合启动靶基因转录,发挥相应的生物学功能。目前发现的SOX 家族根据HMG 结构的氨基酸序列分为A、B1、B2、C、D、E、F、G 和H 亚群,共20余个成员,其中SOX7属于F亚群[16-17]。有文献报道,SOX7 作为抑癌基因可通过Wnt/β⁃catenin 信号通路抑制胶质瘤细胞的增殖[16]。此外,SOX7 还可通过Notch信号通路促进血管生成[18]。本课题组前期实验发现,在大鼠GMC 中过表达SOX7 可上调S100A8基因的表达(资料未发表),另生物信息学软件预测提示大鼠S100A8 基因启动子区含有SOX7的结合元件,但是上调的SOX7 能否直接促进S100A8 基因的转录,目前尚不清楚,故本实验拟对此问题展开研究。首先构建大鼠S100A8 基因启动子全长和截短质粒,与大鼠S100A8过表达质粒共同转染HEK⁃293T 工具细胞,观察SOX7 对S100A8 基因启动子活性的影响,同时筛选SOX7 与S100A8 基因可能的结合元件,并对上述SOX7 结合元件进行突变分析,拟为进一步研究Thy⁃1N 大鼠GMC 中SOX7促进S100A8基因启动和转录的机制提供实验依据。
1 材料和方法
1.1 材料
人胚肾293T(HEK⁃293T)细胞购自美国模式培养物集存库(American Type Culture Collection,ATCC)。pGL3⁃basic 和pRL⁃SV40 荧光素酶报告质粒以及双荧光素酶报告基因检测试剂盒(Promega 公司,美国);基因组DNA提取试剂盒(北京天根生化技术有限);SanPrep 柱式PCR 产物纯化试剂盒(上海生工生物工程股份有限公司);高保真酶PrimeSTAR@Max DNA Polymerase、限制性内切酶KpnⅠ、SmaⅠ和T4 DNA连接酶(TaKaRa公司,日本)。
1.2 方法
1.2.1 引物设计
登录NCBI,通过Gene 数据库中搜索大鼠S100A8 基因(ID:116547),利用Primer 5.0 软件辅助设计针对S100A8基因启动子区(-2 068~+174 nt)的引物,上游:5′⁃GGGGTACCATCCTAGCAGATGT⁃GAGATGG⁃3′;下游:5′⁃TCCCCCGGGGCTACTC⁃TATTCCCCCAACTC⁃3′,并在上下游引物序列前加入KpnⅠ、SmaⅠ酶切位点序列,后交由滁州通用生物系统有限公司制备。
1.2.2 大鼠S100A8基因启动子全长序列的扩增
以大鼠基因组DNA 为模板,用PrimeSTAR@Max DNA Polymerase 进行PCR 反应,反应体系:PrimeSTAR Max Premix(2×)25 μL,上、下游引物各2 μL,基因组DNA 2 μL,灭菌双蒸水19 μL;反应程序:98 ℃变性10 s;60 ℃退火15 s,72 ℃延伸2 min,循环30 次;扩增产物经SanPrep 柱式PCR 产物纯化试剂盒回收。
1.2.3 大鼠S100A8 基因启动子全长荧光素酶报告质粒的构建与鉴定
将pGL3⁃basic 质粒与S100A8 基因启动子PCR产物与限制性内切酶KpnⅠ和SmaⅠ37 ℃水浴2 h,利用SanPrep柱式PCR产物纯化试剂盒分别回收线性化的pGL3⁃basic质粒和S100A8启动子PCR产物,再通过T4 DNA连接酶进行连接反应(16 ℃,8~12 h),并将连接产物转化感受态大肠杆菌DH5α,将其均匀涂布于含Amp 抗性的LB 平板琼脂表面,于37 ℃中培养12 h 后,挑取5 个单克隆菌落于3 mL 含有Amp 抗性的液体LB 培养基中,37 ℃震荡培养12 h。取1 μL 培养后的菌液作为模板DNA 进行PCR 鉴定,筛选出的阳性克隆送通用生物系统(安徽)有限公司测序鉴定,将构建成功的质粒命名为pGL3⁃S100A8⁃FL。
1.2.4 大鼠S100A8 基因启动子截短和突变质粒的构建与鉴定
利用JASPAR 软件预测S100A8 基因启动子区SOX7 的结合元件,并根据预测结果通过通用生物系统(安徽)有限公司构建4 个S100A8 基因启动子截短质粒。后由该公司将S100A8基因启动子-86~-57 nt 区SOX7 结合元件5′⁃GAAATGCTCAATGT⁃GCTCAGTGATTGCCAC⁃3′突变为5′⁃GGGCGCGC⁃GCGCTATAGGGCGCGCGCGCCC⁃3′,突变质粒命名为pGL3⁃S100A8⁃M。
1.2.5 重组质粒转染HEK⁃293T细胞
将HEK⁃293T细胞接种于24孔板中(1×105个/孔),培养24 h 后,用Lipofectamine 2000 将pIRES2⁃SOX7、pRL⁃SV40分别与S100A8基因启动子全长质粒及各截短质粒转染HEK⁃293T细胞。
1.2.6 荧光素酶活性的测定
待上述质粒共转染HEK⁃293T 细胞48 h 后,用双荧光素酶报告基因检测试剂盒中PLB 裂解液稀释后裂解细胞,收集细胞裂解产物,分别检测S100A8 基因启动子质粒及内参照质粒(pRL⁃SV40)的荧光活性,其中,目的基因的萤火虫荧光素酶活性(M1)/pRL⁃SV40 质粒的海肾荧光素酶活性(M2),即为被检测质粒的相对荧光素酶活性(RLU)。
1.3 统计学方法
所得定量数据均以均数±标准误()表示。采用SPSS 19.0 软件对所得数据进行方差分析和Bonfferoni法两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠S100A8启动子荧光素酶报告质粒的构建与鉴定
PCR 扩增大鼠S100A8 全长启动子(-2 068~+174 nt)后,经双酶切插入pGL3⁃basic 质粒中,将重组质粒转化后均匀涂布于含Amp抗性的固体LB平板琼脂表面,经菌液PCR 筛选出阳性克隆菌落,再送公司测序验证,测序结果显示质粒构建成功,命名为pGL3⁃S100A8⁃FL(图1)。
图1 琼脂糖凝胶电泳结果Figure 1 Agarose gel electrophoresis results
2.2 过表达SOX7 对大鼠S100A8 启动子全长活性的影响
将pIRES2⁃EGFP、pIRES2⁃SOX7、pRL⁃SV40 和pGL3⁃S100A8⁃FL 不同分组共转染HEK⁃293T 细胞,转染后48 h 检查GFP 表达情况,发现GFP 显著表达,其转染效率约为80%(图2)。随后裂解细胞并进行荧光素酶报告基因检测,结果显示,pGL3⁃S100A8⁃FL、pIRES2⁃SOX7 与pRL⁃SV40 共转染组其RLU值显著高于pGL3⁃S100A8⁃FL、pIRES2⁃EGFP与pRL⁃SV40 共转染组,提示SOX7 过表达能够明显上调S100A8基因的启动子活性。
2.3 SOX7 过表达对大鼠S100A8 基因启动子活性的影响
2.3.1 大鼠S100A8 基因启动子各截短质粒位置的确定
应用生物信息学软件JASPAR 对S100A8 基因启动子全长序列中SOX7 的结合元件进行预测(表1)。参考其各结合元件的位置,设计相应的截短质粒(表2)。
2.3.2 大鼠S100A8 基因启动子各截短质粒的构建与鉴定
基于pGL3⁃S100A8⁃FL 质粒,由通用生物系统(安徽)有限公司构建上述4 个截短质粒,即pGL3⁃S100A8⁃1、pGL3⁃S100A8⁃2、pGL3⁃S100A8⁃3和pGL3⁃S100A8⁃4,测序结果显示pGL3⁃S100A8⁃1~4 截短质粒构建正确。
2.3.3 SOX7过表达对大鼠S100A8基因启动子各截短质粒活性的影响
将pGL3⁃basic、pGL3⁃S100A8⁃FL 和pGL3⁃S100A8 各截短质粒分别与pIRES2⁃SOX7 和pRL⁃SV40共转染HEK⁃293T细胞,转染后48 h裂解细胞并测定其荧光素酶活性,转染pGL3⁃S100A8⁃4 细胞的RLU 值较pGL3⁃S100A8⁃FL 和pGL3⁃S100A8⁃1~3 转染组相比显著降低(图3)。提示S100A8基因启动子区的SOX7结合元件可能位于-200~+51 nt区域。
2.3.4 SOX7过表达对大鼠S100A8基因启动子突变质粒活性的影响
为了进一步确定SOX7在S100A8启动子-200~+51 nt区内的结合元件,根据JASPAR结合元件预测结果,又开展了启动子突变实验,构建了S100A8 启动子-86~-57 nt 区突变的荧光素酶报告质粒,即将5′⁃GAAATGCTCAATGTGCTCAGTGATTGCCAC⁃3′突变为5′⁃GGGCGCGCGCGCTATAGGGCGCGCGC⁃GCCC⁃3′,并将其命名为pGL3⁃S100A8⁃FL⁃M。将pGL3⁃basic、pGL3⁃S100A8⁃FL和pGL3⁃S100A8⁃M分别与pIRES2⁃SOX7质粒共转染HEK⁃293T细胞,于转染48 h裂解细胞并检测各组荧光素酶活性。结果显示,S100A8基因全长启动子-86~-57 nt突变后其荧光素酶活性显著降低,初步确定转录因子SOX7可通过与-86~-57 nt区结合并上调S100A8的启动子活性(图4)。

图2 HEK⁃293T细胞中质粒共转效率的评估以及SOX7过表达对大鼠S100A8基因启动子全长荧光素酶活性的影响Figure 2 Transfection efficiency of plasmids in HEK⁃293T cells and the effect of SOX7 overexpres⁃sion on rat S100A8 gene full⁃length promoter activity

表1 JASPAR 预测的大鼠S100A8 基因启动子区SOX7 结合元件Table 1 SOX7 binding elements within rat S100A8 gene promoter predicted by JASPAR

表2 S100A8截短质粒位置Table 2 location of different S100A8 truncated luciferase reporter plasmids
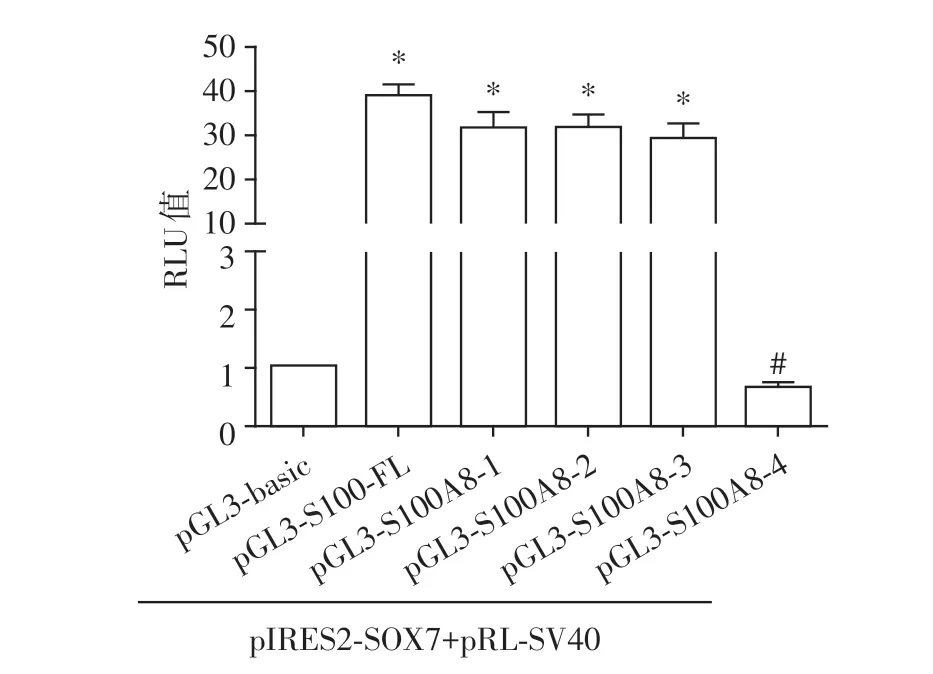
图3 HEK⁃293T 细胞中SOX7 对S100A8 各截短质粒荧光素酶活性的影响Figure 3 The effect of SOX7 on the activity of different truncated rat S100A8 promoter in HEK⁃293T cells
3 讨论
本课题组前期研究证实,大鼠Thy⁃1N发病过程中炎症介质S100A8 和转录因子SOX7 的表达均显著上调,且体外用sublytic C5b⁃9刺激大鼠GMC后亦可明显增强S100A8 和SOX7 的表达。此外,在大鼠GMC中过表达SOX7可显著上调S100A8的表达,另生物信息学软件预测提示,S100A8基因启动子区包含多个SOX7 结合元件。因此推测,sublytic C5b⁃9刺激大鼠GMC 后可通过上调SOX7 促进S100A8 基因的转录和表达,进而加重Thy⁃1N的炎性病变。
为了研究大鼠SOX7 对S100A8 基因启动的影响,本实验构建了大鼠S100A8基因启动子全长荧光素酶报告质粒(pGL3⁃S100A8⁃FL),将pGL3⁃S100A8⁃FL质粒与我们前期构建的pIRES2⁃SOX7质粒行不同分组共转染HEK⁃293T细胞,转染48 h裂解细胞并测定其荧光素酶活性。结果发现,pGL3⁃S100A8⁃FL和pIRES2⁃SOX7共转染组其荧光素酶活性显著高于其他组,提示过表达大鼠SOX7能够增强HEK⁃293T细胞中大鼠S100A8基因的启动子活性,这一发现与本课题前期GMC 细胞实验的结果一致,即转录因子SOX7能够促进大鼠GMC中S100A8基因的表达。

图4 HEK⁃293T 细胞中SOX7 对S100A8 全长和突变启动子质粒荧光素酶活性的影响Figure 4 The effect of SOX7 on the activity of full length and mutant of rat S100A8 promoter in HEK⁃293T cells
为了进一步确定大鼠SOX7 与S100A8 基因启动子的结合部位,通过JASPAR 软件预测发现大鼠S100A8 基因启动子区可能存在5 个SOX7 结合元件,并据此构建了4个大鼠S100A8基因启动子截短荧光素酶报告质粒,即pGL3⁃S100A8⁃1~4。之后将pGL3⁃S100A8⁃FL 或pGL3⁃S100A8⁃1~4 分别与pIRES2⁃SOX7 和pRL⁃SV40 共转染HEK⁃293T 细胞,于48 h裂解细胞检测各组RLU值,结果表明,pGL3⁃S100A8⁃4 荧光素酶活性显著低于pGL3⁃S100A8⁃FL和pGL3⁃S100A8⁃1~3,提示SOX7 与S100A8基因启动子的结合元件可能位于启动子-200~+51 nt 之间。而根据JASPAR软件预测结果,-200~+51 nt 区域含有1 个SOX7 结合元件(-86~-57 nt,5′⁃GAAATGCT⁃CAATGTGCTCAGTGATTGCCA C⁃3′),随后,将该结合元件进行序列突变,构建S100A8启动子全长突变质粒即pGL3⁃S100A8⁃M,并将pGL3⁃S100A8⁃FL 和pGL3⁃S100A8⁃M 分别与pIRES2⁃SOX7 和pRL⁃SV40共转染HEK⁃293T 细胞,于48 h 裂解细胞检测各组荧光素酶活性。结果发现与pGL3⁃S100A8⁃FL相比,pGL3⁃S100A8⁃M 组荧光素酶活性显著降低,提示S100A8基因启动子-86~-57 nt区可能是SOX7结合元件。不过有关SOX7 能否与该启动子区直接结合,仍需要通过染色质免疫沉淀(chromatin immuno⁃precipitation,ChIP)实验进一步确证。
综上所述,本实验成功构建了大鼠S100A8基因启动子全长荧光素酶报告质粒,并在HEK⁃293T 细胞中证实过表达SOX7 可增强S100A8 基因的启动子活性。此外,用生物信息学软件预测SOX7 结合元件的分布,据此设计并构建了4个S100A8基因启动子截短荧光素酶报告质粒,在HEK⁃293T 细胞中过表达SOX7 探讨其对S100A8 基因启动子不同截短活性的影响,初步筛选出大鼠S100A8基因启动子区可能的SOX7 结合元件(-86~-57 nt)。接着对上述结合元件序列进行突变,并在HEK⁃293T 细胞中检查过表达SOX7 对S100A8 基因启动子突变质粒启动的影响,进一步确证了上述SOX7 结合元件的有效性。本研究结果为今后进一步探究sublytic C5b⁃9刺激大鼠GMC后通过上调SOX7促进S100A8基因的转录及其机制提供了必要的启动子质粒和有用的实验数据。

