面向CO2电化学转化的铜基催化剂研究进展
孟怡辰,况思宇,刘海,范群,马新宾,张生
天津大学化工学院,绿色合成与转化教育部重点实验室,天津 300072
1 引言
化石能源的消耗导致了大气中CO2浓度的逐年增加,引发了全球气候变暖、海平面上升等一系列严重问题。因此,如何将风能、太阳能和地热能等可再生能源转化为方便储存、运输和使用的形式,以及如何通过利用可再生能源来降低CO2浓度,实现绿色发展,是迫切需要解决的问题1-3。将CO2转化为含碳燃料和化工产品是实现可持续发展的重要途径,是一项可以实现环境友好与工业生产双赢的方案。利用可再生能源(如风能、太阳能等)将CO2转化为高附加值的化学物质和燃料(CO、CH4、C2H4、CH3OH、HCOOH等),因其理念的重要性和技术的可行性而受到广泛关注4-8。在各类方法中,电化学还原CO2由于其环境友好、操作方便,以及可通过改变施加电位来调节反应产物选择性等优点,成为了降低大气中碳含量、缓解能源危机、以及改善环境的有效途径9-13。
Hori等人14根据CO2还原产物将金属催化剂分为四类:1. 主产物是CO:Au,Ag,Pd,Ga,Zn。2. 主产物是HCOO-:Bi,Pb,Sn,Cd,Hg,In,Tl。3. 可以产生> 2e-还原产物:Cu和Cu合金。4.主产物为H2,对CO2还原反应不活跃:Ni,Ti,Pt,Fe。其中,金属铜可以将CO2还原为CO、HCOOH、CH4、C2H4、C2H5OH等多种产物,是唯一能产生>2e-还原产物的金属。此外,由于它对CO中间体的吸附较强,从而有利于实现C-C偶合,促进C2+产物(即还原产物所含碳原子数≥ 2)的生成。与C1产物(CO、CH4、HCOO-、CH3OH)相比,C2+产物(C2H4、C2H5OH、CH3COO-、n-C3H7OH等)具有更高的能量密度和更高的经济价值,可作为合成长链烃类燃料和氧化物的原料,因此有着很大的工业需求量15。其中,C2H4是一种需求量巨大的化学品,它可以用来生产聚乙烯,还可直接用作焊接燃料或天然气的混合组分,其产量已经作为衡量一个国家石油化工发展水平的重要标志之一16。C2H5OH是一种高能量密度(26.8 MJ·kg-1)的液体燃料,也是化学合成中广泛使用的中间体,容易储存和运输,因此被用作汽油的添加剂。除了作为汽车燃料,C2H5OH也被用于燃料电池中17,18。相对于C1产物,C2+物质的工业合成路线也更为复杂。因此,通过电催化将CO2还原为具有高价值的C2+产物具有更广泛的应用前景。
Cu基催化剂可以将CO2还原为C2+产物的优异性能,引起了越来越多科研工作者的重视。纯金属Cu作为催化剂存在不少缺点,如对某种高价值的C2+产物选择性往往不高,整体的CO2转化效率会受到析氢反应的影响,且电解过程中失活较快以及高过电位的要求限制了其工业应用19-22。作为一种有发展前景的金属催化剂,为了进一步提高其催化性能,众多研究人员对Cu催化剂的尺寸23,形貌24,应变水平25,晶面26,化合态27等进行了改性。本文介绍了近年来不同方式改性的铜基催化剂的研究进展以及相关的反应机理,并根据对已有研究的分析,结合发展的状况,对铜基电催化剂的研究方向进行展望。
2 CO2电化学还原面临的挑战
大气中逐渐增加的CO2浓度是全球变暖的一个重要原因。要解决CO2含量过高的问题,不仅需要减少对化石燃料的依赖,还需要制定有效的策略,从大气中捕获CO2并有效利用。为了应对能源需求,可再生能源长期、大规模的储存仍然是一项巨大的挑战。而化学键储能有很多好处,包括显著提高能量密度,增强安全性和转化程度28。CO2的转化利用一直在不断发展,其主要通过不同的机制断裂C=O键,形成C―C、C―H键来实现29。经过多年的研究,人们逐渐探索出了热化学、光化学、电化学等还原或转化CO2的方法。其中,通过电化学的方法还原CO2是一种有前景的方法,其所需的能量输入可以来自太阳能、风能等可再生能源产生的电能30,31。
将CO2转化为更有价值的产物需要将电子转移到碳上,从而降低碳的价态,这一系列反应通常被称为CO2还原反应32。根据参与反应的电子数不同,可得到不同的产物,常见的还原产物(CO、CH4、HCOOH、CH3OH、C2H5OH、C2H4、CH3CHO等)与相应的平衡电位见表1。从热力学角度来说,CO2作为稳定的线性分子,C、O之间的距离很短,仅有0.116 nm。虽然CO2总体上是非极性的,但由于C和O的电负性不同,它含有极性键33。动力学上,CO2还原过程非常缓慢。CO2还原的第一步是CO2分子的活化,即降低化学键的有序程度。激活CO2的能量反映在还原的负电位上,CO2的单电子还原发生在比较负的电位,大部分原因是由于从线性CO2到弯曲CO2需要能量来完成大规模的结构重排34。
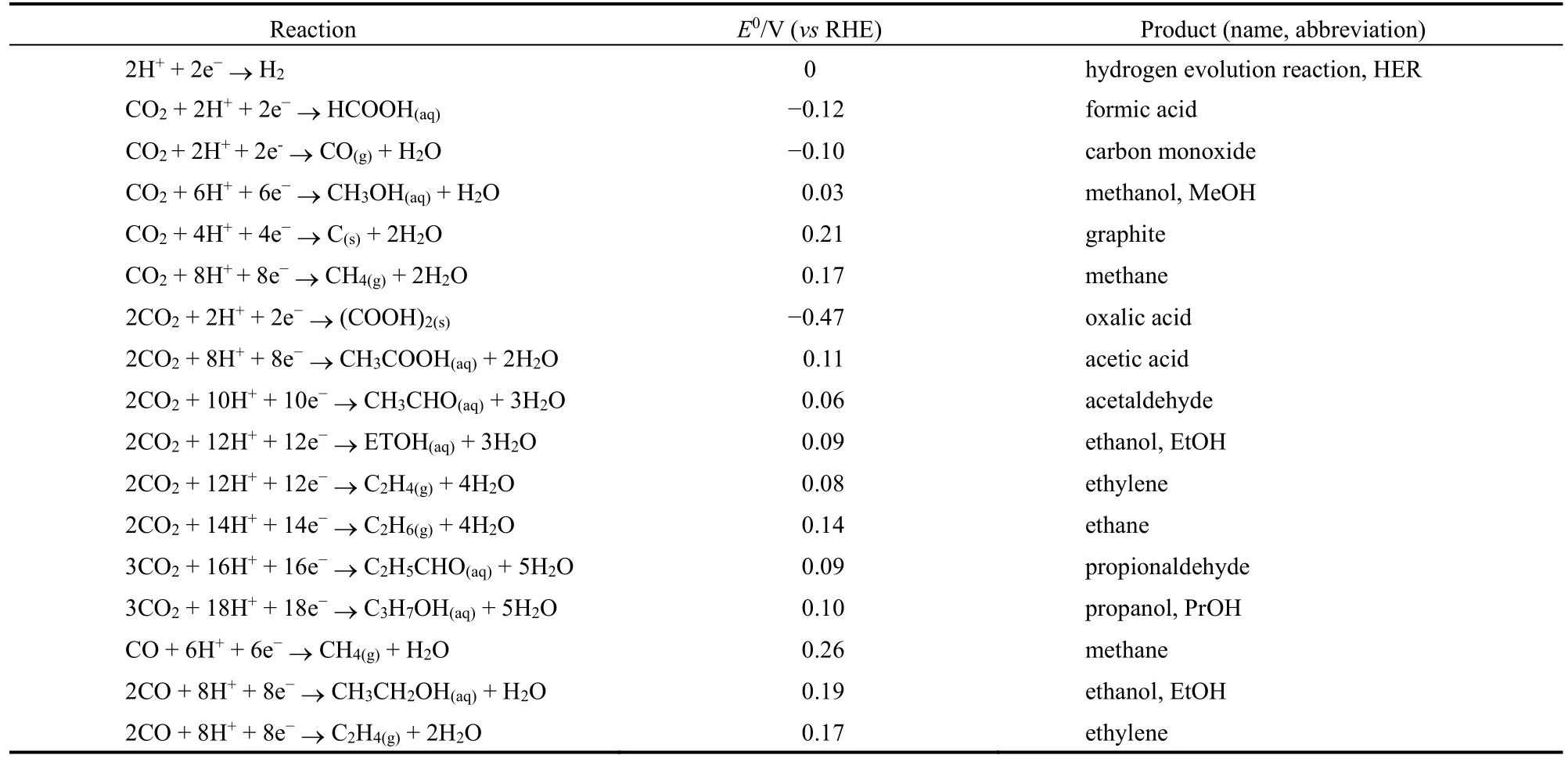
表1 电极反应以及对应的平衡电势Table 1 Electrode Reactions with Equilibrium Potentials.
由于CO2的电化学还原反应通常在水溶液中进行,因此伴随着析氢副反应的发生32,从而导致有效产物法拉第效率的损失。了解析氢与CO2还原之间的竞争关系,对于提高电催化CO2还原的法拉第效率具有重要的意义35,36。CO2还原的商业应用需要一种高稳定性的催化剂,而已报道的催化剂常因为结构不稳定而降解,从而导致性能下降37。另外,CO还原被认为是CO2转化成C2+产物的限速步骤,但大多数关于CO还原的研究都是在电解质溶液中进行的,CO的溶解度很低,所以,更好地理解CO的还原,特别是在高电流密度的情况下,对于提高CO2还原活性非常重要38。因此,促进CO2电化学还原的关键技术是开发出可以在较低过电位下产生目标产物,具有高选择性、高稳定性和高活性的催化剂。
3 Cu表面CO2电催化还原机理
近年来,研究人员一直致力于Cu基催化剂表面CO2还原反应机理的研究。早在1985年,Hori等人39首次在多种金属电极上进行了CO2电催化还原实验,通过产物分析发现,只有Cu具有可以产生C2H4、C2H5OH和n-PrOH等C2+产物的独特性能14,40。这是因为Cu是唯一对*CO具有负吸附能,而对*H具有正吸附能的金属32,更易稳定吸附*CO,并且CO在Cu上具有适宜的结合能,C-C偶联机制是Cu催化剂上C2+产物生成的主要原因。
Hori等人41较早就提出了C-C偶联机制,*CH2直接二聚成C2H4,或者通过CO插入的方式形成*CH2CO,然后进一步生成C2H4。近年来,密度泛函理论(DFT)计算及原位光谱测试已被广泛用于探究CO2还原的机制。通过预测关键反应中间体的吸附能,建立反应自由能图,或者直接识别反应中间体,可以为提出的反应机理提供可靠的验证42,43。有研究表明,通过原位红外光谱仪检测到质子化二聚体(OCCOH),并且这个中间体只出现在Cu(100)平面上还原CO的时候。DFT计算结果也证明了*COCHO的存在,于是认为C2H4的形成可能是通过两个被吸附的CO物种之间的C―C偶合进行的,证实了在Cu(100)上C―C偶联成C2产物是通过二聚化的步骤44。与只通CO2相比,CO2与CO同时存在时,C2+产物的选择性明显提高,说明CO是关键的反应中间体45。光谱与动力学模型均显示,*CO在CO2还原条件下存在于Cu上,C―C偶联的能垒、*H和*CO的覆盖率都会影响C2产物的生成32,46。Karen Chan研究组47认为Cu(100)和(211)台阶面比Cu(111)更有利于C2+产物的形成。自由能显示Cu(100)比Cu(111)更容易进行共二聚反应。*OCCO在Cu(100)面通过两个碳端吸附在四重位点上,比碳原子被限制在三重位点上的Cu(111)具有更强的内在结合能。Cu(211)面有较好的共二聚动力学。虽然Cu(211)比Cu(100)具有更大的二聚势垒,但其跃迁态的能量基本相同。表面加氢形成*OCCHO也很容易,因为*OCCO的碳端指向质子转移的溶剂,形成了相应的质子-电子转移屏障。
Yogesh研究组认为,Cu上高阶产物的形成与pH值和电位有关48。Goddard等人49对H2O/Cu(100)体系使用从头算分子元动力学模拟,根据自由能的计算,确定了C2产物的动力学和生成途径。该研究认为C2产物的生成机制与施加的电位有关。当施加电位在-0.4 V (相对可逆氢电极RHE)到-0.6 V(vs RHE)的范围时,C2H4通过ER机制生成在动力学上比LH机制更具优势。*CO―CO被水合成*CO―COH,然后*CO―COH又很快被还原成*COH―COH。虽然*CCO在Cu(100)上形成从能量角度来看是有利的,但是*CCO形成的ΔG‡比*COH―COH的高0.67 eV,因此,*CCO对C2H4的形成起很小的作用。当施加的电位逐渐增加,由于CO表面位点的丢失,被H*所取代,因此C2H4的生成速率降低。当施加电位大于-0.8 V (vs RHE)的时候,通过未吸附的CO与*COH反应,C2H4的生成又重新增多,这与Bell和Head-Gordon等人50认为*COCHO是生成C2产物的关键中间体的观点一致。另外,通过GC-QM (巨正则量子力学)方法确定了Cu(111)上C2产物的生成途径与pH有关,并且认为Cu表面结合的水在电化学脱水还原中有非常关键的作用。引入探针分子发现,酸性pH下生成HOCHCH2在动力学上是有利的,并预测C2H5OH是唯一的产品。但是当pH增加到7,HOCCH2脱水生成H2C=C在动力学上变的更有利。而在碱性pH下,生成C2H4的路线占主导地位。中间体CH2CH3在酸性条件下生成C2H6,在中性和碱性条件下,C2H6的加氢会被抑制51。
Kim等人52研究发现,C2H4和C2H5OH的Tafel斜率相似,说明决速步骤的中间体相同,并且这些C2产物的形成基本上受到C1中间体偶合作用的限制。另一方面,n-PrOH呈现出不同的Tafel斜率,表明与C2H4和C2H5OH的生成路径不同。n-PrOH的形成可能需要CO与氢化C之间的偶合(例如*CH2),*CH2恰好是形成CH4的中间体,而与C2H4和EtOH相比,n-PrOH在更正的电位下达到最大值,且n-PrOH下降时恰好是CH4法拉第效率上升的区域也证明了这一点。另外有研究认为,被吸附的C2中间体,例如C2H4,也能与邻近的C1中间体(例如CO)发生分子间C―C偶联,然后经过质子/电子转移形成CH3CH2CHO,最后还原成n-PrOH53,这与Bell等人54认为CH3CH2CHO是n-PrOH前体的观点相一致。研究发现,与阴极接触的电解质中醛类的浓度远远高于相应的醇。而且在更大的阴极电位下,C2H5OH在阴极附近的浓度随着CH3CH2CHO的消耗而增加。根据这些发现,认为CH3CHO是C2H5OH和CH3CH2CHO的前体,n-PrOH通过CH3CH2CHO生成。然而,Xu研究组55通过同位素标记和原位光谱测试发现,CH3CHO脱氢生成甲羰基中间体,与CO偶联可以生成PrOH,但主要途径还是CO之间的偶联。甲羰基中间体加氢生成―OCH2CH3和―CHOHCH3,可以进一步生成C2H5OH。
Bell和Head-Gordon研究组50对CO2在Cu(100)上进行电化学还原过程中C―C的形成途径进行了周期性Kohn-Sham密度泛函理论研究。研究发现,在低应用电位下,C―C通过CO二聚体形成。然而,在高应用电位,较大的激活障碍阻断这一途径,因此,C―C的形成通过CHO与CO反应生成。而CHOads可以通过CO与Hads结合生成(Volmer机制),或者直接从溶液中还原水生成(Heyrovsky机制)。之后利用DFT计算与恒电极电位(CEP)模型研究,提出了高电位下Cu(100)上CO生成C2产物的可能途径(图1)。在*CO + H →*CHO,*CHO + CO →*COCHO或*COCO + H →*COCOH的过程中,*COCOH和*COCHO是互变异构体。通过计算发现在没有应用电位的情况下,*COCHO比*COCOH稳定0.43 eV,并且认为*COCHO是生成C2产物的关键中间体,也对C2H4与C2H5OH之间的选择性具有重要作用。从*COCHOH开始,进一步还原环氧乙烷,最终生成C2H4,而C2H2O2分别在低电位和高电位下还原为CH3CHO和C2H5OH,并且认为*CH2CH2OH是生成C2H5OH的直接前体。同时,还通过实验探索出了生成CH3COOH的新路径:从*COCHO开始,通过还原和环化形成乙酰内酯,经过两个额外的还原和质子转移可以产生CH3COOH56。又有研究认为,7种C2、C3产物最有可能通过三种途径形成。对于第一条路线,*CH2是生成C2产物的关键中间体,其中C2H6是通过*CH3的二聚形成的,CH3COO-是通过CO插入机制形成的。第二条路线中,*CHO通过CO插入机制成为C2H2O2和C2H6O2的前体。但是由于*CHO也是CH4的前体,因此这条路线中对CH4的选择性较强。对于第三条路线,C2H4是最常见也是最重要的C2产品。已提出的生成机制有*CO二聚、*CO―COH偶联、碳烯和CO插入机制等57。
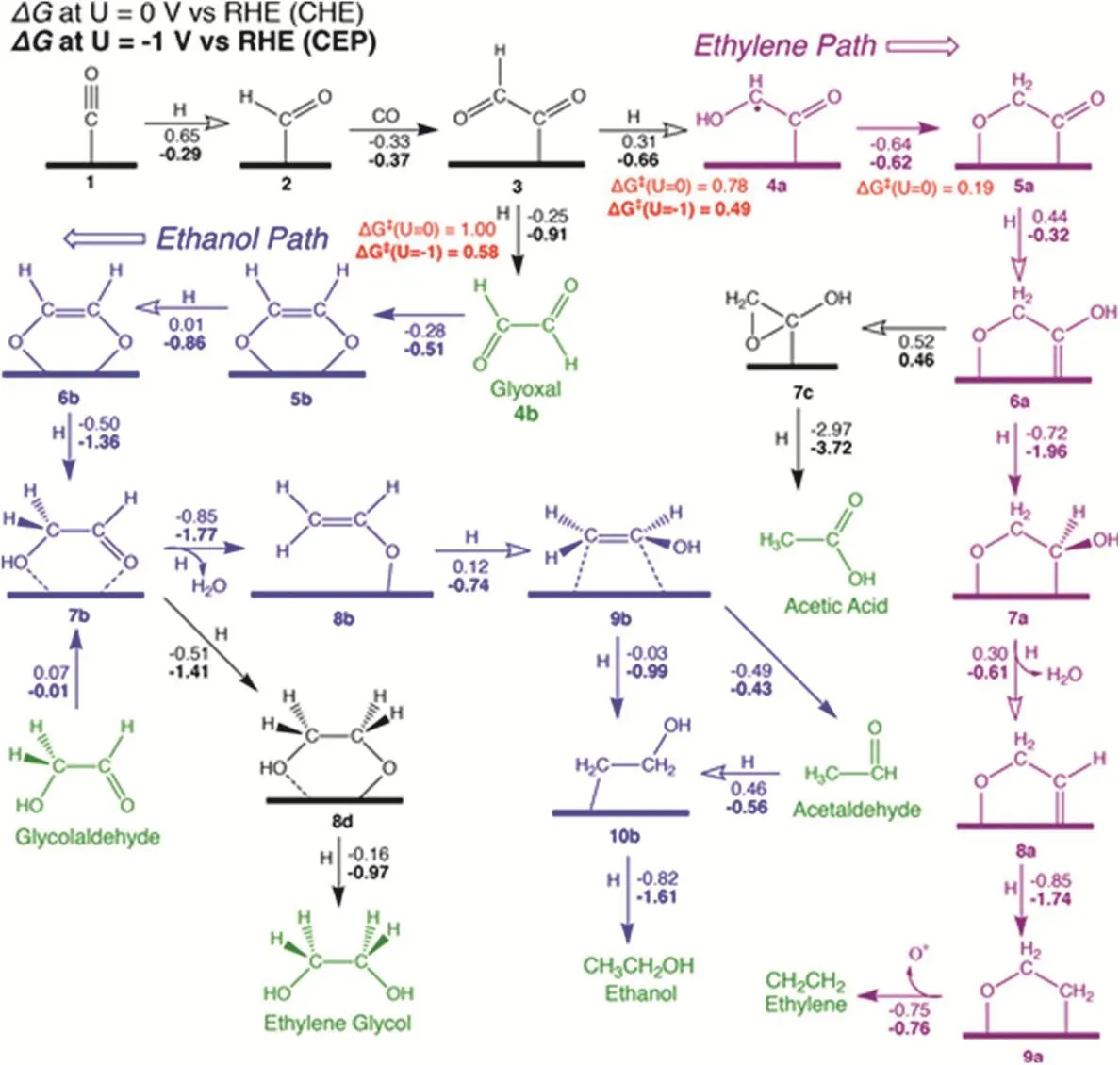
图1 高电位下Cu(100)上CO还原产生C2产物的机制56Fig. 1 Proposed mechanism for the reduction of CO to C2 products at high potentials on Cu(100) 56.
自从CO被确定为CO2还原成C2+产物的关键中间体以来,研究人员对C2+产物生成的途径和机理进行了大量的研究。但是与C1产物的反应途径相比,C2+产物的生成途径比较复杂,并且溶剂对中间体有影响、关于pH效应的起源也存在争议,因此,对于它们生成的途径还没有一个确切的理论。C―C偶合步骤有更高的动力学壁垒,生成C2+产物的效率与C2+的电流密度都比C1产物低很多。这就会限制CO2转化为C2+产物。因此,要继续对反应机理进行探索,加深理解,明确速控步骤与关键中间体,有助于开发高效的催化剂。
4 铜基催化剂研究进展
虽然金属Cu对CO2具有独特的催化特性,但是仍然存在CO2电化学转化的还原过电位较高、动力学缓慢、能量转换效率低、选择性差、稳定性不足、竞争性析氢副反应明显等问题5,58,同时,一些高价值的还原产物一般只有在很高的过电位下才能以显著的速率产生21。因此,通过改性Cu催化剂来提高CO2还原的催化活性和选择性是一项具有重大意义的课题。通过调控一些参数,比如粒径的尺寸23,晶面59,原子配位数60,表面应变61,62等,可以改变催化剂表面的电子结构和几何环境,以实现高选择性地生成不同种类的产物,也可以进一步促进C―C偶联,从而更有效地将CO2还原为高价值的C2+产物63。部分电极的CO2还原产物与测试条件见表S1 (Supporting Information)。
4.1 金属Cu
4.1.1 形貌因素
催化剂的形态和电子结构在电催化还原CO2过程中具有重要作用64,而且产物的选择性在很大程度上依赖于催化剂的形态特征。通过调节反应条件可以实现对形貌的调控65。因此,通过不同的方式制备形貌、尺寸、表面组成各异的金属Cu,会改变催化性能,同时,也会产生不同的C-C偶联方式,从而提高C2+产物的选择性。
Cuellar等人66发现小颗粒的Cu用于进一步还原CO的有效面积更大,因此生成C2产品的效率更高。Li等人24制备了五棱铜纳米线,其上存在低配位边缘位点,增强了中间产物的结合能。Kim和同事52通过电解,使密集排列的Cu纳米粒子集合发生结构转变,成为了立方形颗粒,*CO的覆盖面积可能会增大,增加了C―C偶联的机会,能够在低过电位下有选择性地生成C2-C3产物。Zhao等人67采用电溶解和再沉积的原位合成方法制备的纳米晶须对C2H4具有一定的选择性,这种形貌稳定了CO*并阻止其脱附,并且通过OCCOH*进一步形成C2H4。Wu等人68通过湿化学反应和原位电化学重构的方法制备了纳米枝晶结构的Cu催化剂,其高电化学活性表面积以及丰富的导电网络促进了电子的运输和传质。Cu纳米粒子产生C2H4的电位高于Cu纳米枝晶(Cu NDs),这会进一步延迟C3产物的生成。而Cu纳米枝晶在-0.8 V的时候就可以通过CO二聚体产生C2H4,然后通过CO的插入形成C3产物(图2)。Mangione等人69制备了(100)面,(110)边和(111)角包裹的方形Cu催化剂,对C2产物,特别是对C2H4的选择性增强。并且认为(100)/(110)两个相邻界面之间的协同作用有利于COH―CO偶合。而Kibria等人70通过新型氧化工艺和重构,得到了Cu电极。表面重建过程可能会使Cu表面从稳定的(111)的小平面转变为更具有C2选择性的(100)平面,使其在含有高碱性介质的流动池装置中,完全抑制CH4的产生,C2+产物(乙烯,乙醇,丙醇,醋酸)的法拉第效率达到84%,电流密度达到336 mA·cm-2。

图2 概述了不同的起始电位下CO2电化学还原产生一氧化碳、乙烯、丙醇、丙醛和甲烷的关键中间体和反应途径68Fig. 2 Overview of key intermediates and reaction pathways for CO2ERR for the products CO, C2H4,n-PrOH, propanal, and CH4 at various onset potentials 68.
构建具有复杂功能的原子界面或特定位点,可以更有针对地将催化剂应用到不同的反应当中。Lum等人71将氧化铜箔或薄膜还原成金属状态来制备了氧衍生Cu电极。通过还原同位素标记的13CO和12CO2,并进行产物分析得到这种Cu催化剂对于C―C偶联产物有三种不同的活性位点,一种产生乙醇和乙酸,另一种产生乙烯,还有一种产生正丙醇。单原子与单位点催化剂以其极高的原子利用率和优异的催化性能也在电化学催化中得到了广泛的应用72,73。Jiao等人74制备了具有高度活跃原子界面的Cu原子对催化剂,并将其稳定在Pd10Te3合金纳米线上,生成CO的法拉第效率达到92%。X射线吸收谱(XANES)测试得到分散的Cu原子部分氧化,以Cu4-Ox的形式存在。一个Cu与O结合形成Cu1x+,再进一步与相邻的Cu形成Cu10-Cu1x+原子对,成为了直接参与催化的活性位点。另外两个Cu原子调节占据空位的O原子周围的缺陷,从而稳定了这种原子催化剂。
4.1.2 载体因素
引入合适的载体不仅可以高分散负载纳米催化剂,还能够改变金属铜的电子结构,从而影响其催化性能。例如还原后的氧化石墨烯(rGO)作为包裹层会阻碍纳米铜催化剂形态结构变化(图3),防止选择性位点的丢失,使结构稳定性增强、选择性提高24。Yuan等人75将不规则形状的Cu纳米粒子负载在纸状维生素B6修饰的氧化石墨烯片层上(GOVB6-Cu),GO-VB6中含有吡啶N活性位点,可以降低CO*中间体形成时的能量,并且电极表面的电子转移效率显著增加。电子转移到CO2上形成CO2·-,之后通过电子-质子转移生成CO*,再进一步二聚形成OC―CO*,这可能是关键的决速步骤。然后OC―CO*进一步质子化并且还原生成乙醇。Cheng等人76制备了MOF衍生的Cu负载氮掺杂碳(Cu-NC)的催化剂,具有负电性的N原子从相邻C原子处得到电子,使得带正电的C原子成为了Lewis碱位点,增加了Cu-NC表面对CO2的吸附强度,对C2H4、C2H5OH的生成有一定的选择性。Dinh等人77在C基底气体扩散层上沉积了Cu催化剂,形成了清晰的反应界面。在碱性介质KOH中,生成C2H4的法拉第效率可以达到70%,其中共二聚反应是C2产物在高pH和较低电位下的速率决定步骤50,78。DFT计算显示,铜表面或附近的OH-降低了CO2还原和CO偶合的活化能势垒,从而有利于C2H4的生成。碳纳米颗粒和石墨的存在稳定了铜催化剂表面。通过引入聚四氟乙烯(PTFE)作为气体扩散层,使得CO在反应界面的局部存在率很高,增加了C―C偶合的机会。将疏水性和导电性载体之间的反应界面明确分层,提高了操作稳定性,连续稳定生成C2H4的时间可以达到150 h。说明引入合适的载体,可以提高电催化活性79。
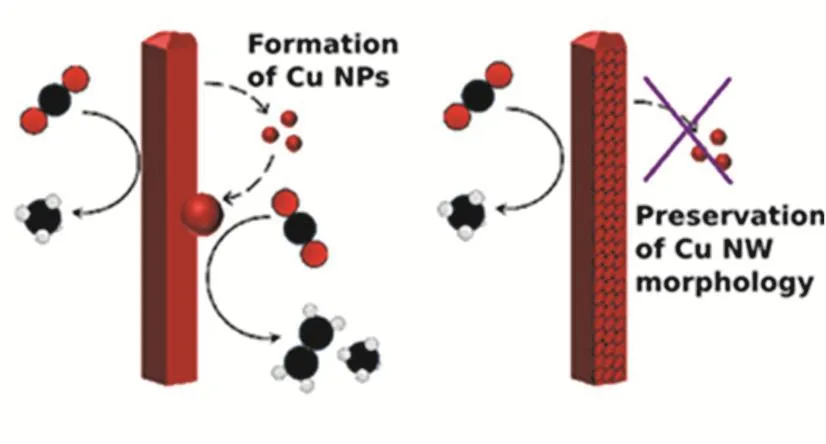
图3 还原氧化石墨烯稳定Cu纳米线结构示意图24Fig. 3 Schematic of rGO stabilizing the structure of Cu NW 24.
4.1.3 电解液因素
在反应电解液中加入离子液体,可以改变Cu表面对中间体的吸附情况,从而影响产物选择性。Zarandi等人80在Cu纳米泡沫电极中以1-丁基-3-甲基咪唑溴化铵(BMIMB)为协同催化剂,在常温常压下对CO2进行了电化学还原。协同催化剂可以有效增强CO2电催化还原的效果81,并且BMIMB是一种具有富电子环的离子液体,能够降低形成CO2·-活化能,它与泡沫Cu电极的协同作用,可以为CO2转化为乙醇等燃料的生产提供有利的环境。电解液中的卤素离子可以稳定中间体,并对反应具有调节作用。Gao和同事82利用电解液驱动Cu纳米结构的变化,原位测试发现C―C偶合过程与铜离子的稳定存在以及被吸附的卤化物有关。在碘离子的存在下,催化剂表面高度粗糙,并且产生了可能有利于C―C偶合的低配位位点,从而使Cu催化剂性能显著改变,进一步将C2+产物的选择性提高到80%。另外,电解质中阳离子大小会影响影响某些反应产物的内在生成速率。经过在Cu(111)上测试了阳离子大小对CO2还原反应的影响,发现HCOO-、C2H4和C2H5OH的部分电流随着阳离子尺寸的增大而增大,而H2、CO和CH4的生成速率受阳离子尺寸的影响较小。在含有较大阳离子Cs+的电解液中进行CO2还原,对C2H4、C2H5OH和HCOO-的生成有更显著的促进作用83。Kim等人52在CsHCO3中测试了Cu纳米粒子催化CO2还原的产物,发现与在KHCO3电解质中相比,C2、C3产物的比例大幅度提高,可以达到90%。
4.2 Cu氧化物
有研究表明,Cu氧化物发生电化学还原反应时产生的低配位表面铜原子,与剩余Cu+之间的协同作用,有利于CO2分子的活化,有利于C―C偶联,促进C2产物的生成84。但也有研究人员通过DFT计算认为,还原电势下亚表面氧对Cu的活性的影响可以忽略不计,并且预测氧化物对CO2还原的中间体吸附没有促进作用85。目前,对于Cu氧化物在CO2电催化还原过程中的活性物质尚无定论,仍需要进一步研究。
4.2.1 形貌与晶面调控
电化学反应可以通过外加电位来诱导表面形貌和组成的变化,这种电化学活化可以避免颗粒团聚,为C―C偶联提供有利条件。Qin等人86选用CuCl作为前驱体,经过一段时间CO2电催化还原后,由于氯离子的消耗和诱导作用,催化剂逐渐转变为Cu和Cu2O的混合相,形态变为立方结构,并将C2H4法拉第效率的提高归因于Cu1+和立方结构的协同作用。Jung和同事87添加半胱胺分子作为固定剂,通过一锅法在碳载体上直接合成分散的Cu2O纳米颗粒。在电催化初始阶段,催化剂由20 nm的立方颗粒转变为紧凑的2-4 nm碎片颗粒,发现C2H4的法拉第效率从27%提高到了57.3%。催化性能的提高是由于排列紧凑、粒径小的纳米颗粒表面与中间体(*CO或其偶联的OCCO*)之间的相互作用发生了改变,以及沿粒子高密度边界间的快速氧扩散。
枝状结构表面粗糙,可以增加反应面积,还可以通过改变pH以及与中间体的结合强度来优化催化剂的性能。Scholten和同事88利用低压氧等离子体对枝状Cu催化剂进行了改性,因为CuxO在还原的过程中并不稳定,而且原位XPS测试证实了在电化学反应后没有氧化物的存在,因此认为是其独特的形貌结构促进了C―C偶合,从而提高了对C2和C3产物的选择性,而与残余的CuxO无关。另外,Feroze等人89通过一步电沉积Cu,再退火的方式,制备了枝状结构的Cu2O电极。电解一段时间后,Cu2O最终被还原为Cu。因此也认为其对C2H4选择性较为稳定的原因是其粗糙多孔结构为CO2的电化学反应提供了更大的活性表面积,而且改变了与中间体的结合强度。Gao等人90也采用了低压氧等离子体对铜箔进行处理,催化剂对烃类和醇类的选择性有所提升。但是通过DFT计算,认为是次表面O、Cu+以及表面重构是提高催化剂性能的原因,并且次表面O强化了碱金属离子对CO*形成的促进作用。Gu等人91通过热退火和电化学还原法制备了表面富含氧空位的部分还原氧化铜(CuOx-Vo)纳米枝晶。电还原一段时间后,O原子逐渐去除,CuOx-V开始还原成Cu,并且产物C2H4也相应减少,因此认为表面氧空位是主要活性位点,它不仅有利于形成中间体*CO和*COH,而且有助于*CH2的快速解吸,从而导致了C2H4的有效形成。Kim等人92也合成了枝化的CuO纳米粒子,并将其沉积在导电碳材料上,C2H4的选择性有了进一步提高,法拉第效率可达70%以上,除了H2外,无其它副产物。通过X射线衍射光谱测定,虽然电化学活化后也检测到少量的表面氧,但是认为Cu+是的主要的氧化物种。枝化的CuO表面积大,区域间存在较多的界面和连接,这导致了电解液中质子的快速消耗,增加了电极表面附近的局部pH值。高的局部pH值会抑制CH4的生成,但可以增强中间产物的C―C偶合,生成C2产物,提高了对C2H4的选择性93。
纳米空腔与核壳结构可以将活性物质限制在一定的区域中,从而增加了C―C偶联的概率,有利于C2+产物的生成。Yang等人94制备的纳米空腔Cu2O催化剂可以使碳中间体在原位形成,增加了中间体在催化剂表面的覆盖率,稳定了活性物种Cu+,防止其还原成Cu0,提升了C―C偶联的机会,从而提高了对C2+产物的选择性(图4)。Cheng等人95合成了核壳纳米立方形的Cu2O@K-PBA,也认为提高CO2还原产物选择性的活性物种是Cu(I)。K-PBA壳结构不仅保护了Cu2O活性核,而且在Cu2O中形成了偶极场,可以稳定具有显著偶极矩的中间体(*CO2、*CO和*OCCO),促进了C―C偶合,抑制了CH4的形成,生成的C2H4/CH4是Cu2O催化剂的两倍以上。

图4 电催化CO2还原时纳米空腔结构中保护Cu氧化态的碳中间体示意图94Fig. 4 Schematic of carbon intermediates that are confined in the nanocavities, which locally protect copper oxidation state during CO2RR 94.
有研究发现,Cu(111)晶面有利于CH4的生成,而Cu(100)晶面则优先生成C2产品。对Cu2O纳米颗粒而言,不同晶面具有不同的性质96,97。Zhang等人98研究发现采用热退火法比湿化学氧化法形成了更厚的氧化层。这种差异可能导致预还原过程中晶面取向和晶界密度的不同,产生更多协调位点、晶界和台阶面,对*CO中间体产生较强的吸附作用,有利于C―C偶联生成C2产物,CO2电化学转化过程中CuxO被还原为Cu0,因此认为活性中心仍然是Cu0。Gao等人26采用湿化学还原法制备了同时具有{100}、{111}两种晶面的Cu2O纳米粒子。通过电催化性能评价,发现它对C2H4的选择性较高。俄歇光谱证实经过电还原过程,Cu2O中只有一小部分转化为Cu0,因此认为氧化物是固有的活性物质。DFT计算表明,含有两种晶面的Cu2O,不仅可以在{100}面和{111}面之间的结合界面上强烈吸附中间体,促进C―C偶合,而且可以很容易地从结合界面解吸生成的C2H4。因此,两晶面之间协同作用非常重要,这也为设计高性能催化剂提供了一种新的方向。
4.2.2 载体修饰
采用具有化学稳定性、热稳定性和优异导电性碳材料担载铜催化剂,可有效提升C2+产物选择性,也是一种改变催化效果的方式。Wang等人99研究发现离子液体功能化石墨薄片(ILGS)可以固定晶体防止聚集。合成的Cu2O/ILGS复合材料对C2H4具有一定的选择性。Cu俄歇谱显示只有很少一部分Cu+转化成Cu0,因此认为Cu+是主要的活性物质,对提高C2H4的选择性有重要作用。Anastasiadou和同事100在气体扩散层上电沉积Cu2O催化膜,使CO2以气相的形式供给催化剂。在电还原过程中,催化剂还原为Cu0,在电位、局部pH值、活性位点和CO2质量运输限制的共同作用下,C2H4选择性在较高的电流密度下显著增加。研究人员还将同位素标记的12CO2与13CO混合物同时通到CuOx纳米粒子上,发现与只通CO2相比,C2H4的选择性明显提高。基于这一发现,使用Ni-N功能化的碳(NiNC)作为基底来模拟上述进气方式,提高了C-C偶联的效率,合成的CuOx-NiNC串联催化剂可以将CO2还原成C2H445。在CO2与CO同时存在的情况下,可能的反应途径是*COOH和*CO的偶联,且与现有的*OCCO二聚途径并存。随着*CO的广泛覆盖和CO(g)的浓度增加,*COOH和*CO的偶联途径在能量上变得越来越有利,从而促进了C2H4的生成。在电极中涂覆一些材料,可能是提高其稳定性的有效方法101。Zhang等人18将MOF衍生的Cu/Cu2O负载于垂直涂覆直接碳化的二维沸石咪唑类骨架的氧化石墨烯(GO/ZIF-L)上,得到催化剂Cu GNC-VL,其形成过程见图5。虽然在电还原过程中一部分Cu(I)转化成了Cu(0),但是整个催化剂还是保持Cu/Cu2O的组成。Cu GNC-VL具有良好的导电性、高活性表面积和电催化稳定性,CO2在Cu(111)上的不对称化学吸附和Cu2O(111)上C-C动力学与热力学的协同作用,促进了*CO的二聚,使其对C2H5OH的选择性提高到了70.52%。

图5 Cu GNC-VL的形成18Fig. 5 Formation of Cu/Cu2O nanoparticles supported on vertically ZIF-L-coated nitrogen-doped graphene nanosheets (Cu GNC-VL) 18.
4.2.3 表面组成调控
原位合成与表征技术在研究催化剂构效关系方面具有重要的意义102。不同表面组成以及Cu氧化态的比例会有不同的催化表现。Iijima和同事103通过红外光谱探究了OH层对C2产物生成的作用。结合DFT计算发现,OH层使CO分子相互靠近,吸附能增强,有利于CO的二聚化,同时在电解过程中还原为C2+产物而不发生任何降解。Chou等人104采用原位表面增强红外吸收光谱(SEIRAS)等表征方法研究了不同氧化态Cu催化剂上的电化学CO2还原机理。研究认为如果表面主要是Cu(I),其CO中间体是顶端吸附态(COatop),剩余的桥联吸附的CO中间体(CObridge)在表面含有Cu(0)的催化剂上形成。表面同时含有Cu(0)、Cu(I)两种氧化态的时候,共存的COatop与CObridge作为反应中间体促进了C2产物的生成。说明铜基催化剂表面的氧化状态影响电催化性能。Chen等人105制备了由Cu(OH)2/CuO纳米复合材料衍生的Cu2O/Cu。通过改变煅烧时间,调控Cu+/Cu0的比例,产生了大量的活性位点和较低的界面电荷转移阻力,有利于CO2的活化和CO二聚反应生成C2产物。另外Aran-Ais等人106研究发现,在脉冲电解条件下,催化剂表面结构以及化学成分发生了变化。并且认为,这种催化性能增强与特定结构基序和表面Cu2O的存在有关。乙醇选择性的提高可能与Cu(I)和Cu(0)物种的共存有关,而C2H4产量主要受Cu(100)台阶长度的影响,并且认为中间产物OCHCH2,ads更倾向于氢化生成OCHCH3,ads,从而产生醇。Shah等人107认为氧衍生Cu催化剂在电还原CO2的过程中仍然有一部分Cu2O一直存在,提出了Cu2O与中间产物之间轨道相互作用的概念。这种作用提高了中间产物的吸附量,在催化过程中起着独特的作用,从而有利于C2产物的生成。
然而,Permyakova等人108制备了低粗糙度类平面的Cu2O薄膜,电催化还原后在超真空的条件下测试发现它被完全还原为Cu0,认为铜氧化物独特的C2产物选择性是其粗糙度增强的结果。Lei与同事109探究了氧化物/氢氧化物衍生的铜电极对C2+产物表现出优异选择性的来源。同样发现,电化学测试后都转变为Cu0,并且认为对C2+产物的选择性与产生的晶体碎片有关而与Cu的特定氧化态无关。
4.3 非金属元素掺杂的Cu催化剂
N、S的掺入会导致电子自旋密度和电荷分布发生改变,从而增加内在活性110。近年来,研究人员利用非金属元素N、S对Cu催化剂进行改性也取得了一定的效果。Yin等人111合成了钙钛矿型一价铜氮化物(Cu3N),这种25 nm的立方体对C2H4具有较高的选择性,同时抑制了C2H6和CH4的形成(生成的C2H4与CH4的摩尔比大于2000)。通过DFT计算认为,优异的性能可能是由于N3-在钙钛矿型Cu3N结构中更有效地稳定了Cu+。Cu3N表面CO―CO偶联具有高能垒,形成其它C2产物的途径被抑制,导致主要发生CO―CHO偶联形成C2H4。Karapinar等人112通过简单的热解方法制备了Cu-N-C材料,可以选择性生成乙醇。结构的显著特点是单原子Cu处在CuN4的配位环境中。在电解过程中,相互分离的位点瞬间转化为金属Cu纳米粒子,这可能是具有催化活性的物质。这个过程是可逆的,电解后又变回独立的CuN4位点。不同电解质的对比实验发现,Cs+的阳离子水化作用更强,减少了阳离子在阴极的吸附,限制了H2的产生,促进了CO的偶联113。这进一步证明了适合的电解质也是提高催化性能的一个重要因素。在使用气体循环装置后,生成C2H5OH的法拉第效率又进一步提高,证明了CO参与了C2H5OH的生成。
用P区元素对Cu进行改性,可提高催化活性。硫属VI组元素和硫化物具有优良的电学性质。硫原子有多种成键形式,易与金属元素形成离子化合物。不同硫含量、组成的铜硫化合物具有不同的相态、形貌和晶体结构。又因为S可以有效抑制析氢,并且与氧的化学性质相似,因此是一种很有前景的电催化剂改性剂114,115。Zhao等人116制备了泡沫镍支撑的硫化铜纳米片阵列(CuS@NF),泡沫Ni骨架上CuS密度较高,形成的多孔3D结构,机械附着力强,稳定性好,对CH4具有较高的选择性。除了CH4,掺S的铜基催化剂最常见的还原产物就是HCOOH或HCOO-。Shinagawa等人114利用湿化学法成功地合成了尺寸可控的碳负载CuS催化剂。并且认为它对HCOO-具有高选择性原因可能是铜与硫的存在改变了关键中间体的结合能。Cu―S与*OCHO的结合能相对于Cu更大,与此同时,这种表面结构可能不利于正电碳原子吸附CO2,因此导致了与CO路径相关的产物的缺失。Zhu等人117采用利于控制形貌和厚度的电沉积法在Cu泡沫电极上合成了Cu2S纳米结构,它对电解质的扩散具有优异的运输特性,具有比多晶Cu更多的活性位点,还原产物HCOOH的法拉第效率达到85%。有研究表明,S的掺入可以抑制析氢和碳氢化合物产生的原因为:对COOH*的吸附作用较弱,而它恰好是在Cu上形成碳氢化合物的前体,这将使HCOO-或HCOOH的产生成为主要过程118。
4.4 Cu基双金属
在铜基催化剂中引入第二种金属形成双金属催化剂,两种金属间的协同作用可以调控催化剂表面中间体的结合强度与构型,有利于C―C偶联,从而生成C2+产物,因此是一种调节选择性和反应活性的有效方法119。
4.4.1 Cu-Ag
Ag对CO2还原反应中间体CO的结合较弱,并且可以通过串联催化或压缩应变抑制表面合金的析氢反应,大幅度地激活Cu以形成多碳产物25,120。基于这一点,Hoang等人121通过电沉积法合成了CuAg合金薄膜,并且添加DAT作为抑制剂,得到了具有高表面积的多孔纳米线形催化剂。它可以在较低的电位下生成还原产物C2H4和EtOH,法拉第效率分别可以达到60%和25%。原位拉曼光谱测试进一步说明Ag促进了Cu2O在CuAg中的形成,Ag作为活性启动子,可以形成较多的CO,使相邻的Cu上有更多C―C偶合的机会,提高了CO和C2H4的生产效率。另外,乙酸可能通过二聚或者插入的方式在CuAg催化剂上形成。在二聚反应中,与Ag结合的*CO被邻近的Cu位点捕获,并与另一个*CO发生偶联。而在插入机制中,*CH2中间体出现在Cu上,它与Ag上的*CO结合生成乙酸122。Kottakkat等人123研究发现,通过氢泡模板电沉积法制备的AgCu泡沫催化剂可以在较低的电位下将CO2还原为CO。拉曼光谱测试发现Ag的加入显著地改变了CO的吸附行为,催化剂中的金属组分在催化CO2还原成CO的过程中具有很强的协同作用。
另外Cu、Ag间界面作用同样是一个重要影响因素。Li等人17制备了具有多种结合位点的Ag/Cu双金属合金催化剂。通过DFT计算发现,Ag的引入对*HCCHOH的影响不大,但这种Ag/Cu催化剂使C2H4反应中间体不稳定,生成路径被抑制,从而促进了EtOH的产生。Huang等人124通过胶体化学法合成的Ag/Cu纳米晶体揭示了Ag/Cu界面在促进CO2还原中的关键作用。电催化实验发现,它生成C2H4的法拉第效率和电流密度与纯Cu相比均有提高。Ag-Cu纳米晶是类葫芦状结构,包括两个分离的金属结构域,共享一个可调的界面,并不是合金的概念。但是通过对比实验发现,Ag域向相邻的Cu域提供高通量的CO可能不是提高C2H4选择性的唯一机制。随后,XPS测试和俄歇谱图证明了电子从Cu域转移到Ag域,通过增强催化剂对C2H4的内在活性来改变整个Cu域与Ag域的催化行为。因此,提出了串联催化和电子效应是Ag/Cu催化剂对多碳产物选择性增加的主要机制(图6)。这为设计高效的CO2还原电催化剂又提供了一种新的选择。

图6 Ag-Cu NDs促进C2H4产生的机制示意图124Fig. 6 Schematic representation of the proposed mechanism of C2H4 promotion in the Ag-Cu NDs 124.Tandem catalysis (CO spillover or sequential adsorption) is induced by the presence of Ag and Cu as segregated domains, and the electronic effect caused by the charge transfer at the interface which intimately binds them.
4.4.2 Cu-Sn
DFT计算和Bader分析说明,Cu与Sn的合金化会导致Sn向Cu的电荷转移,电子从金属原子转移到CO2,导致C=O键断裂形成CO2·-,质子迁移形成HCOO*。HCOO*通过获得一个二次电子而重新排列,之后从催化剂表面解吸并扩散到电解质中,抑制H2和CO的生成。Cu-Sn催化剂对HCOOH/HCOO-具有高选择性源于几何和电子的综合效应125,126。而Morimoto等人127通过理论和实验进一步说明了,Cu3Sn(002)上的Cu位点对稳定H*,COOH*,和CO*中间体具有更大的贡献,Sn的浓度对HCOOH的选择性有显著影响。Jiang等人126通过电子调节构造了丰富的Cu/Sn界面,得到的Cu-Sn催化剂也对HCOO-有很高的选择性。为了进一步提高稳定性,Xiong等人128将水热法制备的CuSn合金纳米颗粒负载在N掺杂的石墨烯载体上。石墨烯片中氮的掺杂导致CuSn纳米颗粒与载体表面的强结合,防止了合金纳米颗粒的团聚,从而提高了材料的长期稳定性。另一方面,它还提高了电子输运能力,有利于吸附CO2,从而提高CO2的还原性能。由于金属化合物之间具有界面作用,Wang等人129制备了多孔泡沫铜支撑的异质结构CuSn电催化剂(Cu3Sn/Cu6Sn5)。DFT计算显示,异质结构Cu3Sn/Cu6Sn5具有适合的氢吸附能,对HCOO*的吸附能大于COOH*,因此不仅抑制析氢,而且有利于HCOOH的生成。
4.4.3 Cu-Zn
Zn具有较低的析氢率和成本,是一种有前景的催化CO2还原的金属。将Zn元素引入Cu催化剂可以通过改变中间体的吸附强度、Cu表面电子结构等来优化催化性能。Ajmal等人12通过电沉积法制备了表面粗糙的CuZn催化剂,它反应面积大,附着力强,从而提高了对HCOOH的选择性。DFT计算表明,Cu表面Zn的存在有利于中间体的稳定,并且可以降低能量势垒。虽然Zn对CO有较高的选择性,但具有适当形貌的双金属CuZn纳米材料可能生成碳氢化合物。Feng等人130首次通过液体脉冲激光烧蚀技术制备了CuZnO纳米粒子,进而由电还原得到CuZn。电催化CO2还原过程中,CuZn中Zn位点产生的CO*可以很容易地转移到最近的Cu位点,通过偶联反应可以转化为C2H4。Zhang等人131为了降低C―C二聚的能垒,通过掺杂过渡金属Zn来调整Cu(100)的电子结构。Zn的加入调整了活性位点的原子排列,使催化剂表面具有电负性,有利于CO2分子的活化,促进了OCCO的生成,从而进一步将CO2有效还原为C2H4。Ren等人132提出了CuxZn电催化CO2还原产生EtOH的一种双位点机制(图7)。首先,四个质子和四个电子分别在Cu和Zn上将2个CO2分子还原为CO。之后,Cu上的CO变成*CH2,而由Zn产生的CO在*CH2附近解吸和迁移。随后,CO插入到Cu和*CH2之间形成*COCH2。两个质子和两个电子再将*COCH2还原为CH3CHO,然后进一步还原为EtOH。除了转化成价值高的碳氢产物,也可以充分利用Zn可以产生CO的特点,制得合成气。Malik等人133通过改变Zn/Cu的元素比例,得到了CO/H2比为0.25-0.74的合成气。合成气是合成CH3OH等许多工业产品的基本原料,CO与H2的比例非常重要,这也为CO2还原的研究提供了一种独特的方向。
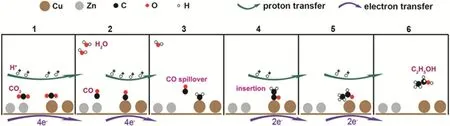
图7 CuxZn电催化CO2还原生成乙醇的机理132Fig. 7 Proposed mechanism for the electroreduction of CO2 to ethanol on CuxZn catalysts 132.
4.4.4 Cu-Au
将双金属系统单元中的原子排列精确地控制在单个纳米颗粒的水平,可以获得具有显著性能优势的功能纳米材料。Cu、Au之间的相互作用会导致Cu催化剂性能的改变。Kim等人134发现,将AuCu无序纳米颗粒通过有序转变可以将这种主要产生H2的材料变为更有活性的CO2还原催化剂。有序AuCu纳米颗粒包含约3个原子厚的金层,直接生长在有序的晶格上。而活性的提高就来自于具有压缩应变的Au覆盖层的形成。另外,两种不同类型的金属纳米粒子之间强烈的相互作用也可以极大地改变它们的电催化性能,比如Cu/Au之间的作用会导致Au本身催化CO2还原的性质消失。Tao等人19报道了由于混合相非合金Cu/Au之间的相互作用,Au作为Cu的促进剂,可以催化CO2电化学还原生成HCOO-,同时还可以将Cu+位点稳定在催化剂表面,从而提高催化性能。而不同于CO、HCOOH/HCOO-等还原产物,Fu和同事135利用联吡啶(bipy)作为连接剂将Au纳米粒子组装到Cu纳米线上,并且还原产物中碳产物的法拉第效率达到90.6%,其中包括25%的CH3CHO,是液体产物的主要成分。Au-bipy-Cu催化作用增强是由于Au(CO2生成CO)、Cu(CO偶联)和双吡啶(CO2*稳定和质子化)的协同作用。
4.4.5 Cu-In
CO是多种碳氢化合物和含氧化合物的原料,研究人员在利用Cu、In两种金属元素提高CO的选择性方面,进行了很多探索。Jang等人136通过电沉积In取代边缘位置的Cu原子形成合金纳米线。它的形貌特征是具有许多晶界、表面积大,并且有含氧空位的In(OH)3。缺氧In和In(OH)3的氧分别带轻微的正电荷和负电荷,在表面形成局部电场,提高了催化生成CO的效率。之后,Xiang等人137通过原位电化学自发沉淀法制备了由In(OH)3覆盖的CuxO纳米核壳结构催化剂,将CO的法拉第效率提高到了90%以上。由于纳米多孔结构增加了表面积、提供了更多的活性位点,因此有利于通往中心的质量运输。Barasa等人138合成了纳米多孔的CuIn催化剂。In上的*COOH具有较强的吸附能,而电还原活化后In在表面富集,因此CO2转化为CO的效率提高。Chu等人139又通过负载在N掺杂碳纳米管上的CuO-In2O3/NCNTs首次例证了CuO-In2O3之间的协同作用使催化剂表面具有更活跃的催化位点,生成CO的法拉第效率达到93%。
4.4.6 Cu-Pd
Pd与CO的结合能较强,与Cu形成合金可以提高CO的产量。另外,不同制备方式与混合方式的Cu-Pd也具有产生CH4与C2+产物的性能。Mun等人140采用胶体法制备了单分散Cu-Pd纳米粒子,Pd元素的加入增加了CO*质子化步骤的势垒,从而抑制生烃,对CO具有较高的选择性。Zhang等人141采用电沉积方法制备了聚合物负载的高度分散的超细CuPd纳米合金催化剂,对CH4有很好的选择性,催化剂TEM图像与生成CH4的法拉第效率见图8。这种活性的增强可能是由于Pd-H位点与Cu-CO位点在CO2电还原过程中的协同作用。而Ma等人119对有序、无序、相分离原子结构的Cu-Pd进行电催化实验,发现有序的CuPd催化剂对C1产物的选择性最高(> 80%),而相分离CuPd对C2产物的选择性(> 60%)较高。基于这一现象,认为在相分离结构中,由于Cu原子的邻近特性,可以提供适合的分子距离和较小的空间位阻,相邻吸附的CO很容易二聚成COCOH中间体,然后主要转化为C2产物。而在有序结构中,Cu、Pd交替排列的结构占主导地位,吸附在Cu原子上的CO倾向于形成CHO中间体,氧原子部分吸附在Pd原子上,从而稳定了CHO中间体的吸附,有利于CH4的进一步生成。说明组分的混合模式在决定催化剂的活性和选择性方面起着重要的作用,这也对CO2还原催化剂的研究具有重要的意义。

图8 (a) CuPd纳米合金与(b)Cu2Pd纳米合金在聚合物膜上的TEM图像,(c,d)不同组成的Cu、Pb纳米合金的一系列测试141Fig. 8 Typical TEM images of CuPd nanoalloy (a) and Cu2Pd nanoalloy (b) on the polymeric film;(c, d) a series of tests on different components of Cu and Pb nanoalloys 141.
5 结论和展望
化石燃料的大量使用造成了大气中CO2含量不断上升,并引发了一系列环境问题。利用可再生能源产生的电能将CO2转化为高价值的化学品和燃料,是同时解决环境与能源问题的有效方式,对可持续发展具有重要意义。金属Cu可以将CO2还原为一氧化碳、甲酸盐、甲烷、乙烯、醇等多种产物,是CO2还原的催化剂中唯一能产生C2+产物的金属。但是它存在选择性较差、稳定性不足等问题。
通过对Cu基催化剂材料进行调控以生成高附加值的C2+产物是近年来的研究热点,归结起来主要有以下两方面:(1) 通过对晶面、缺陷、以及表面应力的控制,调节Cu催化剂表面的电子结构,从而改变对*CO、*CHO等主要中间体的吸附能,打破原有的规度关系(scaling relationship),实现对某一类C2+产物的高选择性。(2) 以Cu催化剂作为母体,引入第二金属构成双金属串联催化剂(tandem)。其中,第二组分金属为易于生成CO的催化剂,如Au、Ag、Zn等。首先CO2原料气体在第二组分金属表面被还原为CO,然后溢流到Cu或二者的界面上进行C―C偶联和进一步的还原。在该策略中,Cu催化剂表面高的CO覆盖度有利于抑制析氢反应,促进C2+产物的产生。
虽然理论上已经提出了许多可能的反应途径和某种特定产物的活性位点,但是绝大多数研究只考虑了反应物、中间体和生成物的热力学自由能,而忽略了电解质和实验环境的影响。所以为了更好的理解CO2在Cu催化剂表面上的电催化反应过程,需要建立更加完善的理论模型来研究实际化学环境对二氧化碳电催化反应的影响。在研究提高理论计算的精确度的同时,还需要在操作条件下进行原位实验验证。由于某些重要中间体在Cu催化剂上的覆盖率较低,所以当前迫切需要提高一些原位光谱技术的信号强度。目前比较有发展前景的技术,如: X射线吸收光谱(XAS)、X射线光电子能谱分析(XPS)、傅立叶变换红外光谱(FTIR)、拉曼光谱(Raman)、微分电化学质谱(DEMS)、电化学原子力显微镜(EC-AFM)、电化学扫描透射电镜(EC-STEM)等等,通过这些检测技术的结合,使得识别某类产物在Cu催化剂上的重要中间体和确定某类产物在Cu催化剂上的反应路径成为可能。
尽管Cu基催化剂可以在适中的过电位下实现较高C2+产物的选择性,但在实际应用过程中还面临一些问题。其一,稳定性问题。Cu基催化剂在使用过程中会发生重构、聚集等问题,从而使催化剂的价态、组成和形貌等性质发生改变,造成催化剂失活。目前,大多数报道的Cu基催化剂的稳定性在100 h以内,与实际应用过程中要求的数千小时的寿命还相去甚远。因此,Cu基催化剂的稳定性问题将是一个重要的研究方向。其二,反应过程强化。对于C1还原产物(如CO,HCOOH),工业要求的最低电流密度为200 mA·cm-2,而对C2H4等多电子产物来说这一数值还应进一步提高。因此,引入气体扩散电极GDE和流动性电解池(flow cell)以提高CO2的传质扩散是提高反应速率一个重要途径。同时通过气体流场设计,增加反应物CO2与Cu基催化剂的接触时间,可有效地提高CO2的转化率。
Supporting Information: available free of charge via the internet at http://www.whxb.pku.edu.cn.

