组学技术在前交叉韧带损伤研究中的应用
朱 婷,周敬滨,徐 昕,3*
(1.上海体育学院 运动科学学院,上海 200438;2.国家体育总局运动医学研究所,北京 100061;3.上海体育学院 国家兴奋剂检测上海实验室,上海 200438)
前交叉韧带(anterior cruciate ligament,ACL)损伤是常见且较严重的膝关节韧带损伤,近年来发生率持续增加(Kaynak et al.,2017)。前交叉韧带重建术后(anterior cruciate ligament reconstruction,ACLR)的再损伤率较高。据报道,在丹麦、挪威、美国、瑞典每年分别约有4.6%、4.3%、3.4%、3.2%ACLR患者需要二次手术(Allahabadi et al.,2020)。ACL损伤易产生创伤后关节炎(post-traumatic osteoarthritis,PTOA)、关节不稳等并发症,甚至可能制约运动员的职业生涯发展(Kharaz et al.,2020)。ACL损伤会造成严重的经济负担,美国每年约花费76亿美元和177亿美元分别用于ACL手术重建和康复治疗(Baker et al.,2018)。因此,对ACL损伤的病因、治疗、预后、康复等问题进行研究,有利于减轻ACL损伤带来的影响。
目前,ACL损伤的研究热点主要包括前交叉韧带重建、神经肌肉训练以及重返赛场的评价指标等(季程程等,2019)。近年来,对ACL运动损伤机理的研究多从解剖学或生物力学角度出发,关于其机制的研究仍不够深入(季程程等,2019)。传统的基础研究方式大多从单一指标或靶点出发对手术疗效、预后等进行评价,难以全面反映治疗的潜在作用机制及效果。
基于基因组学(genomics)、转录组学(transcriptomics)、蛋白质组学(proteomics)和代谢组学(metabolomics)产生的高通量和多组学方法作为全球精准医学的新前沿,能够高效地揭示运动和医学领域中许多疾病的病理、生理等特征,为疾病治疗提供综合、可靠的信息(Rahim et al.,2016)。目前组学技术在心血管、内分泌、骨科等多种系统疾病中已有应用,在疾病的发病机制、早期诊断、预后判断等方面取得了重大进展(Hasin et al.,2017;Rodríguez et al.,2018;Swank et al.,2020)。本文就组学技术在ACL损伤研究中的应用展开综述,旨在加深人们对ACL损伤的认识,为深入研究ACL损伤提供经验借鉴以及临床治疗、康复的理论依据。
1 组学技术概述
1.1 组学研究技术概述
组学方法是高通量、数据驱动、整体和自上而下的方法,该研究依赖与数据库的比对、统计分析以及时间、人力、资金的投入。每种组学数据(基因组学、转录组学、蛋白质组学、代谢组学等)通常能够从自身角度提供与疾病相关的差异列表,但单一的组学数据分析主要是反映反应性过程而不是原因性过程,所以通常使用不同类型组学数据的整合即多组学研究来阐明疾病的潜在致病性原因,或探究能够在进一步的分子研究中测试的治疗靶点(Hasin et al.,2017)。现将医学领域常用组学技术的概述进行汇总(蔡江瑜 等,2017;陈聪等,2019;戴志成等,2020;Hasin et al.,2017;Heaney et al.,2019;Karahalil,2016;Pan et al.,2012;Tsuji et al.,2018),如表1所示。

表1 医学领域常用组学技术概述Table 1 Summary of Common Omics Technologies in the Medical Field
1.2 组学在运动损伤领域运用概述
组学技术在运动损伤领域已有应用,主要涉及病因分析、损伤易感性预测、治疗、预后和康复等方面。有研究通过基因组学技术发现,遗传是肌腱损伤易感性的影响因素,血管内皮生长因子A亚型VEGFA基因与跟腱病风险相关(Vlahovich et al.,2017)。未来,以运动处方和损伤预防为目的的基因检测能够成为遗传信息的一种合法、有效的使用方式,为不同水平运动能力和损伤倾向的个体提供有价值的信息(King et al.,2020)。有研究对急性ACL损伤后的膝关节滑液进行了高通量和高度多重检测的蛋白质组学分析,为PTOA的早期诊断、病情进展和治疗靶点提供理论依据(King et al.,2020)。代谢组学被用于多种骨骼和关节疾病如骨关节炎(osteoarthritis,OA)、类风湿性关节炎、骨质疏松症等的研究,其能够阐明与各疾病相关的潜在分子机制,有助于开发新的治疗靶点,改善患者生活质量(Swank et al.,2020)。
运动损伤组学研究中,常用样本有血清、尿液、关节液、关节滑膜等。血清是代谢组学中最常用的生物体液,也是检测广泛疾病的理想方法。与其他生物体液分析相比,血清分析具有以下优势:能够作为随机样本、定时样本或24 h样本采集;储存期间的稳定性和样品完整性强(Zhang et al.,2012)。与血液相比,尿液样本的获取更为方便且没有侵入性。尿液包含了人体内每个细胞的代谢信息,从中能够找到90%~97%的血浆蛋白(范锦勤等,2013)。尿液组学可能受到生理、环境条件的显著影响,如性别、年龄、日常节律、激素状态、饮食、运动、生活方式和极端环境等。因此,通过尿液分析也可能检测到病理和/或药理学条件的微小和早期变化,是临床蛋白质组学或代谢组学研究的理想生物标志物来源,能够以更有效和正确的方式识别潜在的疾病生物标志物(Wu et al.,2015)。在骨骼和关节疾病的研究中,关节液能够提供比血清或血浆更高浓度的潜在生物标志物,因为关节液与滑膜、韧带、半月板、关节囊和骨直接接触,这些组织中任何结构和代谢的改变都可反映为关节液组成的变化。因此,关节液样本的组学分析可能提示疾病的严重程度和进展(Kiapour et al.,2019)。
2 前交叉韧带损伤相关组学研究
目前,组学技术已被用于ACL损伤相关研究中,并取得了一定的进展,主要包括ACL损伤的病因、治疗、术后并发症特别是PTOA等。组学研究使人们对ACL损伤的认识更加深入和全面。
2.1 前交叉韧带损伤病因的组学研究
ACL损伤具有复杂的内在和外在病因,解剖结构、激素水平、神经肌肉缺陷、基因和环境的作用均为潜在的风险因素(Baker et al.,2018)。当前,研究人员通过组学研究对ACL损伤的相关病因进行了补充和深化。
研究表明,解剖结构如骨的形态、关节的松弛度与ACL损伤存在关系(Myer et al.,2008;Sonnery-Cottet et al.,2014)。胫骨后倾角(posterior tibial slope,PTS)越大,ACL二次损伤的发生率越高(Shelbourne et al.,2021)。移植物的矢状倾角(sagittal inclination angle,SIA)越大,ACL重建后膝关节的稳定性降低(Hagiwara et al.,2021)。但这些研究仅仅是对病因进行单变量分析,没有进行多因素的深入联合分析。编码Ⅰ、V和Ⅻ型胶原的基因(COL1A1、COL5A1和COL12A1)内特定的基因变化与ACL损伤有关,但没有研究阐明上述相关性的潜在机制。组学研究进一步阐明了ACL损伤解剖学因素的潜在途径与作用机制。Baker等(2018)通过GWAS发现3个具有中度关联且此前未被发现的与ACL断裂有关的基因位点:与ACL断裂和rTTW均相关的位点位于1号染色体ROR2基因内,ROR2对软骨和骨骼发育有重要意义;与ACL断裂和TPA均相关的位点位于4号染色体DOCK2基因内,DOCK2基因可促进滑膜炎中免疫细胞的迁移和侵袭;仅与ACL断裂相关的位点位于23号染色体长的非编码RNA(lncRNA)附近,lncRNA对调节基因转录和翻译很重要。Bell等(2012)通过基因组学技术发现,与ACL损伤风险相关的基因变异在很大程度上与关节松弛相关。COL1A1(rs1800012)与更大的膝反张相关,COL5A1(rs12722)和 COL12A1(rs970547)仅与女性膝反张、前膝关节松弛和一般关节松弛的较大幅度相关。该研究表明,胶原基因的变异可能改变韧带结构和行为,产生更大的关节松弛,从而影响ACL损伤风险。
大量研究发现,女性ACL损伤和术后再次受伤的风险大于男性,可能与女性膝关节韧带松弛、解剖结构、肌肉力量、激素水平等因素有关(郑亮亮等,2014)。组学研究表明,成分差异可能在这种差异风险中发挥作用。在ACL重建中,通常使用髌腱(patellar tendon,PT)自体移植物。Little等(2014)基于二维液相色谱串联质谱法确定了男性和女性的PT以及ACL的蛋白质组差异,发现PT与ACL之间存在29种差异蛋白,ACL的Ⅰ型胶原更少、Ⅲ型胶原更多,且富含弹性蛋白、腱糖蛋白C和X、软骨低聚基质蛋白、血小板反应蛋白4和骨膜素。男性与女性的ACL、PT分别有7种、12种差异表达蛋白,女性的乙醇脱氢酶1B和补体成分9含量更高,男性的肌球蛋白含量更高。
研究表明,ACL损伤与遗传因素有关,易感基因主要为胶原基因(l型胶原基因、V型胶原基因和Ⅻ型胶原基因)和基质金属蛋白酶(matrix metalloproteinases,MMPs)相关基因(张成绩等,2012)。研究者利用基因组学技术筛选了与ACL损伤有关的基因与易感位点,对ACL损伤的遗传因素进行补充和深入探究(Kirsten et al.,2020;Laguette et al.,2020;Lulińska-Kuklik et al.,2018),如表 2所示。
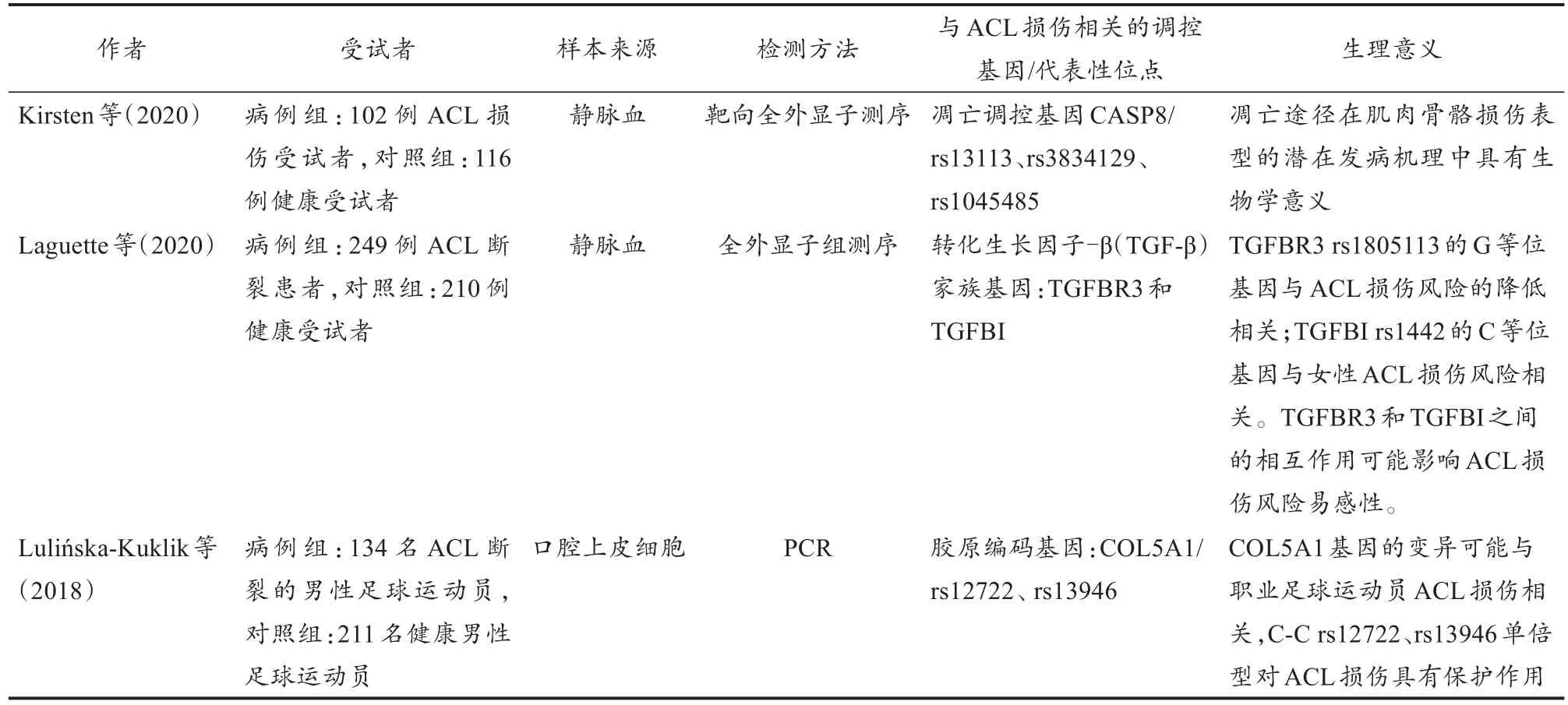
表2 对ACL损伤基因组学相关遗传病因的研究Table 2 Relevant Genetic Etiology Study of ACL Injury
ACL损伤的病因较为复杂。通过组学研究结合生信分析,能够较好地探究损伤因素的内在机制及联系,但在临床中仍需要综合考虑内在和外在因素。一项系统综述认为,需要更多的研究来支持ACL断裂和基因变异之间的明确关联,建议对受试对象进行全基因组研究,以探索更多潜在的基因变异(Kaynak et al.,2017)。有研究认为,肌腱和韧带损伤没有单一的遗传原因,现实情况中,需要通过环境、生活方式与基因谱图结合来分析肌腱和韧带损伤(Longo et al.,2015)。
2.2 前交叉韧带损伤治疗的组学研究
ACL损伤后自愈能力有限,这可能与韧带损伤后关节腔内微环境变化等原因有关(Murray et al.,2007)。ACL重建术是目前治疗ACL损伤的主要方法,影响预后的因素较多,如移植物的选择、固定位置及方式的选择、合并的术式等(钱驿等,2020)。组学研究在ACL损伤的治疗领域有所应用,主要涉及手术时间的选择、手术方式的评价、移植物的成分分析以及治疗和康复方法的评估,能够为ACL损伤治疗提供更全面综合、精准的理论依据和经验借鉴。
有研究通过转录组学对ACL损伤后的手术时间选择进行分析,认为急性期应该成为ACL修复的重点窗口。Brophy等(2016)使用Agilent微阵列平台对不同受伤时间(急性:伤后3个月;亚急性:伤后3~12个月;慢性:伤后12个月)的ACL损伤患者的ACL残余物转录表达情况进行探究,发现慢性ACL损伤中细胞外基质基因(POSTN、COL5A1、COL1A1和COL12A1)的表达较低,急性损伤中代表血管生成和干细胞分化的过程受到影响,亚急性损伤中代表干细胞增殖伴随细胞成分组织/细胞定位的过程被改变。在慢性ACL损伤中,肌球蛋白丝组织、细胞成分组织/细胞定位和细胞外基质组织的转录过程受到影响。该研究表明,ACL的修复能力随受伤时间的延长而下降,急性ACL损伤的治愈潜力最大,因此急性期可以作为ACL修复的重点窗口。
组学技术可以作为一种评价手术方式的新方法。Kiapour等(2019)采用LC-MS/MS蛋白质组学方法对桥接增强ACL修复术(bridge-enhanced ACL repair,BEAR)的软骨保护作用进行探究。BEAR是一种采用经自体血液浸泡的细胞外基质支架修复断裂的ACL的手术方式。结果表明,与BEAR治疗组相比,无进一步治疗组(ACLT组)可观察到更大的软骨损伤。主要体现为ACLT组维生素K依赖性蛋白C水平较高,载脂蛋白A4和软骨中间层蛋白1水平较低,ACLT膝关节促炎蛋白浓度高于BEAR组,抗炎蛋白浓度低于BEAR组。因此,采用BEAR术修复ACL损伤可能维持了对细胞外基质更具保护作用的环境。
ACL手术重建的常用移植方式有3种:自体移植物、异体移植物、人工韧带(潘知常,2018)。通过组学技术对ACL损伤移植物进行结构分析,可为ACL手术治疗提供新的经验借鉴。Kharaz等(2016)使用LC-MS/MS来确定天然肌腱和韧带以及3D肌腱和韧带的蛋白组差异,发现天然肌腱和韧带的关键结构蛋白含量不同,韧带中软骨的蛋白含量更多。与天然组织相比,3D肌腱和韧带构建体含有较少的细胞外基质蛋白和较大比例的细胞相关蛋白,具有相似的细胞外基质蛋白和细胞蛋白质组成,表明细胞来源可能不是肌腱/韧带组织工程的重要因素。
组学技术在研究手术后续治疗方法和运动康复疗效方面也有所应用,这有利于ACL损伤的康复。Kiapour等(2016)通过组织学和功能基因组学方法发现,关节内类固醇注射能够减轻ACL切断后损伤引起的滑膜炎和胶原降解,认为早期关节内免疫抑制可减轻损伤诱导的胶原蛋白片段的增加;单核白细胞募集和M1巨噬细胞活化标志物与胶原片段水平显著相关,并且比滑膜细胞结构的组织学指标更具预测性。Kharaz等(2020)使用LC-MS/MS评估4周高强度跑步运动对大鼠ACL和内侧副韧带蛋白质组的影响,发现短期剧烈的跑步运动干预后,ACL中的细胞骨架蛋白、核糖体蛋白和酶表达水平较高,胶原蛋白和蛋白聚糖等基质体蛋白也较丰富,而内侧副韧带蛋白质组没有改变。
2.3 前交叉韧带损伤后并发症的组学研究
ACL损伤会产生一系列并发症,如PTOA、肌肉萎缩等,对患者的运动功能、生活质量产生影响。目前,组学技术已被用于ACL损伤后并发症病因、机制、防治等的研究。
组学技术的应用为PTOA的诊断提供了新思路和方法。PTOA的诊断主要依赖临床症状、影像学资料,但病程早期患者通常无明显症状和异常影像学表现,一定程度上限制了PTOA的早期诊断。通过组学技术对生物标志物进行监测,能够定量、动态、无创地反映关节内的变化,有助于在出现临床症状前对PTOA进行早期诊断。Mickiewicz等(2015)发现,异丁酸盐、葡萄糖、羟脯氨酸、天冬酰胺、丝氨酸和尿苷可作为ACL损伤重建后早期退行性变化的生物标志物。Maerz等(2018)将几种酰基肉碱代谢物和色氨酸代谢物确定为具有高ROC曲线下面积值和高预测准确度的非侵入性ACL断裂后PTOA的生物标志物。Li等(2020)发现,与正常对照组相比,PTOA组(通过ACL损伤诱导)表达谱改变的蛋白包括细胞色素复合物、中间丝、转运所需的内体分选复合物(ESCRT)-Ⅲ复合物、中间丝细胞骨架和锚定连接的蛋白。
通过组学技术可以发现PTOA的治疗靶点。Haudenschild等(2019)认为,Cdk9抑制或许能为细胞介导的继发性关节损伤提供新的靶点。Zhou等(2018)发现,miR-233转基因模型或miR-233模拟物和抑制剂将用于阐明miR-233调节靶点在膝骨关节炎发病机制中的作用。Brophy等(2019)发现,骨膜蛋白(POSTN)升高可提供与OA不同的亚急性ACL损伤环境的滑液生物标志物,可能引发关节退变,为PTOA早期干预提供机会窗口。
目前,暂无对ACL损伤后PTOA的预后生物标志物进行组学研究,但已有大量研究通过组学技术对原发性OA的预后进行探究,发现了一系列的预后生物标志物,这对PTOA相关研究的开展具有实际参考意义。Attur等(2011)发现,外周血白细胞中IL-1β基因的过表达与疼痛加重和膝关节炎进展风险相关。Takinami等(2013)发现,在OA进展期,载脂蛋白CI、载脂蛋白CⅢ以及甲状腺素运载蛋白N端截断片段的血清浓度明显高于非进展期患者。Zhang等(2015)发现,中度OA患者的左旋甘氨酸和左旋组氨酸表达水平低于重度OA患者。未来,可通过组学技术检测PTOA的预后标志物,进一步区分不同类型的OA。
既往研究发现,ACL损伤和重建术后会导致持续性的股四头肌萎缩,这主要与疼痛、肿胀引发的关节源性肌肉抑制有关(Fukunaga et al.,2019)。目前,有研究者通过组学技术对ACL损伤与股四头肌萎缩的内在联系进行补充。Hunt等(2020)发现,在ACL损伤的前2周内,血清中的几丁质酶-3样蛋白1、胰岛素样生长因子结合蛋白1、胰岛素样生长因子结合蛋白5、肾素和淋巴毒素α1:β2显著上调,组织蛋白酶Z、纤维蛋白原、碳酸酐酶6、γ链纤维蛋白原、脂多糖结合蛋白、C反应蛋白和甲状旁腺激素7种分析物的血清浓度显著降低,确定了补体和凝血级联反应、核因子-κB(NF-κB)信号途径、血小板活化和饥饿素4种通路。该研究证明患者软骨破坏标志物MMP-1的初始水平与胰岛素样生长因子结合蛋白5的变化存在强相关性,认为关节内炎症和软骨改变触发了相关的通信网络,进而导致全身炎症标志物增加,最终引起骨骼肌的改变。
3 总结与展望
近年来,组学技术已被用于运动损伤相关研究,关于ACL损伤的组学研究也逐步开展。通过组学技术,可以对ACL损伤研究进行补充,让其更为深入。ACL损伤的发生与解剖、性别、基因和易感位点等综合因素有关。组学技术可用于检测治疗前后生物体内代谢物、蛋白质的变化情况以及与之相关的反应通路,评价或预测治疗效果,推断治疗作用机制;也用于探索ACL损伤后并发症的特异性生物标志物和治疗靶点。但ACL损伤的组学研究尚处发展阶段,还存在很大提升空间,例如,多组学技术与不同组学仪器和设计方案的整合可以成为下一步研究的重点;可以对ACL损伤后重返赛场进行组学研究,将组学研究与运动学研究相结合,以寻找客观的评价指标以及治疗靶点;可以对ACL损伤后PTOA的预后生物标志物进行探究。随着技术的不断完善和研究的不断深入,组学将能够在ACL损伤研究中做出更大的贡献。

