重症监护室患者伏立康唑谷浓度监测及影响因素分析*
朱芮芮,刘晓青,韩 栋,李 强,刘学松,陈文瑛△
(1.南方医科大学第三附属医院,广东 广州 510631; 2.广州医科大学附属第一医院,广东 广州 510030)
伏立康唑是具有广谱抗真菌活性的第2代三唑类抗真菌药物,是侵袭性曲霉菌感染和克柔念珠菌感染的一线治疗药物,其在成人体内的药代动力学特征为非线性,个体间和个体内存在较大差异,主要经细胞色素酶CYP2C19代谢[1]。年龄、体质量、肝功能、炎症水平、联合用药、CYP2C19基因多态性等均可能影响伏立康唑谷浓度分布[2]。重症监护室(ICU)患者病情较重,病理生理较复杂,如出现严重感染、肝肾功能不全、低蛋白血症,且合并持续性肾脏替代治疗(CRRT)、体外膜肺氧合(ECMO)等辅助治疗时,均可能导致伏立康唑谷浓度在体内产生较大波动,给临床优化应用带来巨大挑战。同时,给药方式也是影响因素之一[3]。ICU患者多数因不能口服或胃肠道功能受限,静脉给药较常见。性别、年龄、蛋白、转氨酶、胆红素水平、联合用药等对ICU患者伏立康唑谷浓度均有影响[4-7]。本研究中探讨了影响ICU患者伏立康唑静脉给药谷浓度的因素,并将影响因素与稳态谷浓度建立关系式,为优化伏立康唑的临床应用提供参考。现报道如下。
1 资料与方法
1.1 一般资料
回顾性收集某三甲医院ICU 2018年1月至2020年1月收治患者的基本资料、治疗过程及用药情况。患者均按药品说明书治疗或预防性静脉给予注射用伏立康唑;伏立康唑谷浓度达到稳态[给予负荷剂量(初次使用第1个24 h,6 mg/kg,每12 h 1次)时,在第5次给药前30 min;未给予负荷剂量(维持剂量为4 mg/kg,每12 h 1次)时,在用药第5~7日早上给药前30 min]并进行监测;排除年龄<18岁,妊娠期,临床资料缺失过多(基本信息、诊断及用药信息缺失,对应谷浓度下检验相关指标缺失>50%)患者。根据监测患者病情变化及临床反应调整维持剂量,给药剂量有:每次300mg、每12h1次,每次200 mg、每12 h 1次,每次200 mg、每日1次,每次150 mg、每12 h1次,每次150mg、每日1次,每次100 mg、每12 h 1次,每次100 mg、每日1次。本研究经医院医学伦理委员会批准(批准号2020-伦审-010)。
1.2 方法
血样处理:将采集的全血标本以5 000 r/min离心5 min,分离、得血浆,取100μL,置1 mL EP管中,加入10μL内标物,再加入150μL甲醇沉淀蛋白,涡旋3 min,12 000 r/min离心10 min,取上清液进样分析[8]。
血药浓度检测:采取在线固相萃取-高效液相色谱法。色谱柱固相萃取柱为Capcell MFPh-1柱(20 mm×4.0mm,5μm),分析柱为Hypersil GOLDC18柱(150 mm×4.6 mm,3μm);流动相,在线固相萃取柱为乙腈-水溶液(8∶92,V/V),分析柱为乙腈-10 mmol/L乙酸铵溶液(42∶58,V/V),梯度洗脱(洗脱程序见表1);流速为1 mL/min;检测波长最大激发波长和最大发射波长(λEx/λEm)分别为254 nm和372 nm;柱温为40℃;进样量为50μL[8]。
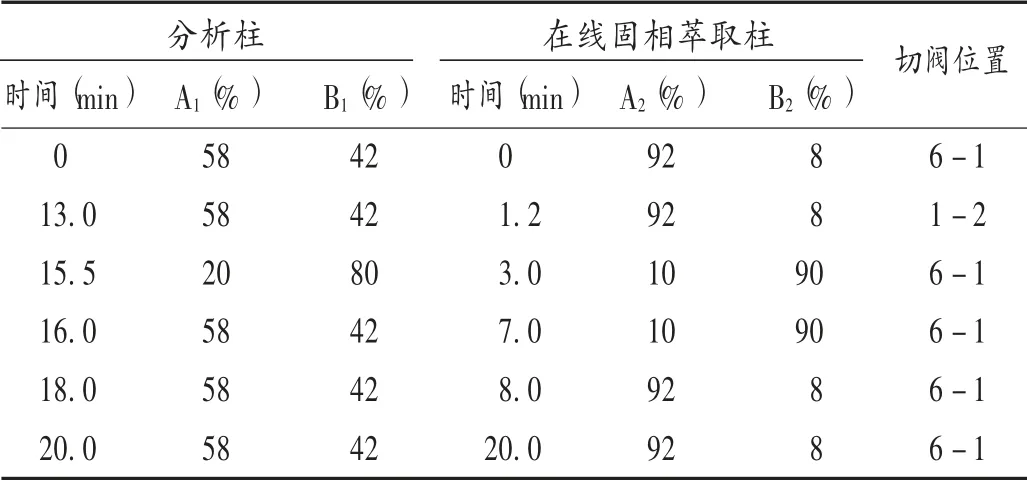
表1 流动相梯度洗脱程序Tab.1 Gradient elution procedure of the mobile phase
1.3 观察指标
采用医院信息系统(HIS)录入患者人口统计学资料,疾病严重程度评分[序贯器官衰竭(SOFA)评分、急性生理与慢性健康状况Ⅱ(APACHEⅡ)评分],临床诊断,伏立康唑给药剂量,伏立康唑稳态血药谷浓度及同日的实验室检测指标[血肌酐(Cr)、尿素氮(BUN)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBiL)、γ-谷氨酰转肽酶(GGTP)、总蛋白(TP)、白蛋白(Alb)],联合用药(泮托拉唑、奥美拉唑、艾司奥美拉唑、糖皮质激素、吗替麦考酚酯、环孢素),辅助治疗(CRRT,ECMO)情况,建立患者的资料数据库。
1.4 统计学处理
2 结果
结果见表2至表6。ICU患者伏立康唑谷浓度变异较大,ECMO患者与非ECMO患者的伏立康唑谷浓度无明显差异(P=0.85);年龄[(62.47±14.41)岁]、性别、每日每千克体质量剂量及ALT,AST,TP,Alb水平均对伏立康唑谷浓度有显著影响,其中每日每千克体质量剂量、AST和Alb水平为独立危险因素,通过模型可建立谷浓度与独立危险因素的关系式,即Cmin=1.22+0.31X1+0.36 ln X2-0.52(X3-32.89)/5.16。其 中Cmin为稳态谷浓度,X1为每日每千克体质量剂量,X2为AST水平,X3为Alb水平。结果Cmin分布于0.34~14.77 mg/L,约76%例次测得值在有效治疗范围内。
3 讨论
本研究结果显示,ICU患者伏立康唑谷浓度变异较大,与LI等[9]的研究结果基本一致。ECMO下与非EC-MO下伏立康唑谷浓度无显著差异,分析原因,可能因纳入分析的两组谷浓度点数量差异较大(非ECMO∶ECMO=220∶47);也可能由于ECMO下收集的谷浓度点一部分处于吸附未饱和状态,而另一部分处于吸附饱和状态,ECMO对伏立康唑谷浓度的影响还需进一步研究。现有研究表明,伏立康唑药代动力学会受到ECMO影响[10]。伏立康唑在ECMO回路中,因易被吸附在管路中而损失,当伏立康唑在管路中未达到吸附饱和时,质量浓度较低,而达到吸附饱和后,因从管路中释放导致质量浓度急剧增加[11]。
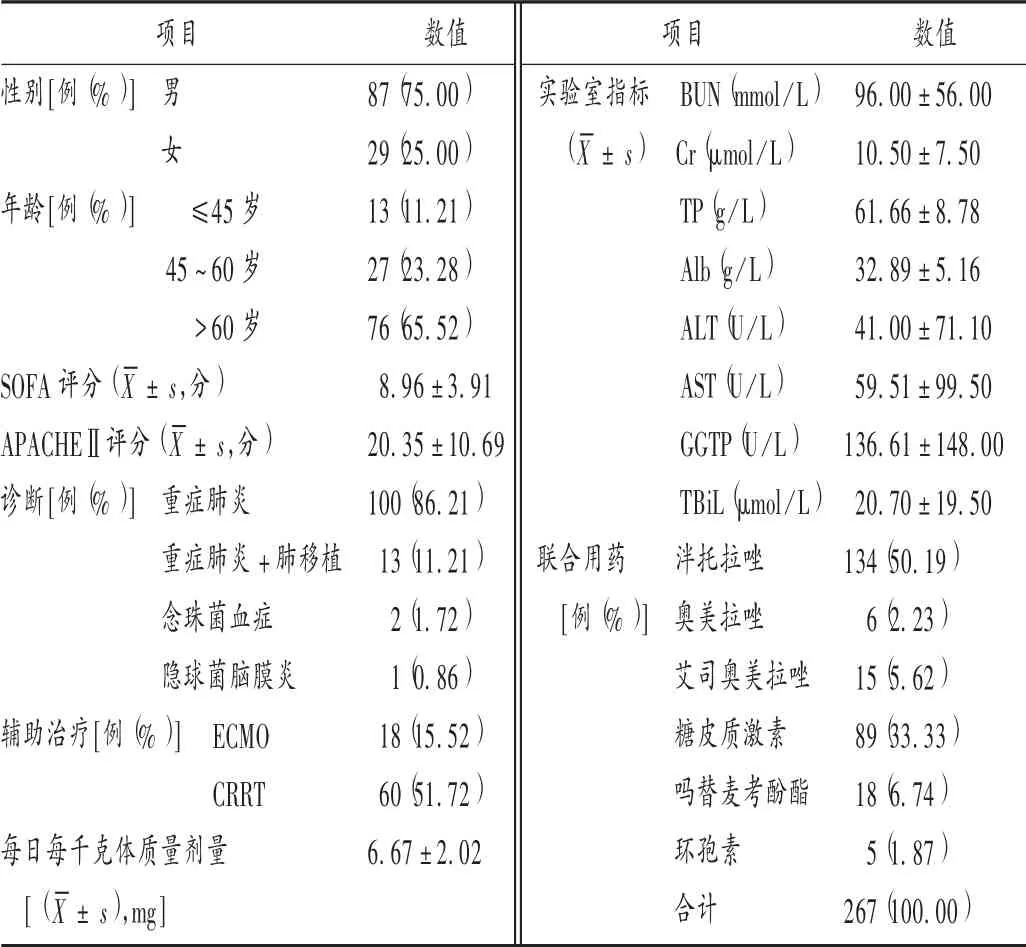
表2 ICU患者基本资料(n=116)Tab.2 The ICU patients′general data(n=116)
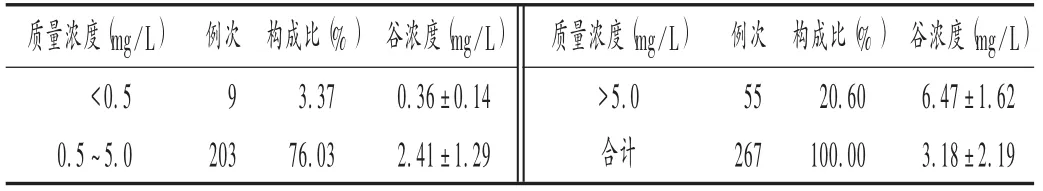
表3 ICU患者伏立康唑稳态谷浓度分布Tal.3 The distribution of steady-state voriconazole trough concentration in ICU patients

表4 ECMO与非ECMO患者稳态谷浓度分布Tab.4 The Distribution of steady-state voriconazole trough concentration between ECMO and non-ECMO patients
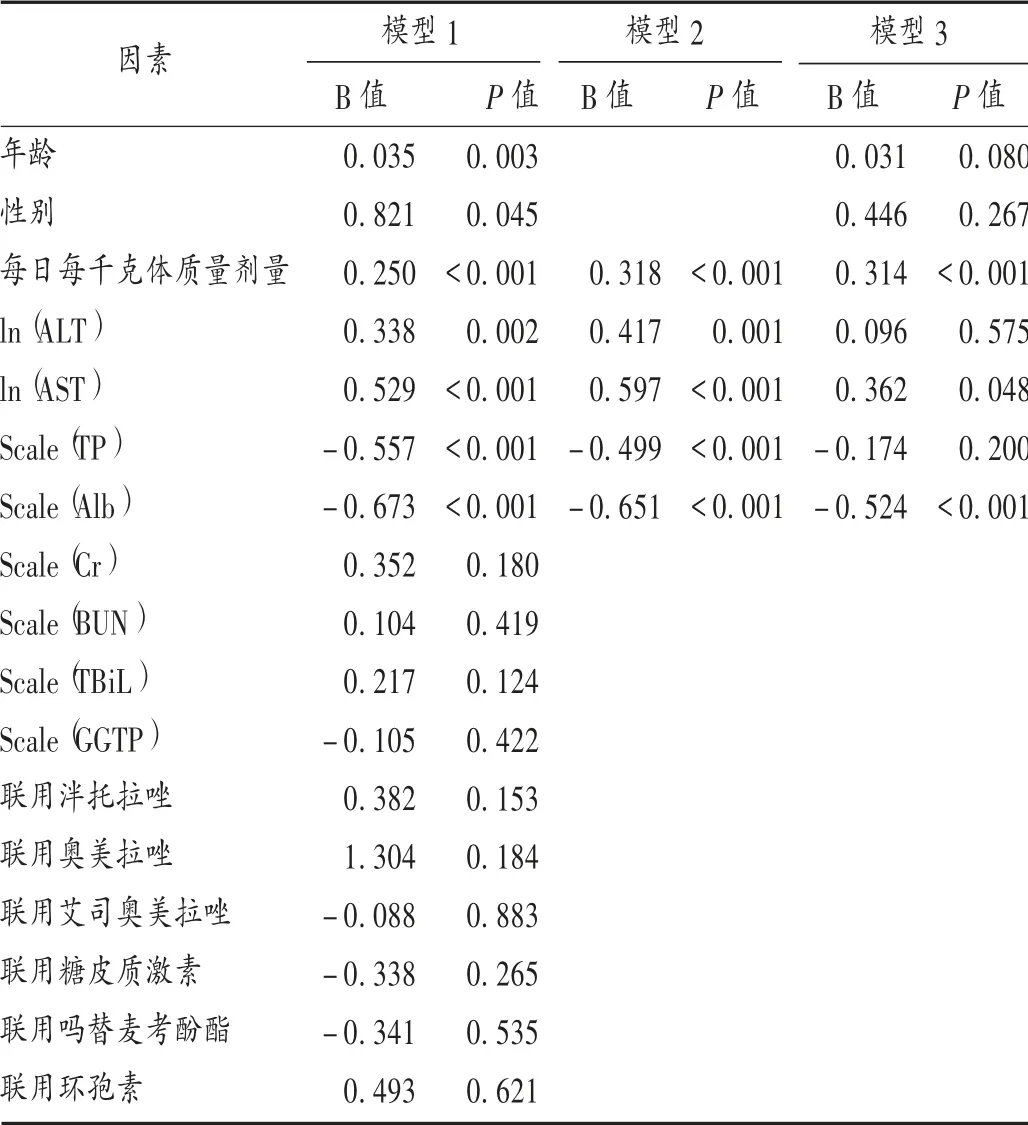
表5 伏立康唑谷浓度影响因素单因素与多因素分析Tal.5 Univariate analysis and multivariate analysis of factors affecting voriconazole trough concentration
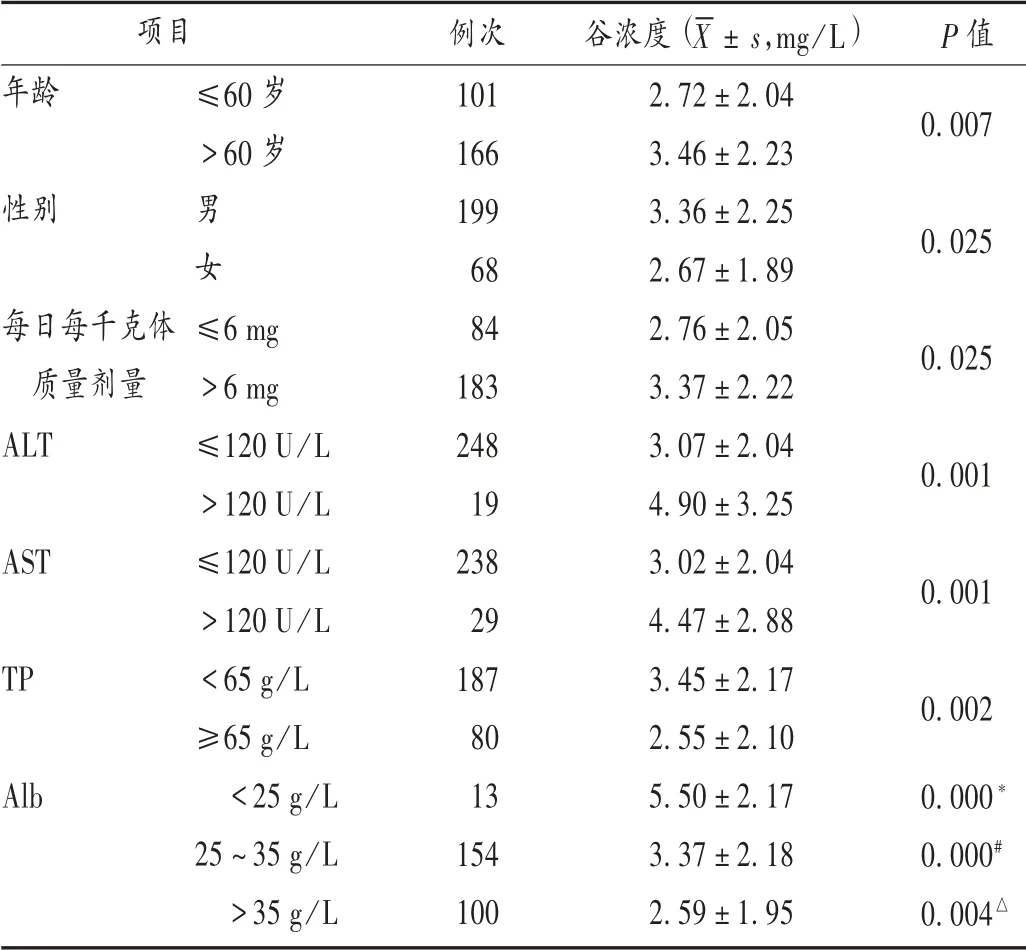
表6 伏立康唑单因素分层分析(n=267)Tab.6 Univariate stratified analysis of voriconazole(n=267)
单因素分析结果显示,年龄、性别、TP、ALT、AST、Alb、每日每千克体质量剂量均影响伏立康唑谷浓度。老年(>60岁)ICU患者伏立康唑谷浓度明显高于非老年ICU患者,与之前的研究结果[9,12]一致。随着年龄的增长,老年人肝脏容积及血容量均显著下降(分别减少20%~40%和35%~50%),导致肝脏对药物的代谢能力下降[13]。女性患者体内伏立康唑谷浓度显著低于男性患者,与LI等[9]及陈茂林[14]的研究结果相反。可能是因为本研究中女性患者年龄[(49.12±19.63)岁]明显低于男性患者[(64.78±10.71)岁]。
TP水平正常(≥65 g/L)患者的伏立康唑谷浓度虽明显低于低TP水平患者,但目前尚缺乏TP影响伏立康唑谷浓度的报道,可能与TP会受Alb水平的影响有关,还需进一步研究证实。相关指南[1]指出,ALT上升至正常上限的3倍作为减少伏立康唑给药剂量的一项指征,因剂量过大会导致质量浓度过高,引起肝功能、神经及视觉障碍等不良反应。本研究结果显示,ALT水平影响伏立康唑谷浓度,当ALT水平上升至正常上限的3倍以上时,伏立康唑谷浓度明显高于其在ALT水平正常或轻度上升时的谷浓度。故ICU患者可根据ALT水平及时调整给药剂量,避免不良反应发生。
多因素混合效应模型分析结果显示,AST和Alb水平及每日每千克体质量剂量是影响伏立康唑谷浓度的独立危险因素。本研究与徐丙发等[5]及王佳等[7]的研究结果一致,AST及Alb水平是重症患者稳态谷浓度的危险因素,谷浓度与AST水平呈正相关,而与Alb水平呈负相关,借助软件模型3分析,假设在控制其他变量下,AST水平每升高约2.70倍时,谷浓度可增加0.36 mg/L;Alb水平每升高3.16 g/L,谷浓度将降低0.52 mg/L。
每日每千克体质量剂量亦为伏立康唑谷浓度的独立危险因素,前者每增加1 mg/(kg·d),谷浓度将增加0.31 mg/L,这与梁培等[4]、徐丙发等[5]及RACIL等[15]的研究结果不一致。伏立康唑符合非线性药代动力学特征,由肝药酶系介导代谢,随着给药剂量的增加,血药浓度不断增加,当代谢酶代谢饱和时,如若再增加剂量,则伏立康唑代谢清除率将降低,血药浓度则不成比例地增加;HOHMANN等[16]研究发现,伏立康唑的生物利用度呈剂量依赖性,口服和静脉给药一致,给药剂量大,则生物利用度高,血药浓度相应升高,表明剂量显著影响伏立康唑血药浓度。伏立康唑在静脉给药时,输注速率影响其浓度和暴露量,即同剂量下,输注速率快则浓度高,药时曲线下面积大[17]。
本研究的亮点为,纳入研究的数据相比之前的一些研究较多;并将影响伏立康唑谷浓度的危险因素与谷浓度建立关系式,通过危险因素的变化,估算伏立康唑谷浓度,为临床用药提供参考。但本研究也存在一定局限,如未对基因型及C反应蛋白水平[18]进行分析(其中未收集C反应蛋白数据是因为数据过少,为避免结果偏差过大)。后期将有针对性地改进,同时结合患者的临床疗效进行进一步研究。
综上所述,ICU患者伏立康唑谷浓度的影响因素较多,患者自身的病理生理变化也较复杂,导致伏立康唑药代动力学变化较复杂,谷浓度变异大,每日给药剂量及AST和Alb水平为影响伏立康唑谷浓度的独立危险因素,需特别留意。同时,伏立康唑为浓度依赖性抗菌药物,临床给药过程中应选择适当的剂量和给药速率,以更快达到有效治疗浓度。

