曝气联合投加菌藻对白洋淀沟壕浮游甲壳动物的影响
彭 亮,代梨梨,陶 玲,李晓莉,李 谷
(中国水产科学研究院长江水产研究所,武汉,430023)
曝气技术因其占地面积小、成本低、见效快,在黑臭河道、湖泊污染治理中应用广泛[1]。在河道、湖泊中进行曝气复氧,有利于提高水体中溶解氧水平和微生物活性,使水体底部形成一个以兼性微生物为主的环境,从而抑制底泥氮磷等营养物质的释放,降低水体中有机污染物浓度,改善水体环境[2,3]。曝气结合投加微生物菌剂是治理黑臭水体的重要生物技术,而在富营养化水体净化中应用较少。微藻是生活在水体中的自养型浮游生物,其生长过程中可利用水体的氮磷等营养物质,对水体具有明显的净化作用[4]。目前采用微生物技术的修复手段多采用曝气结合微生物菌剂对水体进行改善,额外添加藻类的并不多见。
浮游甲壳动物作为天然水域食物链中的关键环节,在淡水生态系统的物质循环、能量流动及信息传递中起着重要作用[5]。通过“上行效应”和“下行效益”,浮游甲壳动物种类和数量的变化直接或间接影响着初级生产者和其他消费者的群落结构[6],从而影响着整个生态系统的结构。因此,了解和掌握浮游甲壳动物群落特征变化,有助于判断水生态系统的结构特点,进一步揭示生态修复中水生态系统的演变规律,有利于制定或调整湖泊生态系统修复和保护方案。
本研究采取曝气联合投加菌藻的生态修复技术对白洋淀沟壕水体进行生态修复,分析试验期间生态修复技术下浮游甲壳动物群落结构动态变化及其影响因素,探究该生态修复技术对浮游甲壳动物群落的影响,以期提出白洋淀水体生态修复技术的改善建议,为丰富生态修复技术内容和改进生态修复技术提供科学基础资料。
1 材料与方法
1.1 试验点基本情况
白洋淀地处冀中凹陷地区,淀区沟壕纵横,沟渠内水生植物蔓延,主要包括芦苇、紫背浮萍、水鳖、金鱼藻等14种植物[7]。在整个湖区366 km2的范围内,以芦苇植被为景观特征的水陆交错带约占36 %,分布在围堤内湖边的洼地和大小淀泊之间[8]。该地区属温带季风半干旱气候,多年平均气温7.3~12.7 ℃,年平均蒸发量1 637 mm,远大于年降水量568.8 mm。
1.2 生态修复试验方案
于2019年7月24日-10月16日开展了中试试验,分别设置生态修复区(T)和未修复区(C),试验区及采样点位置如图1所示。

● 代表采样点
在生态修复区采用层流曝气增氧联合微生物制剂、藻种和藻类营养素投加的方式对水体进行水质改善。层流曝气增氧装置是通过底部微孔产生气流推动水流,形成螺旋状水气混合流的一种气体发生装置,具体如图2所示。选择在天晴时开启,开启时间为每天10:00~16:00;微生物制剂定制于湖北启明生物工程有限公司,主要以芽孢杆菌为主,有效活菌数≥200亿/g,在每台曝气增氧装置处投加,每处投加量为3 kg;投加藻种种类为小环藻,购于天津藻润生物科技有限公司,用无污染的井水或自来水浸泡2 d活化后投加,每1 kg可用于1 m水深的水面0.5 hm2,一般在晴天上午光照条件好的情况下使用;藻类营养素品牌为NualgiTMLakes(印度,Nualgi Nanobiotech),营养素含纳米形式的铁、锰、锌、铜、镁、硼、钙、钼、硫、钴和硅,这些元素为硅藻生长所必需,使用1 L产品用于约2.5×104m3的水面,每半月重复使用一次,使用时用1 L营养液与20 L湖水混合后泼入水体中。

图2 层流曝气装置(A)和工作实景图(B)Fig.2 The bottom aeration unit (A) and working condition of the experiment (B)
生态修复区沟道(1 000 m)共布置20台曝气增氧设备,每台装置覆盖水体面积约3×103m2(沟道宽平均12 m,水深平均5 m)。设备布设完成后,于7月24日开始运行曝气增氧设备,一般选择天晴时开启,运行时间为每天10:00~16:00;设备开始运行后投加微生物制剂,每半月投加一次,共投加4次;在第二次投加微生物制剂时,每台装置处投加1 kg活化的藻种和200 mL营养液,以后每半月投加一次,共投加3次。
1.3 样本采集和分析方法
于曝气增氧设备开启前(7月24日),并在其后15、30、50和75 d采集浮游动物样品并测试水质理化性状,每个点位采集一份水样、一份浮游动物样品。
水温、pH、电导率和溶解氧采用便携式水质分析仪SmarTroll MP(In-situ公司,美国)现场测定,在水面下0.5 m处(记为表层)和底部0.5 m以上处(记为底层)现场测定;采集表层水带回实验室,总氮(TN)、总磷、氨氮、硝态氮、亚硝态氮和化学需氧量等参照《水和废水监测分析方法》[9]进行测定。
每个采样点均采集浮游甲壳动物定性标本和定量标本,定性标本以25号浮游生物网(孔径64 μm)在上层水体呈“∞”字形捞取3~5 min,并将滤取的标本放入塑料标本瓶中,加入2~3 mL浓度为10%的甲醛溶液固定;定量标本用5 L采水器采集40 L表层水样,通过13号浮游生物网后,将滤取的标本放入50 mL塑料标本瓶中,加入2~3 mL浓度为10%的甲醛溶液固定。所有样本经浓缩、固定处理后带回实验室,在奥林巴斯BX53显微镜下鉴定浮游动物种类及其数量。定性及定量样品均在10×4倍的显微镜下用5 mL浮游生物计数框进行观察和计数,浮游甲壳动物枝角类和桡足类的鉴定参照《中国动物志(淡水枝角类)》[10]和《中国动物志(淡水桡足类)》[11],浮游甲壳动物的生物量估算参照章宗涉等的《淡水浮游生物研究方法》[12]。
1.4 数据处理与分析
浮游动物密度:
N=(Vs×n)/(V×Va)
式中:N为1 L水中浮游动物的个体数(ind/L);V为采样体积(L);Vs为浓缩后的体积(mL);Va为计数体积(mL);n为计数所得的个体数。
生物量的计算按照每个枝角类为0.02 mg,桡足类成虫为0.007 mg,无节幼体为0.003 mg的鲜质量换算成浮游动物的生物量。
物种多样性采用Shannon-Wiener指数(H′),其计算公式为:
物种丰富度指数(D)采用Margalef的计算公式:
D=(S-1)/log2N
物种均匀度指数(J)采用Pielou的计算公式:
J=H′/log2S
优势度指数(Y)采用计算公式:
式中:N为浮游动物总个体数;S为浮游动物种类总数;Pi为第i种的个体数与样品中总个体数的比值(Ni/N),ni为物种i的密度,fi为物种i出现的频率,n为所有物种的总密度。实验数据采用Microsoft Excel 2016和IBM SPSS 19.0软件分析,使用Origin 8.0作图。
不同区域环境因子差异显著性采用t检验(Student’st-test),浮游甲壳动物的生物量和密度仅采用均值进行分析。
2 结果与分析
2.1 水质理化因子的变化
试验期间,水体温度随时间推移而逐渐降低,生态修复区和未修复区水体pH值和溶解氧呈现出随时间推移逐渐上升趋势(图3)。比较试验期间试验组与对照组水体表底层水体的水温、pH、溶解氧和电导率,发现生态修复区(T)与未修复区(C)表层和底层水体水温、pH、电导率和溶解氧并无显著差异(图3)。可见,生态修复区与未修复区水体表底层水温、pH、电导率和溶解氧差别并不大。
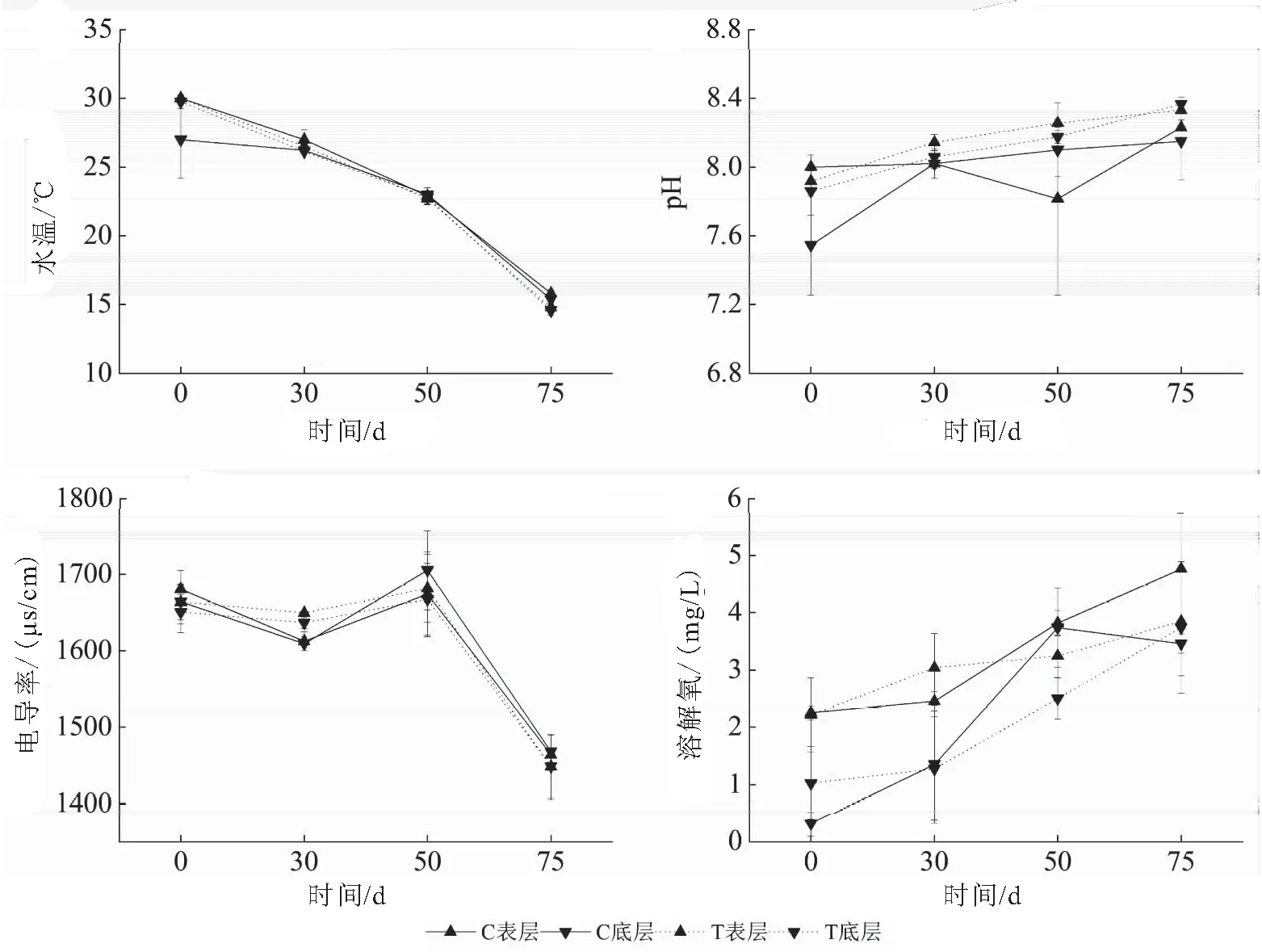
图3 生态修复区(T)和未修复区(C)表、底层水温、pH、电导率和溶解氧Fig.3 Temperature,pH,conductivity and dissolved oxygen of surface and bottom water in ecological restoration area (T) and control area(C) during the experiment time
对生态修复区和未修复区表底层水温和溶解氧差值进行分析(图4)发现,随着曝气时间增加,生态修复区表底层水体温度差、溶解氧差明显低于未修复区。试验开始时,生态修复区和未修复区表底层水温差分别为(3±2.83)、(0.25±0.5) ℃,溶解氧差分别为(1.94±0.50)、(1.19±0.95) mg/L,经75 d生态修复,生态修复区表底溶解氧差仅(0.11±0.21) mg/L。

图4 生态修复区(T)和未修复区(C)表底层水温和溶解氧差值变化Fig.4 The difference value of temperature and dissolved oxygen between the surface and bottom water in the ecological restoration area(T) and control area(C)
图5可知,试验期间,生态修复区与未修复区水体总氮浓度和硝态氮浓度并无显著差异;生态修复区水体总磷浓度在50 d时显著高于未修复区,而在75 d时低于未修复区浓度,但差异并不显著;试验前期(0 d、30 d),生态修复区与未修复区水体亚硝态氮浓度并无显著差别,试验后期(50 d、75 d),生态修复区水体亚硝态氮浓度显著低于未修复区;在试验末期(75 d),生态修复区水体氨态氮浓度显著低于未修复区;试验期间,生态修复区和未修复区水体化学需氧量差别不大,仅30 d时生态修复区水体化学需氧量显著高于未修复区。
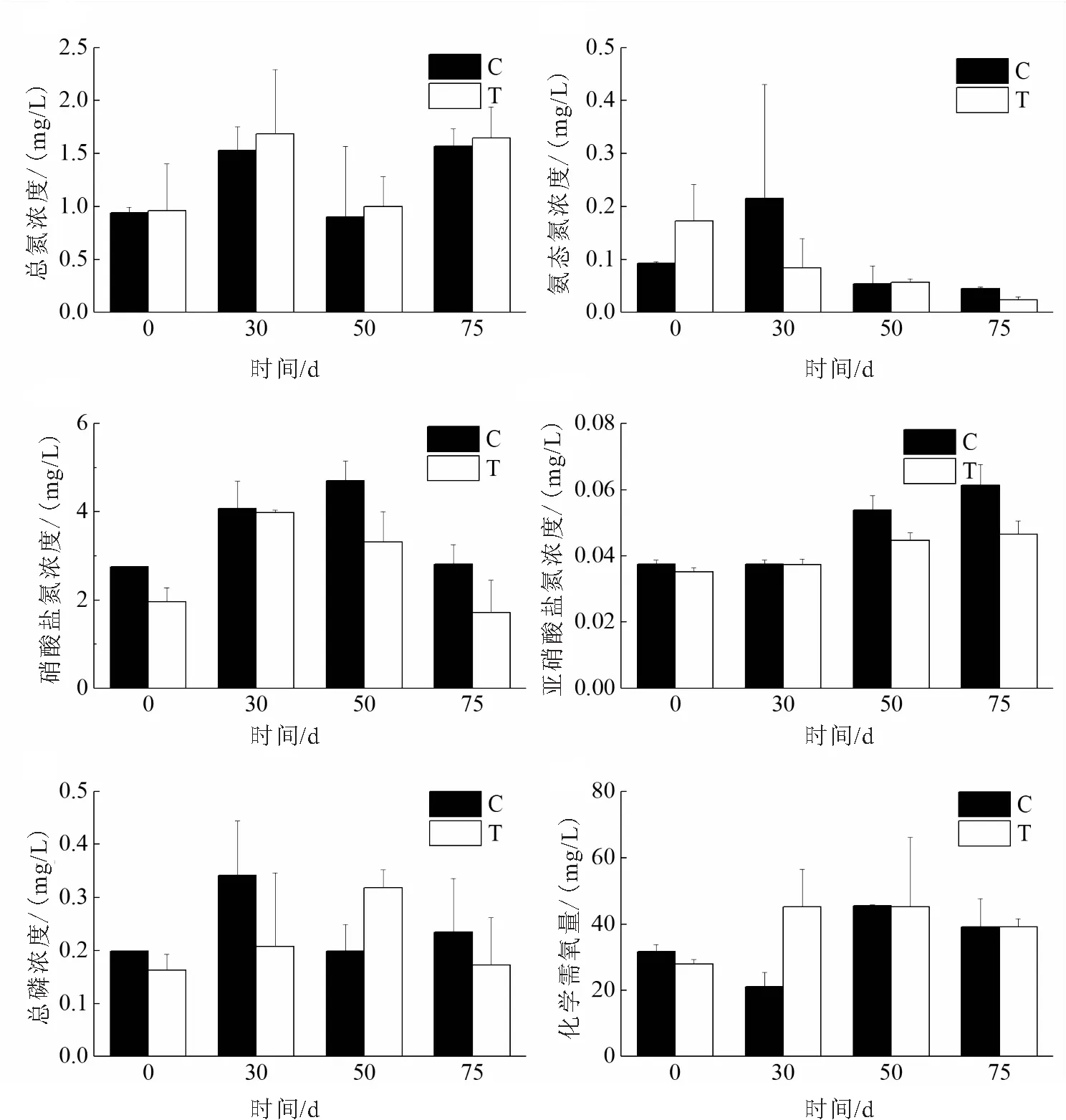
图5 试验期间生态修复区(T)和未修复区(C)水体化学指标变化Fig.5 Major physic-chemical properties of water in ecological restoration area (T) and control area(C) during the experiment time
2.2 浮游甲壳动物的群落结构变化
实验期间白洋淀沟壕中共鉴定浮游甲壳动物20种,隶属1纲3目8科15属,其中枝角类1目4科9属12种,占60 %,桡足类2目4科6属8种,占40 %(表1)。生态修复区共检出13种,其中枝角类6种,桡足类7种;未修复区共检出18种,其中枝角类11种,桡足类7种。研究中,以优势度Y≥0.02为标准,通过计算优势度指数确定优势种。试验期间,生态修复区优势种包括温剑水蚤(Thermocyclopssp.)、桡足幼体(Copepodid)和无节幼体(Copepod nauplii),而未修复区优势种包括短尾秀体溞(Diaphanosomabrachyurum)、长肢秀体溞(Diaphanosomaleuchtenbergianum)、温剑水蚤(Thermocyclopssp.)、桡足幼体(Copepodid)和无节幼体(Copepod nauplii)。随着试验进行,生态修复区的优势种逐渐由枝角类的短尾秀体溞、长肢秀体溞向桡足类的温剑水蚤、桡足幼体和无节幼体转变。
一般以出现频率大于65%的浮游动物作为水体中的常见种。试验期间,生态修复区的浮游甲壳动物常见种有4种(表1),包括枝角类的长肢秀体溞(Diaphanosomaleuchtenbergianum),桡足类的温剑水蚤(Thermocyclopssp.)、无节幼体(Copepod nauplii)、桡足幼体(Copepodid);而未修复区的浮游甲壳动物常见种,包括枝角类的长额象鼻溞(Bosminalongirostris)、短尾秀体溞(Diaphanosomabrachyurum)、长肢秀体溞(Diaphanosomaleuchtenbergianum),桡足类的广布中剑水蚤(Mesocyclopsleuckarti)、温剑水蚤(Thermocyclopssp.)、无节幼体(Copepod nauplii)、桡足幼体(Copepodid)。
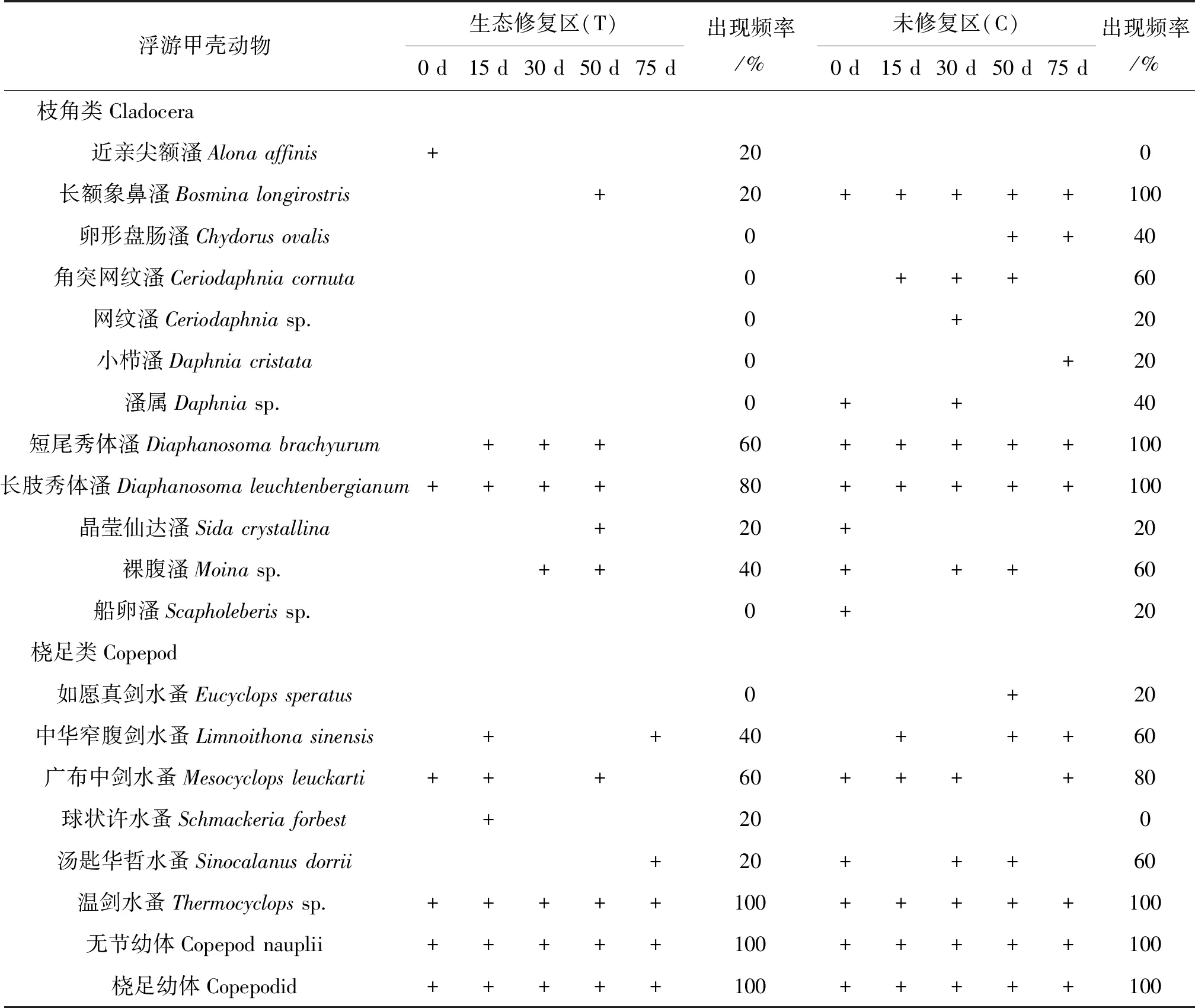
表1 浮游甲壳动物随时间变化及出现频率Table.1 Variation and occurrence frequency of planktonic crustacean species
2.3 浮游甲壳动物的密度与生物量变化
试验期间,生态修复区浮游甲壳动物密度和生物量均低于同一时期未修复区(图6),生态修复区浮游甲壳动物平均密度为11.94 ind/L,平均生物量为0.067 mg/L,而未修复区浮游甲壳动物平均密度为45.16 ind/L,平均生物量为0.323 mg/L。不论是生态修复区还是未修复区,浮游甲壳动物以桡足类为主。其中,生态修复区和未修复区桡足类密度占浮游动物总密度的87.90%~100%,桡足类生物量占浮游甲壳动物总生物量的65.81%~100%。
未修复区浮游甲壳动物的密度和生物量随时间呈现逐渐升高的趋势,到50 d时达到最高峰(94.23 ind/L、0.65 mg/L),而在75 d时呈现断崖式下降,而生态修复区浮游甲壳动物的密度和生物量随时间波动不大,呈现出随时间先缓慢增加后逐渐缓慢降低的趋势(图6)。总体上,生态修复区浮游甲壳动物的密度和生物量均低于同一时期未修复区浮游甲壳动物的密度和生物量。
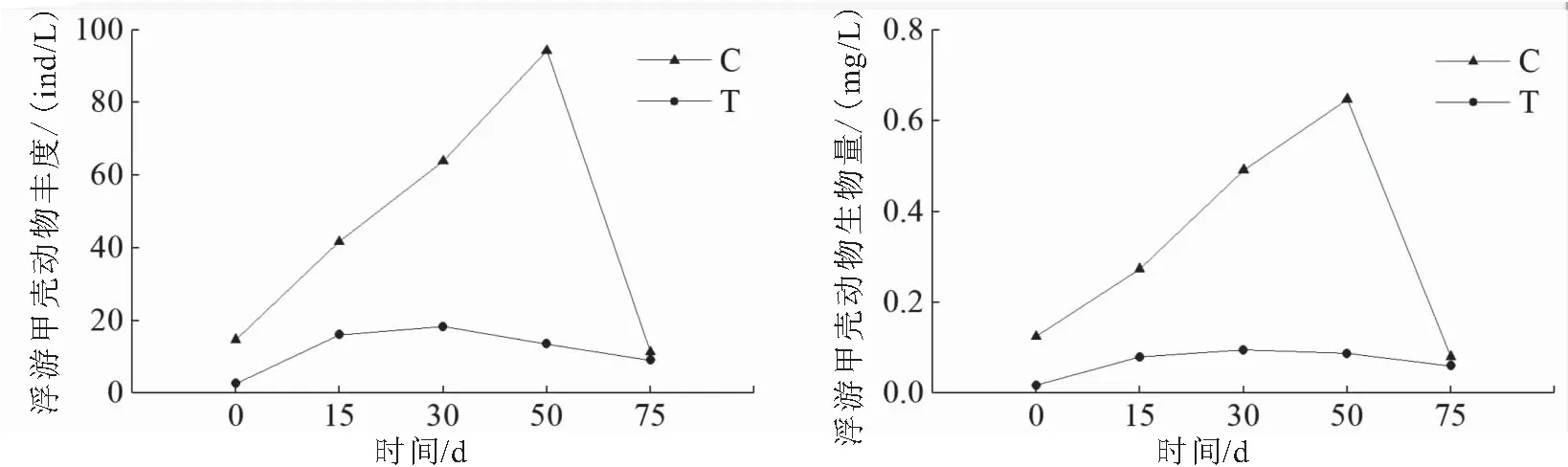
图6 生态修复期间生态修复区(T)和未修复区(C)的浮游甲壳动物丰度和生物量变化Fig.6 The abundance and biomass of planktonic crustacean in the ecological restoration area (T) and control area(C)
从生态修复区和未修复区的各种桡足类和枝角类密度变化(图7)可以看出,随着时间推移,生态修复区和未修复区水体中短尾秀体溞和长肢秀体溞均呈现明显上升,其他枝角类变化并不明显;而桡足类的无节幼体先呈现爆发式增长,后逐渐降低,桡足幼体密度变化不大,且在试验结束时,温剑水蚤逐渐成为主要种类。

图7 生态修复期间生态修复区(T)与未修复区(C)的各种枝角类和桡足类丰度变化Fig.7 The abundance of cladoceran and copepod species in the ecological restoration area(T) and control area(C)
2.4 浮游甲壳动物的多样性指数
计算浮游甲壳动物的Shannon-Wiener指数、物种丰富度指数和物种均匀度指数,并对其进行比较分析,发现生态修复区水体浮游甲壳动物的Shannon-Wiener指数H′值和物种丰富度指数D值多数低于同一时期的未修复区浮游甲壳动物的相应指数(图8-A/B),其中,生态修复区Shannon-Wiener指数平均值为1.67,未修复区平均值为1.87;生态修复区物种丰富度指数平均值为1.99,未修复区平均值为2.08。而生态修复区水体浮游甲壳动物物种均匀度指数则高于未修复区(图8-C),生态修复区平均值为0.62,未修复区平均值为0.54。
试验期间,生态修复区浮游甲壳动物Shannon-Wiener指数H′值由1.83降至1.59,物物种丰富度指数D值由3.63降至1.26,物种均匀度指数J值由0.71降至0.69(图8-A/B/C);而未修复区浮游甲壳动物Shannon-Wiener指数H′值和物种均匀度指数J值均呈现出先升高后降低的趋势,且试验结束时H′值和J值均高于初始值,物种丰富度指数D值则呈现出先降低后逐渐升高的趋势,试验结束时低于初始值。

图8 生态修复期间生态修复区(T)与未修复区(C)浮游动物多样性指数的变化Fig.8 The diversity index of planktonic crustacean in the ecological restoration area(T) and control area(C)
2.5 浮游甲壳动物优势种与水环境因子的关系

3 讨论
3.1 生态修复技术对水体水质的改善
消除水体耗氧物质,稳定水体的高溶氧状态是生态修复的第一步,因此,本研究采用了层流曝气装置来提高水体溶解氧,使水体逐渐处于高溶氧状态。试验过程中,虽然生态修复区和未修复区的表、底层水体温度、溶解氧、pH等差别不大,但是,对表底层水体温度和溶解氧的差值分析发现,生态修复区使用了底部层流曝气装置,能明显缩小表底层水间的温度和溶解氧差值,使表底层水体状态趋于相似,打破了水体的自然分层状态。
试验期间,生态修复区和未修复区总氮、硝态氮浓度差别并不大,而生态修复区亚硝态氮和氨态氮浓度明显降低,且显著低于未修复区,可见,生态修复技术明显改善了生态修复区的亚硝态氮和氨态氮浓度。这可能是由于一方面水体溶解氧浓度的升高改善了水体的氧化还原状态,影响了参与水体氮循环微生物(氨氧化菌、亚硝酸盐氧化菌、反硝化菌等)的活性[13],另一方面,投加的微生物制剂可能较好地降低亚硝态氮浓度[14],从而降低了亚硝态氮浓度。
生态修复区总磷浓度随时间逐渐增加,并在第50 d时达到最高值,且显著高于未修复区,这可能是层流曝气装置的曝气过程搅动了泥水界面,使部分可溶解性的磷从底泥中释放,导致水体中总磷浓度逐渐上升[15],并在50 d达到最高值。本研究中,水体总磷、总氮浓度并未明显减少,反而有一定程度的升高,且在试验结束时,总磷、总氮仍处于较高水平(0.17 mg/L、1.65 mg/L),水体仍处于富营养化状态。尽管利用微生物对水体脱氮和有机质降解的研究已有很多报道[16,17],且其有效性得到了一致认可,但在本研究中,微生物制剂的添加并没有促进水体氮素的减少,且反而使化学需氧量有一定程度的升高,这一结果可能与投加微生物量不足和曝气系统长期搅动水体的综合作用有关。湖泊水体原位处理的化学方法较多,但生物方法多采用水生植物的修复技术,直接投加微生物菌剂来净化富营养化水体仅作为一个试用手段进行,其作用效果受温度、溶氧等多方面综合影响,需根据实际情况作进一步优化。
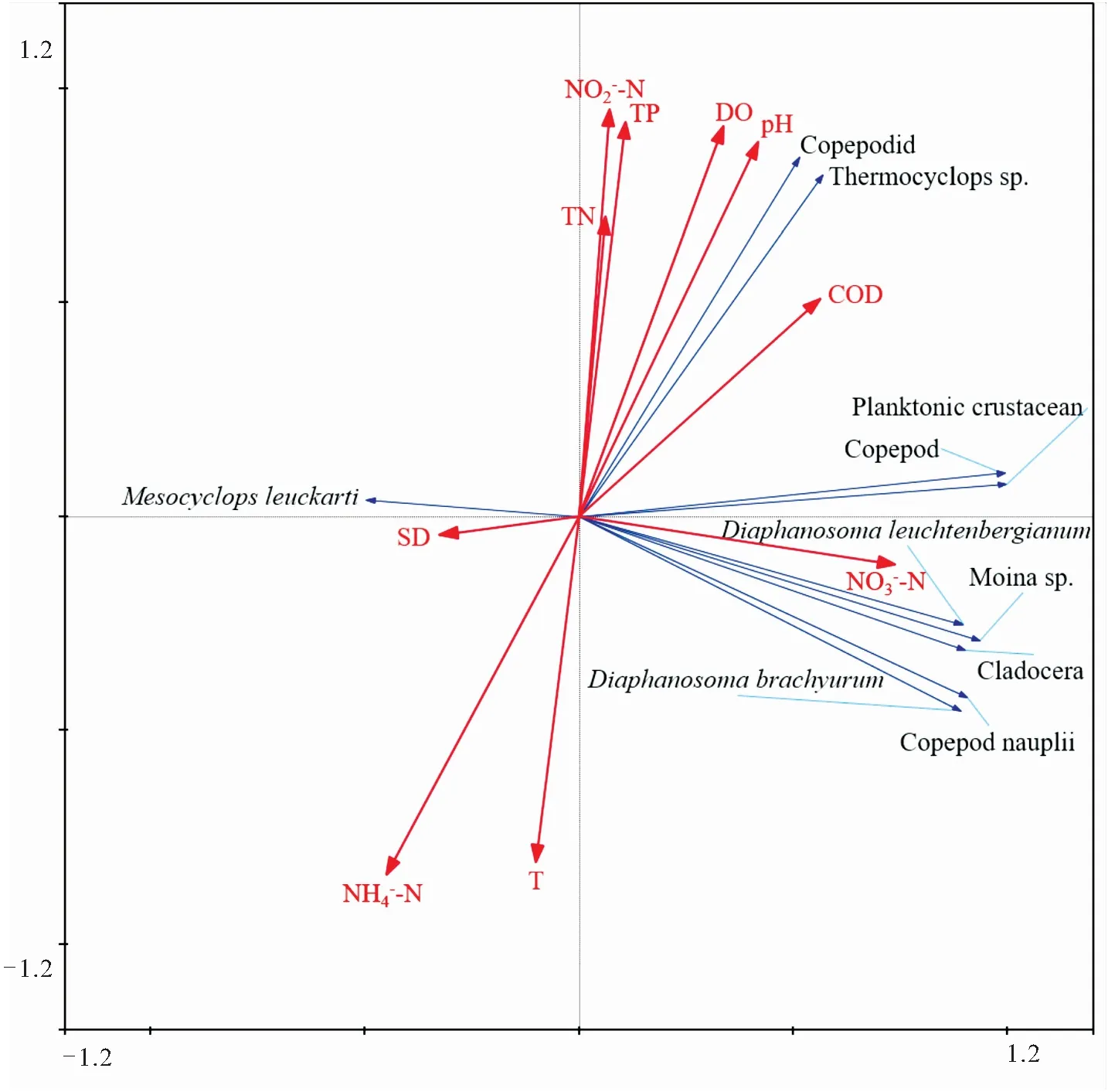
图9 生态修复区浮游甲壳动物丰度和环境因子的RDA排序图Fig.9 RDA ordination plot of the abundance of planktonic crustacean and environment variable
3.2 浮游甲壳动物群落结构的变化特征
随着试验进行,生态修复区的优势种逐渐由枝角类的短尾秀体溞、长肢秀体溞向桡足类的温剑水蚤、桡足幼体和无节幼体转变。谢丹平等[18]利用氧化塘-河道原位生物修复方法对广州市古廖涌黑臭水体进行治理时发现,浮游动物群落结构发生显著变化,水体修复完成后,枝角类优势种为微型裸腹溞,桡足类优势种为无节幼体。与本研究结果一致,曝气增氧作用下,浮游甲壳动物趋于向幼体和小型种类演变。这可能是多方面因素综合影响的结果,一方面,生态修复区添加了硅藻藻种和硅藻营养素,当硅藻的浓度较高时,桡足类的产卵率和孵化率显著降低[19],而且以往研究还发现,桡足类雌体在摄食高浓度硅藻后,存活率也会显著下降[20],另一方面,曝气增氧装置引起的水体搅动也是改变浮游动物组成的一大因素,陈伟民等[21]利用大型生态模拟槽,研究不同水动力过程对浮游动物种类组成演替的过程中发现,强水动力引起水体悬浮物增加、水体透明度降低,从而影响浮游动物的摄食等,使水体中的浮游动物向小型的枝角类演变。
生态修复区和未修复区浮游甲壳动物整体变化趋势一致,但浮游甲壳动物密度和生物量均低于同一时期未修复区浮游甲壳动物的密度和生物量,这与刘爱芬[22]在小围隔试验中的结果一致。这一结果可能与试验期间微生物制剂的投加有关,刘爱芬在试验中发现,微生物菌剂停止投加后,处理组的浮游动物很快恢复,甚至于超过对照组。同时,生态修复区同时投加硅藻藻种和硅藻类营养素,理论上增加了浮游动物的食物来源,一定程度上应该引起浮游动物的增多。但是,可能由于硅藻对浮游动物抑制作用降低了其产卵率和孵化率[20],引起浮游甲壳动物生物量显著降低。
3.3 生态修复技术对浮游甲壳动物多样性指数的影响
随着时间推移,生态修复区浮游甲壳动物的H′值、D值和J值均低于试验开始的值,可见,该生态修复技术在一定程度上降低了浮游甲壳动物的多样性。这可能与硅藻藻种和硅藻营养素的投加有关,一方面某些浮游甲壳动物因摄食硅藻,导致产卵率和孵化率降低[23,24],另一方面,藻类营养素中的硅酸盐、氯化物等也与浮游动物物种分布相关[25],这两方面的作用可能直接导致浮游甲壳动物的种类组成和密度大幅降低,从而降低了浮游甲壳动物的多样性。
一般而言,Shannon-Wiener指数H′值常用于反映群落的复杂程度,数值越大表明群落复杂程度越高;Margalef丰富度指数D值与浮游动物种类数相关,主要反映物种种类的分布情况,数值越大表明种类数越多;Pielou均匀度指数J值则表示浮游动物个体数目分布的均匀程度,数值越高表明浮游动物群落结构越稳定。试验末期,生态修复区浮游甲壳动物H′值和D值低于对未修复区,J值高于未修复区。可以看出,整体上,生态修复区浮游甲壳动物群落结构复杂程度有所降低,物种丰富度也有所降低。
3.4 环境因子与浮游甲壳动物群落之间的关系

本研究过程前后,水体温度由30 ℃左右降至15 ℃左右,温度的变幅可能引起浮游动物出现一定的变化,研究人员对多地湖泊浮游动物群落结构与环境因子研究表明,温度是影响浮游动物丰度和群落结构变化的重要环境因子[32-34]。在本研究中,温度变幅太大可能导致浮游动物群落结构出现明显变化,从而影响对生态修复技术效果评价,因此,需进一步开展小试或模拟试验,综合评价该生态修复技术的效果,提出修复技术的优化方式和最佳适用范围。

