SH2B1通过活化PI3K/Akt通路促进胶质瘤细胞增殖
刘 岩 韩风伟 闫丽娜 张琳娜 王淮兴
(承德医学院附属医院神经外科,承德067000)
胶质瘤源自脑神经上皮细胞恶性病变,是最为常见的原发性颅内肿瘤,占颅脑肿瘤的40%~50%[1-2]。3-磷酸肌醇激酶(phosphoinositide 3-kinase,PI3K)/蛋白质丝氨酸苏氨酸蛋白激酶(protein-ser‐ine-threonine kinase,Akt)作为经典的信号通路,在胶质瘤发生发展中起重要作用[3]。SH2B1是SH2B家族成员,是一类含有SH2和PH结构域的信号接头蛋白,在机体生长发育、免疫调节、增强神经因子诱导方面发挥调控作用[4-5]。近年来研究显示,SH2B1基因在食管癌、非小细胞肺癌等恶性肿瘤组织中高表达,提示其可能与癌症发生有关[6-7]。但有关SH2B1在胶质瘤中的表达尚未有研究,因此本研究以胶质瘤U87细胞为研究对象,利用siRNA干扰技术沉默SH2B1基因表达,观察U87细胞增殖、凋亡及PI3K/Akt通路的改变,旨在为SH2B1在胶质瘤发生发展中的效应机制提供理论依据。
1 材料与方法
1.1 材料 人脑星形胶质母细胞瘤U87细胞(CCY1528)购自上海酶研生物科技有限公司。10%胎牛血清、青霉素-链霉素、胰酶、RPMI1640培养基购自美国Gibco公司;Trizol抽提试剂、逆转录试剂盒、BCA试剂盒购自BioRad公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;SH2B1-siRNA、NC-siR‐NA购自南京锐真生物技术有限公司;CCK8相关试剂购自美国Sigma公司;鼠源一抗SH2B1、Ki67、PC‐NA、Bax、Bcl-2、p-PI3K、PI3K、p-Akt、Akt、GAPDH、羊抗鼠二抗购自上海圣克鲁斯生物技术有限公司。
1.2 方法
1.2.1 细胞培养 U87细胞培养基为含100 U/ml青霉素-链霉素、10%胎牛血清的RPMI1640培养基,于37℃、5%CO2培养箱中培养。
1.2.2 细胞转染 收集对数生长期的细胞以2.0×105个/孔接种于24孔细胞板,利用Lipofectamine 2000转染法转染胶质瘤U87细胞,操作严格按照试剂盒说明书进行。实验分为3组:SH2B1-siRNA转染组(正义 链5′-GCCGGUCAUGUCCAAAGUATT-3′,反义链5′-UACUUUGGACAUGACCGGCTT-3′);NC-siRNA组(正义链5′-GATCCGGACCACCGCATCTCT-3′,反义链5′-GCCTGGTGGCGTAGAGATGTA-3′)和未经处理的胶质瘤U87细胞为空白组。转染48 h后收集各组转染成功的细胞,提取总RNA及总蛋白供后续研究使用。
1.2.3 qRT-PCR检测SH2B1 mRNA表达 收集1.2.2中各组U87细胞,提取总RNA,利用逆转录试剂盒进行逆转录,通过逆转录buffer 2μl,上游引物0.2μl,下游引物0.2μl,dNTP 0.1μl,逆转录酶0.5μl,DEPCS水2μl,总体积为10μl的反应体系得到cRNA。后利用qRT-PCR试剂盒检测各组细胞中SH2B1 mRNA表达情况。以GAPDH为内参基因,反应条件如下:94℃预处理30 s,59.5℃30 s,72℃1 min,72℃5 min,以上3步骤循环40次。引物序列见表1。
1.2.4 CCK-8法检测细胞增殖 收集1.2.2中各组U87细胞以2×104个/孔接种于96孔板,每组设置6个复孔,在37℃、5%CO2、饱和湿度条件下培养24 h、48 h、72 h后,每孔加入10μl浓度为1.5 mg/ml的CCK-8,继续培养4 h,读取吸光度值(A),测定时以未接种细胞只加培养基孔的A值为空白对照调零。
1.2.5 平板克隆法检测细胞增殖 收集1.2.2中各组U87细胞,胰蛋白酶消化、重悬,梯度稀释后接种至含RPMI1640培养基的培养皿中(1 000个/皿),移液器吹打分散均匀,置于培养箱常规培养,待出现肉眼可见克隆后,弃去上清,PBS清洗,4%多聚甲醛固定,0.5%结晶紫染色,20 min后,清洗染色液,空气干燥。计数3组细胞克隆形成数。
1.2.6 细胞凋亡情况检测 收集1.2.2中各组U87细胞,胰蛋白酶消化,预冷PBS洗涤2次,离心弃上清,配制成1×106个/ml的细胞悬液,100μl细胞悬液加入5μl AnnexinV‐FITC和5μl PI混匀,室温避光孵育15 min,流式细胞仪检测凋亡率。实验重复3次。
1.2.7 Western blot检测蛋白表达情况 收集1.2.2中各组U87细胞,提取总蛋白,通过BCA蛋白试剂盒检测细胞中总蛋白含量,蛋白总上样量为60μg,10%SDS-PAGE分离蛋白,转移蛋白至PVDF膜,5%脱脂牛奶室温封闭2 h。封闭完成后加入适宜 浓 度SH2B1、Ki67、PCNA、Bax、Bcl-2、p-PI3K、PI3K、p-Akt、Akt一抗,4℃封闭过夜,24 h后吸取一抗,清洗PVDF膜后,加入相应二抗(山羊抗鼠)37℃封闭1 h,滴加ECL显色液,用凝胶成像系统获取蛋白条带图片,用Tanon 600图像分析系统拍照,对蛋白质表达量进行定量分析,以GAPDH为内参。
1.3 统计学分析 采用统计学软件SPSS22.0进行数据分析,计量资料符合正态分布的数据以±s表示,多组间比较行方差分析,两组间比较采用LSD-t检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 si-SH2B1抑制SH2B1表达 与空白组相比,NC-siRNA组SH2B1 mRNA及SH2B1蛋白表达差异均无统计学意义(P>0.05),SH2B1-siRNA组SH2B1 mRNA及SH2B1蛋白表达显著降低(P<0.05,图1)。
2.2 s i-SH2B1抑制U87细胞增殖 CCK-8实验显示,与空白组相比,SH2B1 siRNA组48 h、72 h后OD值显著降低(P<0.05);与NC-siRNA组相比,SH2B1siRNA组转染后48 h、72 h后OD值显著降低(P<0.05)。而空白组与NC-siRNA组各时间点OD值差异无统计学意义(P>0.05,图2)。

表1 qRT-PCR引物Tab.1 qRT-PCR primers
2.3 si-SH2B1抑制U87细胞平板克隆形成数 与空白组相比,SH2B1-siRNA组克隆形成个数显著降低(P<0.05);与NC-siRNA组相比,SH2B1-siRNA组克隆形成个数显著降低(P<0.05)(图3、4)。而空白组与NC-siRNA组克隆形成个数差异无统计学意义(P>0.05)。
2.4 si-SH2B1促进U87细胞凋亡 与空白组相比,SH2B1-siRNA组细胞凋亡率显著升高(P<0.05);与NC-siRNA组相比,SH2B1-siRNA组细胞凋亡率显著升高(P<0.05,图5、6)。空白组与NC-siRNA组细胞凋亡率差异无统计学意义(P>0.05)。

图1 各组U87细胞中SH2B1 mRNA及蛋白表达情况Fig.1 Expression of SH2B1 mRNA and protein in U87 cells of each group

图2 各组不同时间增殖情况比较Fig.2 Comparison of proliferation in each group at differ⁃ent time

图3 平板克隆法检测各组U87细胞增殖情况Fig.3 Proliferation of U87 cells in each group was detect⁃ed by plate cloning method
2.5 si-SH2B1抑制Ki67、PCNA、Bcl-2蛋白表达,促进Bax蛋白表达 与空白组相比,SH2B1-siRNA组Ki67、PCNA、Bcl-2蛋白表达显著降低(P<0.05),Bax蛋白表达显著升高(P<0.05);与NC-siRNA组相比,SH2B1-siRNA组Ki67、PCNA、Bcl-2蛋白表达显著降低(P<0.05),Bax蛋白表达显著升高(P<0.05,图7)。空白组与NC-siRNA组Ki67、PCNA、Bax、Bcl-2蛋白表达差异无统计学意义(P>0.05)。
2.6 si-SH2B1抑制p-PI3K/PI3K、p-Ak/tAkt表达与空白组相比,SH2B1-siRNA组p-PI3K/PI3K、p-Ak/tAkt表达显著降低(P<0.05);与NC-siRNA组相比,SH2B1-siRNA组p-PI3K/PI3K、p-Ak/tAkt表达显著降低(P<0.05,图8)。空白组和NC-siRNA组p-PI3K/PI3K、p-Ak/tAkt表达差异无统计学意义(P>0.05)。
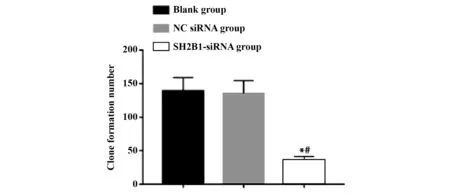
图4 各组U87细胞克隆形成数比较Fig.4 Comparison of number of U87 cell clone formation in each group

图5 各组U87细胞凋亡率比较Fig.5 Comparison of apoptosis rate of U87 cells in each group

图6 各组U87细胞凋亡率比较Fig.6 Comparison of apoptosis rate of U87 cells in each group

图7 各组U87细胞增殖、凋亡相关蛋白表达情况Fig.7 Expression of proliferation and apoptosis related proteins in U87 cells of each group
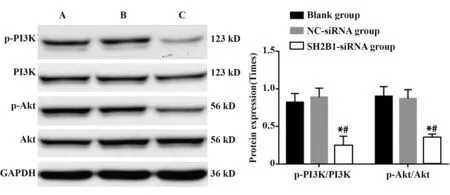
图8 各组PI3K/AKT通路相关蛋白表达情况Fig.8 Expression of PI3K/Akt pathway related proteins in each group
3 讨论
SH2B1作为SH2B家族新成员,含有SH2与PH结构域的信号接头蛋白,在生长发育、代谢平衡等方面发挥重要调节作用[8]。SH2B1是酪氨酸激酶受体A与细胞膜相连的结合蛋白,主要介导含酪氨酸磷酸化的信号转导途径,存在于下丘脑、肝脏、脂肪等多种组织及细胞中[9]。关于SH2B1的研究多集中在糖尿病及肥胖症中,SH2B1参与胰岛素敏感性及血糖平衡的调节,且可调节能量代谢及体重[10]。研究显示,SH2B1参与神经生长因子诱导的神经分化,猜测SH2B1在颅脑疾病中发挥作用[11]。SH2B1在非小细胞肺癌等恶性肿瘤中高表达,且发挥促癌基 因 的 作 用[6,12]。 本 研 究 采 用siRNA靶 向 沉 默SH2B1基因表达策略,探讨SH2B1在胶质瘤细胞中的效应及可能机制。
恶性肿瘤的发生发展与肿瘤细胞增殖、凋亡失衡有关[13]。细胞增殖及细胞凋亡均是由一系列基因级联控制的过程[14]。本研究中,与空白组及NC-siRNA比较,SH2B1-siRNA组U87细胞转染48 h、72 h U87细胞增殖率、克隆形成数显著降低,凋亡率显著升高,提示沉默SH2B1基因表达可抑制U87细胞增殖,促进U87细胞凋亡,表明SH2B1通过影响肿瘤细胞增殖、凋亡参与胶质瘤发生发展。Ki67及PCNA与细胞增殖密切相关,Ki67是增殖相关的核抗原,与细胞有丝分裂密切相关,在细胞增殖过程中必不可少[15];PCNA只存在于正常增殖细胞及肿瘤细胞内,与细胞DNA合成密切相关,是细胞异常增殖的关键蛋白[16]。Bax、Bcl-2具有同源性,均属于Bcl-2基因家族,Bax主要发挥促凋亡作用,Bcl-2发挥抑制凋亡作用[17]。本研究中,与空白组及NC-siR‐NA组相比,SH2B1-siRNA组U87细胞Ki67、PCNA、Bcl-2蛋白表达显著降低,Bax蛋白表达显著升高,进一步提示沉默SH2B1表达可抑制U87细胞增殖,促进U87细胞凋亡。
研究表明,PI3K/Akt信号通路在肝癌、乳腺癌等多种肿瘤中失调,主要表现为PI3K及Akt过度活化[18-19]。PI3K含有p85和p110两部分,其中p85羧基端有SH2结构域,p85与p110在SH2区结合,Akt是PI3K/Akt信号转导通路的中枢,其活化与肿瘤恶性进展有关[15]。Akt共含有3个亚基:N端的PH结构域、中间的激酶/催化结构域、C端的调节结构域,其中PH结构域可介导Akt进行膜转位,进而激活Akt。PI3K可通过激活下游靶点Akt,通过磷酸化作用使其转化为p-Akt,进而激活或抑制下游基因表达,介导细胞增殖、凋亡。LU等[20]研究显示,SH2B1过表达可通过激活PI3K/Akt信号通路活化降低海马神经元细胞凋亡。另有研究显示,Akt磷酸化可调控Bax、Bcl-2表达发挥抗凋亡作用[21]。在本研究中,与空白组及NC-siRNA组相比,SH2B1-siRNA组p-PI3K/PI3K、p-Ak/tAkt表达显著下降,提示沉默SH2B1基因可能通过抑制PI3K/Akt信号通路活化,从而抑制U87细胞增殖、促进细胞凋亡。
该研究为胶质瘤的靶向治疗提供了新思路,但本研究也存在一定不足,胶质瘤细胞增殖、凋亡由多基因、多通路共同调控,是十分复杂的网络结构,其具体机制有待进一步研究。

