川芎嗪通过JAK 2/STAT3信号通路调节线粒体自噬减轻心肌缺血再灌注损伤的机制研究
陈乘波 陈天宝 许友榜 (福建医科大学附属泉州第一医院心内科,泉州362000)
心肌缺血是心脏性猝死的主要原因之一,冠状动脉再灌注是治疗缺血性疾病最有效的方法,但其可能加重细胞损伤,即缺血再灌注损伤。由于心肌细胞无法再生,减少心肌细胞缺血再灌注损伤的策略受到了广泛关注[1]。目前,心肌细胞缺血再灌注损伤的防治主要包括通过腺苷与别嘌呤醇减少炎症反应、阿托伐他汀钙降低TNF-α、IL-1β浓度与心肌细胞凋亡及心肌缺血预处理等[2]。心肌再灌注期由于血氧的突然再补给而伴随活性氧(reactive oxy‐gen species,ROS)的积累。线粒体不仅是心肌细胞产生ATP的关键细胞器,也是ROS的主要来源和靶点。ROS可通过过氧化氢离子氧化细胞膜和细胞器脂质,这种脂质过氧化进一步导致反应性醛的增加,进而导致线粒体损伤。内源性酪氨酸激酶2(ja‐nus kinase signal transducers 2,JAK2)是一种信号转导因子,信号传导和转录激活因子3(signal transduc‐ers and activators of transcription 3,STAT3)为其受体,JAK2与STAT3结合后可启动目的基因表达,促进多种生长因子表达,减少细胞凋亡[3]。AG490为JAK2激酶的有效抑制剂,可抑制JAK2/STAT3信号通路的激活[4]。川芎嗪是从中药伞形科植物川芎提取出的四甲基吡嗪有效成分,具有抗血小板聚集、扩张血管等作用,临床常用于心脑血管疾病的治疗,但对于心肌缺血再灌注损伤的保护作用与机制鲜有报道[5]。本研究采用川芎嗪治疗心肌缺血再灌注损伤,阐明其保护作用并对可能的机制进行探究。
1 材料与方法
1.1 材料
1.1.1 实验动物与试剂 SD雄性大鼠购自北京维通利华实验动物技术有限公司,体重200~220 g,生产许可证号:SCXK(京)2017-0011。戊巴比妥钠、肝素钠购自北京索莱宝科技有限公司;AG490、TTC、DAPI购自西格玛奥德里奇(上海)贸易有限公司;Bcl2、Bax、琥珀酸脱氢酶(succinate dehydrogenase,SDH)及β-actin一级抗体购自细胞信号技术有限公司;抗JAK2、STAT3一级抗体购自圣克鲁斯生物技术公司;线粒体膜电位检测试剂盒(JC-1)购自中山公司;脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TdT-mediated dUTP nick labeling,TUNEL)染色试剂盒购自罗氏公司。
1.1.2 主要仪器 Langendorff小动物心脏灌注装置购自安徽正华生物仪器设备有限公司;Bio-Rad凝胶成像系统购自美国Bio-Rad公司,Leica RM2135组织切片机购自德国Leica公司;LIOOS600T荧光显微镜购自日本尼康公司。
1.2 方法
1.2.1 动物造模及分组 SD大鼠腹腔内注射戊巴比妥钠(50 mg/kg),腹腔注射500 U/kg肝素钠20 min后,仰卧位固定于无菌操作台。采用冠状动脉结扎术建立缺血再灌注模型,将左上肢、右上肢和左下肢接针形电极,用以记录大鼠心电图(elec‐trocardiogram,ECG)和心率(heart rate,HR);于气管处行纵切口,插管连接动物呼吸机。同时参照文献[9]采用6-0线结扎左冠状动脉前降支,稳定10 min后,收紧线结即造成左冠状动脉闭塞以致大鼠心肌缺血,由左冠状动脉所支配的局部心肌发绀,心脏局部搏动受限,血压下降,ECG显示ST段波动较大或抬高或降低,呈现心肌梗死改变,视为大鼠心脏缺血成功,缺血30 min后再灌注60 min,以心电图ST抬高≥0.15 mV为结扎成功的标准,松开线结后ST-T回落超过50%为再灌注成功的标志。造模成功后将大鼠随机分为:对照组(IR组)、川芎嗪治疗组(Lig组)、川芎嗪治疗且AG490处理组(Lig-AG组)及AG490处理组(AG组),15只/组。Lig组造模前灌胃3 mg/L川芎嗪;Lig-AG组灌胃3 mg/L川芎嗪且含有5 mg/L的AG490;AG组灌胃5 mg/L的AG490;给药体积5 ml,IR组给予等体积生理盐水。
1.2.2 LVDP、HR、±dp/dtmax及CF的检测 心脏缺血再灌注结束后,通过传感器(Biopac System)检测各组大鼠LVDP、HR及CF,该传感器与通过左心房插入左心室的注水乳胶球囊相连。心肌功能指数由左室舒张压和最大压力变化率(+dp/dtmax)决定。在实验开始时,通过充气使LVEDP调整到大约5 mmHg。隔离的心脏被恒温玻璃罩(37℃)包围以保持温度。所有数据均采用AcqKnowledge 3.8.1软件包和Biopac数据采集系统进行记录和存储。
1.2.3 心肌梗死面积检测 心功能检测结束后,迅速剥离大鼠心脏,并沿长轴连续切成6片。在37℃、1%TTC孵育10 min后,分别称重6个心肌切片。计算机辅助平面测量法(OPTIMASv5.2)评估梗死区域的年龄百分比。标准化梗死面积(%)=梗死面积/总危险面积×100%。
1.2.4 心肌细胞凋亡检测 TUNEL染色检测心肌细胞凋亡水平。采用双染色法,TUNEL染色定量凋亡核,DAPI染色定量心肌细胞核总数。在400倍放大条件下,随机选取5个区域,对绿色染色的TUNEL阳性细胞和所有蓝色DAPI染色的细胞进行计数。细胞凋亡指数(%)=总阳性凋亡心肌细胞/总肌细胞数×100%。
1.2.5 线粒体膜电位检测 采用线粒体膜电位检测试剂盒(JC-1)染色,荧光显微镜观察拍照。自噬细胞经JC-1染色后观察应显示绿色荧光,正常细胞经JC-1染色后应显示红色荧光,常用红绿荧光的相对比例来衡量线粒体去极化的比例。从红色荧光到绿色荧光的转变作为细胞凋亡早期的检测指标之一,荧光定量采用Image J软件。
1.2.6 氧化应激水平检测 取部分大鼠心脏组织,试剂盒测定SOD活性和H2O2、MDA、GSH、GSSG水平。GSH和GSSG的值用于使用能斯特方程计算线粒体氧化还原电位(Eh)。
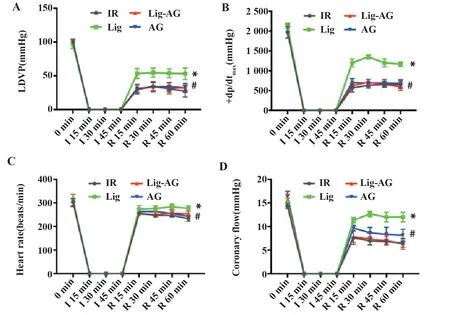
图1 Lig对缺血再灌注心脏功能损伤的影响Fig.1 Effect of Lig on ischemia reperfusion injury
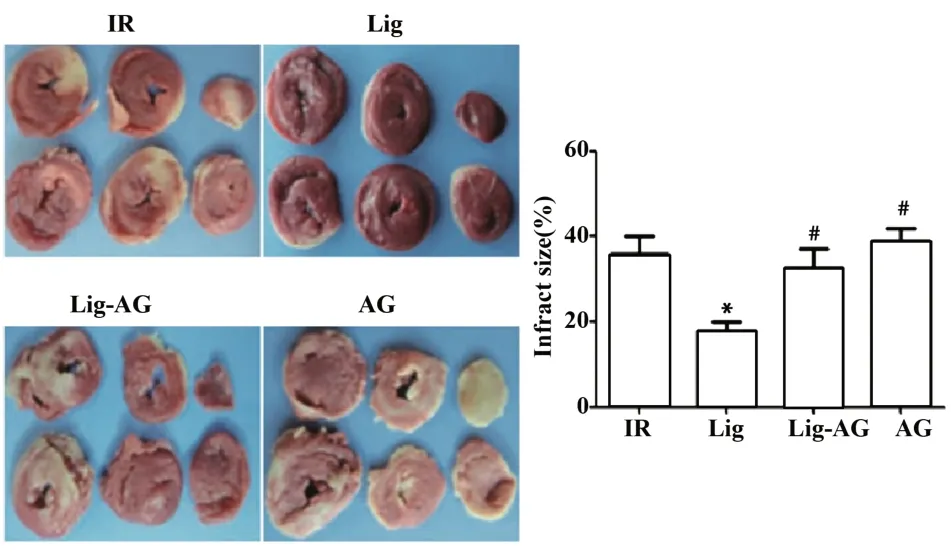
图2 Lig对大鼠心脏梗死体积的影响Fig.2 Effect of Lig on the volume of heart infarction in rats
1.2.7 Western blot 提取心肌组织总蛋白并定量。在蛋白样品中加入上样缓冲液,95℃或更高温度下变性10 min。将样品加入SDSPAGE胶样品孔(80 V,2 h)。膜转移后(90 V,60 min),2%BSA密封过夜。TBST清洗4次后,4℃下一级抗体孵育过夜。TBST清洗4次,37℃下二级抗体孵育1 h。TBST清洗4次,反应30 s后,将显影液加入成像系统进行曝光和图像采集,并以β-actin作为内参蛋白计算蛋白相对表达量。
汽轮机整个启动过程就是一个缓慢均匀的加热过程,各部温差及膨胀不正常的情况下就容易发生碰磨产生振动,升速率及暖机点的选择和控制就至关重要。本次汽封更换间隙调整后,除临界转速区以外,升速率及机组带负荷速度均应比正常启动缓慢,以便汽轮机加热和汽封磨合,通过胀差、汽缸膨胀、各部温度综合判断暖机效果及汽封磨合状况,再决定升速或加负荷,切忌单纯凭时间或某一参数决定。
1.3 统计学方法 数据统计采用SPSS16.0软件,作图工具采用Graphpad5.01软件,组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 LVDP、HR、±dp/dtmax及CF的比较 如图1所示,与IR组相比,Lig组LVDP、HR、+dp/dtmax和CF明显升高,差异具有统计学意义(P<0.05);与Lig组相比,Lig-AG组、AG组LVDP、HR、+dp/dtmax和CF明显降低,差异有统计学意义(P<0.05)。
2.2 大鼠离体心脏梗死面积比较 如图2所示,TCC染色结果显示,与IR组相比,Lig组心肌梗死面积明显减小,差异具有统计学意义(P<0.05);与Lig组相比,Lig-AG组、AG组心肌梗死面积明显增加,差异具有统计学意义(P<0.05)。
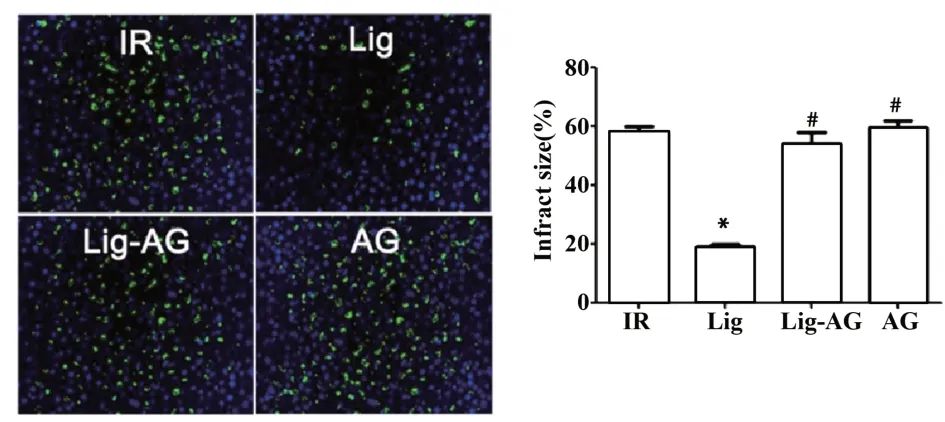
图3 Lig对缺血再灌注后心肌细胞凋亡的影响(×400)Fig.3 Effect on myocardial cell apoptosis after ischemia reperfusion(×400)
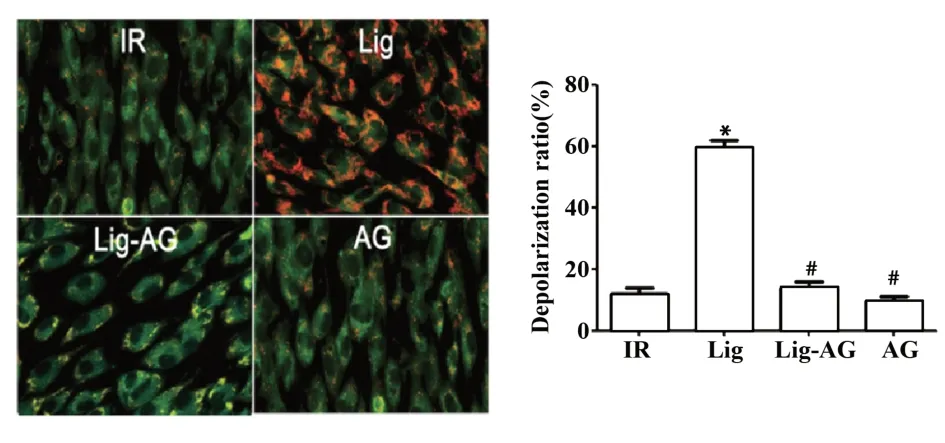
图4 Lig对缺血再灌注后线粒体膜电位的影响Fig.4 Influence of Lig on mitochondrial membrane poten⁃tial after ischemia reperfusion
2.3 心肌细胞凋亡比较 如图3所示,与IR组相比,Lig组细胞凋亡率明显减少,差异具有统计学意义(P<0.05);与Lig组相比,Lig-AG组、AG组细胞凋亡率明显增加,差异具有统计学意义(P<0.05)。
2.4 线粒体膜电位比较 如图4所示,与IR组相比,Lig组线粒体膜电位明显增加,差异具有统计学意义(P<0.05);与Lig组相比,Lig-AG组、AG组线粒体膜电位明显降低,差异具有统计学意义(P<0.05)。
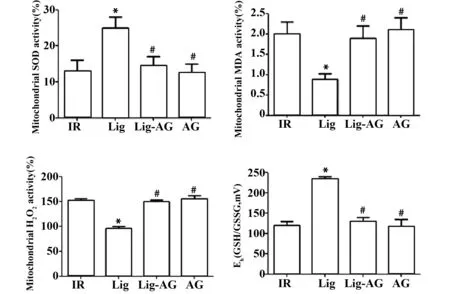
图5 Lig对缺血再灌注后氧化应激反应的影响Fig.5 Effect of Lig on oxidative stress response after isch⁃emia reperfusion
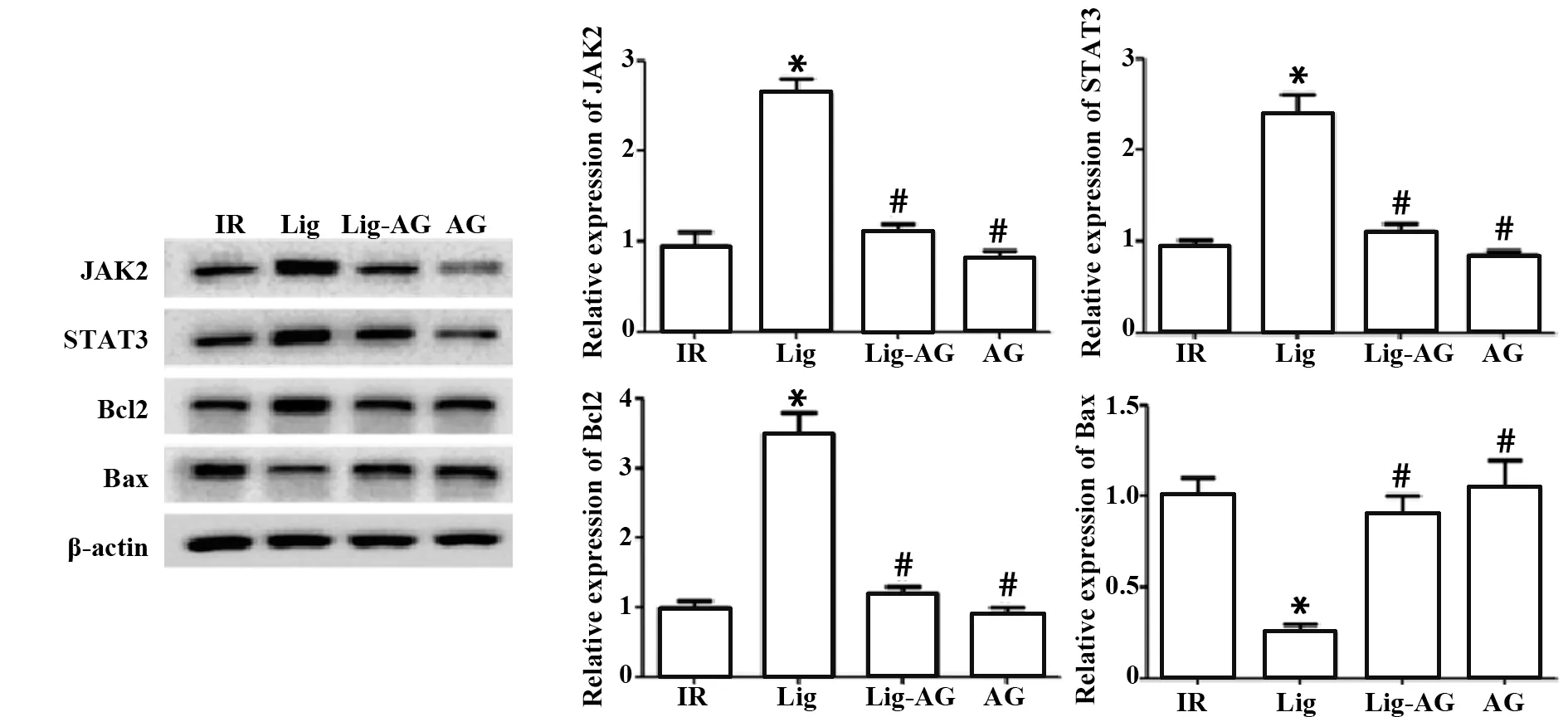
图6 Lig对缺血再灌注后JAK2/STAT3通路及Bcl2、Bax蛋白表达的影响Fig.6 Effects of Lig on JAK 2/STAT3 pathway,Bcl2 and Bax protein expression after ischemia reperfusion
2.6 JAK2、STAT3、Bcl2、Bax的表达 如图6所示,与IR组相比,Lig组JAK2、STAT3、Bcl2蛋白表达明显升高,Bax蛋白表达明显降低,差异均具有统计学意义(P<0.05);与Lig组相比,Lig-AG组、AG组JAK2、STAT3、Bcl2蛋白表达明显降低,Bax表达明显升高,差异均具有统计学意义(P<0.05)。
3 讨论
缺血性心脏病是临床常见心血管系统疾病之一,实行冠状动脉再灌注可有效降低死亡率[6]。然而,在短时间内中断心肌供血,一定时间后恢复供血,原缺血心肌会发生较为严重的损伤,包括心肌功能异常和细胞死亡等,这种情况称为心肌再灌注损伤[7]。通常认为,再灌注时自由基爆发、细胞自噬、细胞凋亡等是缺血再灌注损伤的重要原因[8]。
细胞通过自噬机制来清除受损或不需要的线粒体称为线粒体自噬,发生缺血再灌注损伤时,线粒体可产生大量ROS,且线粒体通透性发生改变,从而诱发线粒体自噬,线粒体通过细胞的自噬机制被清除[9-10]。另外,MDA是自由基引起不饱和脂肪过氧化作用的特征产物,心肌缺血再灌注损伤时,线粒体内MDA含量显著升高[11-12]。同时,GSH是哺乳动物细胞内含量最丰富的多肽,研究表明,GSH预处理可减少线粒体氧化应激,减少缺血再灌注损伤[13-14]。因此,缺血再灌注导致的线粒体能量障碍是细胞坏死和凋亡的关键环节。
川芎嗪对心血管病的治疗具有显著疗效,其作用机制主要有清除自由基、抗脂质过氧化、促进心肌细胞能量代谢、调控凋亡相关基因表达、影响细胞因子等。熊响清等[15]研究表明,川芎嗪可以和参麦注射液协同作用治疗脑缺血再灌注损伤,缓解大鼠大脑缺血再灌注与多器官损伤;彭淼云等[16]研究表明当川芎嗪与地塞米松联合用药时,用于治疗肾缺血再灌注损伤,可能通过诱导Bcl2蛋白的合成,下调c-Fos、ICAM-1蛋白的合成减轻肾损伤;有研究表明,川芎嗪能够平衡eNOS/iNOS两种蛋白表达,维持体内NO正常浓度以防止过量NO造成的心肌组织损伤[17-18]。李鹏飞等[19]研究表明,川芎嗪作用于缺血再灌注的大脑时还可减少线粒体损伤。然而,川芎嗪对于心肌缺血再灌注损伤的保护与机制的研究鲜有报道。实验结果表明,川芎嗪能够显著减小心肌梗死面积、改善心肌功能、减少心肌细胞凋亡,可对缺血再灌注后的心肌细胞产生明显保护作用。且川芎嗪能够抑制线粒体膜电位降低,抑制线粒体内MDA表达、GSH/GSSG升高并促进SOD表达,提高缺血再灌注后心肌细胞内线粒体的氧化应激,进而抑制线粒体自噬,最终缓解缺血再灌注对于心肌细胞的损伤。
JAK2/STAT3信号通路是参与机体分化、代谢、血管再生与侵袭的重要信号通路,多种因子及药物可通过激活此通路促进细胞新生,改善缺血,参与心肌保护[20]。Bcl2蛋白质家族可在线粒体水平上决定细胞的存活或死亡,定位于细胞内膜系特别是线粒体外膜上的Bcl2可起抗凋亡作用[21-22]。Bax作为促凋亡因子可活化转移至线粒体外膜形成蛋白性孔道,改变线粒体膜通透性,激活下游caspase-9而诱导凋亡起始[23]。实验结果表明,川芎嗪能够促进JAK2/STAT3信号通路的激活与Bcl2的表达,同时抑制Bax表达。因此,川芎嗪可通过对JAK2/STAT3信号通路的激活促进心肌细胞的保护作用,并可通过调节Bcl2与Bax表达抑制心肌细胞凋亡。
综上所述,JAK2/STAT3信号通路可能与缺血再灌注后的细胞凋亡相关,通过川芎嗪治疗可缓解缺血再灌注后心肌细胞的损伤。川芎嗪对于心肌缺血再灌注损伤的保护作用可能是通过对JAK2/STAT3信号通路及线粒体自噬的调控实现的。

