超声造影定性诊断直肠肿物
李悦扬,姜脉涛,杨秀华,王秀云,安婷婷,王守志,蒋佩岑,叶乃源
(哈尔滨医科大学附属第一医院腹部超声科,黑龙江 哈尔滨 150001)
直肠癌发病率居全球恶性肿瘤第3位,死亡率居第2位[1]。早诊断、早治疗对于治疗决策、提高生存、改善生活质量至关重要[2]。WHO分类中,常见直肠良性病变包括直肠腺瘤和直肠炎性包块;直肠不典型增生为癌前病变;常见恶性病变包括直肠腺癌及直肠癌伴黏液样变,往往不易鉴别[3]。美国国立综合癌症网络(national comprehensive cancer network, NCCN)临床实践指南[4]指出,活检是术前诊断直肠肿物的金标准,但有创。经直肠超声(endorectal ultrasonography, ERUS)是常用影像学技术[5],被广泛用于术前诊断直肠肿物,但大部分直肠肿物ERUS均呈低回声,导致鉴别困难。近年来,超声造影(contrast-enhanced ultrasonography, CEUS)在直肠病变中的应用价值逐渐凸显。CEUS能基于微循环强化更好地表征病变,且利用造影剂时间-强度曲线(time-intensity curve, TIC)可获得多个定量灌注参数[6],有助于鉴别良性与恶性病变[7]。本研究观察CEUS定性诊断直肠肿物的价值。
1 资料与方法
1.1 一般资料 回顾性分析2019年1月—2020年12月129例于哈尔滨医科大学附属第一医院就诊的直肠肿物患者,男90例,女39例,年龄17~87岁,平均(53.8±15.7)岁。纳入标准:①直肠指诊触及中低位直肠肿物(距肛缘≤10 cm),术前接受常规ERUS及直肠腔内CEUS检查;②经手术切除病变,术后病理检查明确诊断。排除标准:①严重混合痔、肠腔狭窄及梗阻;②曾接受靶向治疗、放射或化学治疗;③合并肝肾功能严重不全;④合并严重心功能不全;⑤造影剂过敏。
1.2 仪器与方法 采用Hitachi Hi Vison Ascendus型彩色多普勒超声诊断仪,经直肠双平面腔内探头U533,凸阵频率3.5~5.5 MHz,线阵频率10~12 MHz。造影剂为SonoVue(Bracco)。
1.2.1 常规ERUS检查 清洁灌肠后,嘱患者左侧卧,屈髋屈膝。以直肠指诊初步确定肿物位置后,将探头缓慢送至肿物中心处进行多切面扫查,记录肿物最大切面中的位置及与肛缘距离、形态、大小、内部回声、有无侵袭边界及血流灌注等情况。
1.2.2 直肠腔内CEUS检查 完成常规检查后切换至动态CEUS模式,将机械指数(mechanical index, MI)调至0.03,显示双幅图像(左侧CEUS图像,右侧常规灰阶图像),选择肿物最大、血流最丰富的切面(含部分正常肠壁)进行造影,经肘正中静脉团注4.8 ml SonoVue并跟注5 ml生理盐水,之后连续动态观察180 s,存储图像。
1.2.3 分析CEUS图像 由2名超声科主治医师采用双盲法。回放CEUS图像,选取肿物最粗大血管灌注区作为ROI1,以周围正常肠壁为ROI2,确定病变增强速度和增强模式。增强模式分为高增强、等增强、低增强和无增强4种类型。以设备自带时间-强度分析软件描绘TIC,测量灌注参数,包括到达时间(arriving time, AT)、达峰时间(time to peak, TTP)及峰值强度(peak intensity, PI)。各参数均连续测量3次,取平均值作为结果。
1.3 统计学分析 采用SPSS 22.0统计分析软件。计量资料均符合正态分布,以±s表示,多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
129例病灶均单发,其中65例恶性病变(45例腺癌、20例腺癌伴黏液样变),31例癌前病变,33例良性病变(15例腺瘤、18例炎性包块)。65例直肠恶性病变的组织病理学分期为T1期7例、T2期14例、T3期31例及T4期13例。
2.1 ERUS与CEUS定性诊断病变准确率比较 CEUS对直肠恶性病变、癌前病变及良性病变的正确诊断率均高于ERUS(P均<0.05),见表1。

表1 ERUS、CEUS对129例直肠病变的正确诊断率比较[%(例)]
2.2 不同病变AT、TTP及PI比较 直肠恶性病变、癌前病变、良性病变及周围正常肠壁间AT、TTP及PI差异均有统计学意义(P均<0.001)。恶性病变AT、TTP均低于癌前病变、良性病变及周围正常肠壁(P均<0.001),PI高于癌前病变及周围正常肠壁但低于良性病变(P均<0.001);癌前病变AT、TTP高于良性病变及周围正常肠壁(P均<0.001),而PI低于良性病变(P<0.001);良性病变PI高于周围正常肠壁(P<0.001);见表2。
表2 直肠病变及周围正常肠壁间AT、TTP及PI比较(±s)

表2 直肠病变及周围正常肠壁间AT、TTP及PI比较(±s)
组别AT(s)TTP(s)PI(dB)恶性病变(n=65)15.28±1.97*#&22.21±3.09*#&58.72±12.40*#&癌前病变(n=31)23.09±1.34#&35.47±1.34#&29.92±4.59#良性病变(n=33)19.78±1.0029.91±1.84107.46±26.65&周围正常肠壁(n=129)20.25±0.9431.24±1.6227.11±10.95F值306.01376.16330.00P值<0.001<0.001<0.001 注:*:与癌前病变比较,P<0.001;#:与良性病变比较,P<0.001;&:与周围正常肠壁比较,P<0.001
2.3 病变ERUS及CEUS表现 ERUS表现:①腺癌,多呈低回声,形态欠规则,边界不清晰或欠清晰,向肠壁侵袭性生长,血流信号丰富或略丰富;②直肠癌伴黏液样变,多呈不均匀低回声,形态欠规则,边界不清晰或欠清晰,多有血流信号丰富(图1A);③癌前病变,低回声,形态尚规则,边界欠清晰,基底稍宽,似见点状血流信号(图2A);④直肠腺瘤,低回声,形态规整,边界清晰,似见窄蒂与肠壁相连,游离于肠腔,活动度大(图3A);⑤直肠炎性包块:多为不均匀低回声,边界欠清晰,周边见少量血流信号。
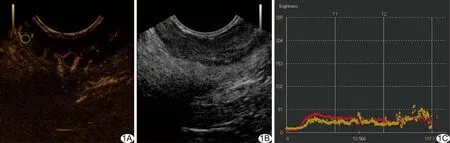
图1 患者女,56岁,直肠腺癌伴黏液样变 A、B.CEUS(A)、ERUS(B)示截石位10点方向距肛缘3 cm处37 mm×14 mm低回声病变,形态欠规则,边界不清晰,侵及肌层,病变处造影剂于14 s进入; C.TIC显示“快进快出”轻度高增强 (红色代表病变ROI1,黄色代表周围正常肠壁ROI2)
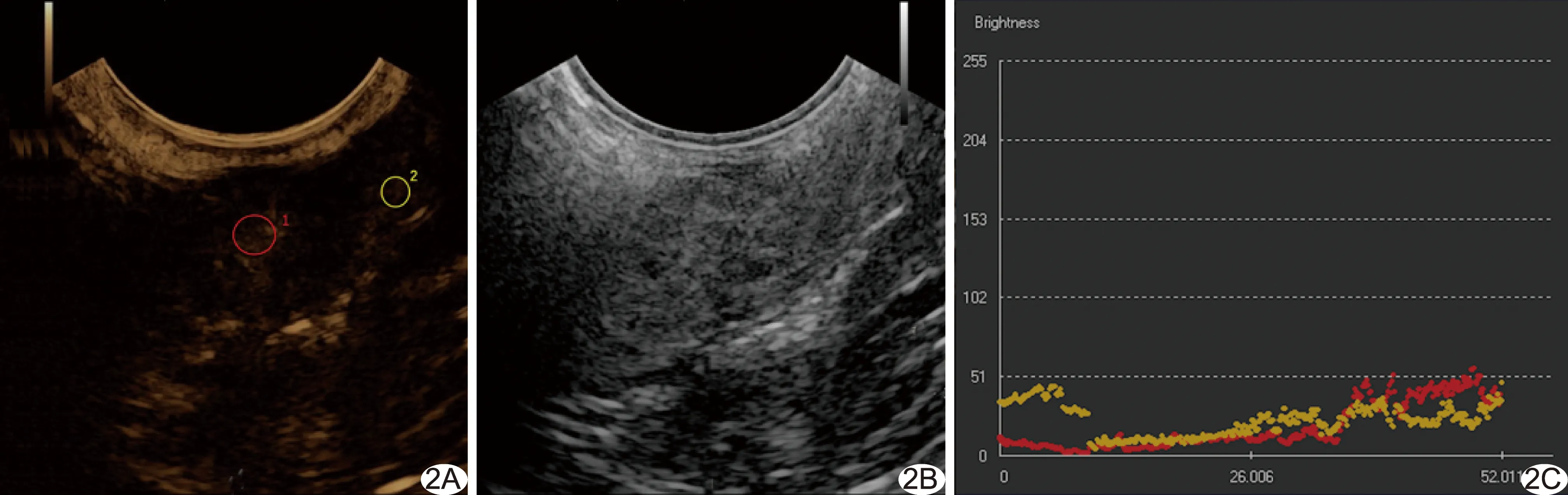
图2 患者男,67岁,直肠管状腺瘤伴局部中度不典型增生 A、B.CEUS(A)、ERUS(B)示截石位6点方向距肛缘5 cm处40 mm×12 mm低回声病变,形态尚规则,边界欠清晰,基底稍宽,似见点状血流信号,病变处造影剂于25 s进入; C.TIC示“慢进慢出”的低增强表现 (红色代表病变ROI1,黄色代表周围正常肠壁ROI2)

图3 患者女,38岁,直肠绒毛管状腺瘤伴局灶高级别上皮内瘤变 A、B.CEUS(A)、ERUS(B)示截石位7点方向距肛缘10 cm处21 mm×20 mm低回声病变,形态规整,边界清晰,似见窄蒂与肠壁相连,游离于肠腔,活动度大,病变处造影剂于19 s进入; C.TIC显示同步高增强 (红色代表病变ROI1,黄色代表周围正常肠壁ROI2)
CEUS表现:①腺癌,动脉期多表现为快速强化,延迟期造影剂消退早于正常直肠壁,呈现“快进快出”表现;②直肠癌伴黏液样变,动脉早期即表现为快速增强,强化程度不均匀,延迟期快速消退(图1B、1C);③癌前病变,灌注表现不一,大部分“慢进慢出”,22例表现为不均匀高增强,4例同步均匀等增强,5例低增强(图2B、2C);④直肠腺瘤,多由一条粗大滋养血管供血,动脉期离心性均匀高增强,延迟期较周围正常肠壁仍表现为高增强(图3B、3C);⑤直肠炎性包块,动脉期及延迟期病灶边缘呈环状高增强,中央无增强,显示病变边界较二维超声清晰。
3 讨论
全球范围内直肠癌发病率约占结直肠癌的40%、消化系统恶性肿瘤的20%[8]。在我国,直肠癌在结直肠癌中占比达49.66%。为实现合理治疗,术前准确进行定性诊断至关重要[9]。对局部进展期直肠癌多行全直肠系膜切除术,对良性腺瘤仅需通过内镜或手术进行局部切除。
ERUS是术前诊断直肠肿瘤的常用影像学方法,但多数肿瘤ERUS表现为低回声,致使鉴别诊断困难。CEUS是纯血池灌注显像,造影剂不会渗透到组织间隙,且能实时动态对比观察直肠病变与周围正常肠壁的灌注差异。本研究结果显示,CEUS定性诊断直肠肿物的准确性高于常规超声检查。同时,灌注定量参数能客观反映不同性质肿物的差异[10]。本研究TIC定量分析结果表明,直肠良性、交界性、恶性病变及周围正常肠壁之间,AT、TTP及PI差异均有统计学意义;与正常直肠壁相比,恶性病变的AT和TTP更短、PI更高;交界性癌前病变的AT及TTP稍晚于正常肠壁、PI低于恶性病变;提示CEUS灌注参数可用于鉴别诊断不同性质直肠肿物,与LU等[11]的结果相符。这是由于恶性肿瘤侵袭性高,新生血管呈指数增长,癌前病变的微血管密度高于正常组织而低于侵袭性直肠癌,恶性病变PI值高于癌前病变及良性肿瘤,且直肠恶性病灶常存在动静脉瘘,AT和TTP更短[12]。但本组癌前病变与正常肠壁间PI、良性病变与正常肠壁间AT及TTP差异均无统计学意义,可能与纳入病例数少有关,尚待加大样本量继续观察。
不同性质直肠肿物CEUS表现存在差异。直肠癌多呈均匀或不均匀“快进快出”表现,但随着肿瘤体积增大或直肠癌为低分化,肿瘤内部可能出现坏死或黏液样变,使部分区域可呈低增强或无增强[13];坏死相对较少的中分化直肠癌血管生成相对均匀,故呈均匀增强[12]。直肠癌前病变灌注表现不一,大部分表现为“慢进慢出”特点,高增强多见。既往研究[14]表明,直肠不典型增生组织中血管内皮生长因子过表达,且肿瘤的形成晚于血管生成,使处于血管前期的肿瘤表现为“慢进慢出”特点。良性病变中,直肠腺瘤呈离心性均匀高增强,CEUS可清晰显示其由一条粗大滋养血管供血,与恶性病变杂乱分支血供不同,此点有助于与恶性病变相鉴别;直肠炎性包块呈环状高增强,PI常高于恶性病变,且CEUS所示病灶边界更清晰。
本研究的局限性:单中心研究,纳入病种较少;部分病灶体积过大,考虑到患者耐受能力,未行腔内及静脉双重造影检查或其他影像学检查[15];仅纳入中低位直肠病变,今后将进一步增加高位直肠病变,以缩小诊断局限性[16]。综上所述,CEUS可用于定性诊断直肠肿物,且较二维超声优势明显,可作为常规ERUS检查之后的进一步定性诊断方法。

