间充质干细胞来源的外泌体对脂多糖诱导的血管内皮损伤的影响及其机制
袁天杰 赵子君 陈 依 鄢和新 俞卫锋
脓毒症与感染、免疫系统平衡被破坏等损伤相关,是导致重要器官功能障碍的严重全身性疾病。感染诱发的脓毒症(如菌血症)可刺激宿主的免疫系统释放过量的促炎症细胞因子(简称促炎因子)进入血液循环[1-2]。脓毒症引起的内皮细胞损伤和功能障碍被认为是急性肺损伤(acute lung injury,ALI)的主要发生机制,该机制与死亡率显著相关[3-4]。
内皮细胞在白细胞的黏附和迁移中起着重要作用。当内皮细胞受到诸如细菌的感染,可引起机体血管屏障受损,导致血管通透性增加,致使液体渗漏和炎症细胞迁移。随着病程的进展,机体内环境稳态被破坏,黏附分子的表达水平上调,促进免疫细胞的黏附与迁移。因此,恢复内皮的完整性、增强内皮细胞稳定性,对治疗脓毒症引起的ALI和改善患者的预后至关重要。
间充质干细胞(mesenchymal stem cell,MSC)广泛存在于各类间充质组织中。该类细胞具有自我更新并分化成各种细胞谱系的能力。越来越多的研究[5-7]结果表明,MSC对诸多血管性疾病均有益处,如缺血性心肌病、败血症和ALI等;但相关分子作用机制尚未完全明确。目前的研究结论为,MSC的治疗作用可能与其分泌的外泌体有关。MSC释放体液因子来调节局部或全身免疫反应,其中包括外泌体的调节作用[8-9]。外泌体是近期研究的焦点。外泌体可将功能性信使核糖核酸(mRNA)、微核糖核酸(miRNA)和其他生物化学物质转运至靶细胞,实现细胞间的通信。研究[10-12]发现,外泌体通过调节人体内环境稳态对疾病的发生、发展起到调控作用,如骨性关节炎、心血管疾病、皮肤创面的修复等。脂质体膜可以保护外泌体免于降解,故存储简便。因此,外泌体是具有临床应用前景的治疗工具。本研究旨在探索MSC来源的外泌体对受损的内皮细胞的生物学影响及其相关机制。
1 材料与方法
1.1 实验材料和试剂 脐带组织由上海交通大学医学院附属瑞金医院提供。高糖DMEM培养基、青霉素链霉素混合液、丙氨酰谷氨酰胺均购自上海源培生物科技公司。总RNA抽提试剂(TRIzol)、RIPA裂解液、SYBR Green核酸染料、硝酸纤维素膜、BCA蛋白测定、TUNEL凋亡测定和十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)试剂盒均购自上海碧云天生物技术有限公司。超氧化物歧化酶(SOD)、髓过氧化物酶(MPO)测定试剂盒购自南京建城生物工程研究所。胎牛血清(FBS)购自美国Gibco公司。牛血清白蛋白(BSA)、脂多糖(LPS)购自美国Sigma公司。人脐静脉内皮细胞(HUVEC)购自中国科学院上海生物化学与细胞生物学研究所细胞库。一抗TSG101(兔)购自美国Protein Tech公司。CD63、血管内皮钙黏蛋白(VE-cadherin)抗体购自美国Abcam公司。CD81抗体购自美国BD公司。辣根过氧化物(HRP)偶联的羊抗鼠二抗IgG购自上海碧云天生物技术有限公司。相关引物均由上海华津生物科技公司合成与提供。
1.2 实验方法
1.2.1 MSC来源外泌体(MSC-Exos)的分离与鉴定 采用组织贴壁法从人脐带组织中分离出MSC,培养于含有5%FBS和1%青霉素链霉素混合液的高糖DMEM培养基中。将MSC接种在含完全培养基的15 cm培养皿中直至细胞完全融合,后换液为15 mL无血清培养基继续培养。收集上述条件培养基,2 000×g,4 ℃,离心30 min以除去细胞碎片。应用超速离心机100 000×g,室温离心2 h,弃去上清液,分离出外泌体,重悬于1×PBS中。应用透射电子显微镜(简称电镜)观察外泌体形态。将外泌体在室温下固定于含1.25%多聚甲醛和2.5%戊二醛的混合溶液中2 h,后以1×PBS洗涤样品2次,再以1.5%乙酸铀酰负染2 min,并拍照、记录外泌体形态。使用纳米颗粒跟踪(NTA)技术分析外泌体的直径和总数,免疫印迹法测定外泌体的标记蛋白CD63和TSG101,流式细胞术检测细胞表面抗原CD63和CD81。
1.2.2 分组、模型和干预 将HUVEC培养于含10%FBS和1%青霉素链霉素混合液的高糖DMEM培养基中至完全融合。随机分为对照组、LPS组、MSC-Exos组,每组均有3个重复样本。对照组在不含血清的高糖DMEM培养基中培养12 h,LPS组添加100 μL质量浓度为1 mg/L LPS孵育24 h,MSC-Exos组添加100 μL质量浓度为1 mg/L LPS和100 mg/L的外泌体孵育24 h。
1.2.3 细胞迁移实验 将1×105HUVEC接种于六孔板培养皿中,并在含10% FBS和1%青霉素链霉素混合液的DMEM高糖培养基中培养至细胞完全融合。以200 μL移液器尖端手动刮擦细胞表面,在每个孔中产生垂直伤口。分别于处理即刻、处理后12和24 h,应用Image J软件分析细胞迁移区域。实验重复至少2次。
1.2.4 实时荧光定量PCR法检测目的基因表达 ①总RNA提取,采用TRIzol裂解液裂解各组细胞,并提取细胞总mRNA。②反转录,按照SYBR Green qPCR Mix反转录试剂盒操作步骤,将提取的mRNA反转录为cDNA。③实时定量PCR法,以18S核糖体RNA(18SrRNA)作为管家基因,以cDNA为模板行目的基因扩增。采用ΔΔCt法检测各组样本中基因的表达水平,扩增后目的基因相对表达量=2-(目的基因Ct-内参基因Ct)。引物序列见表1。
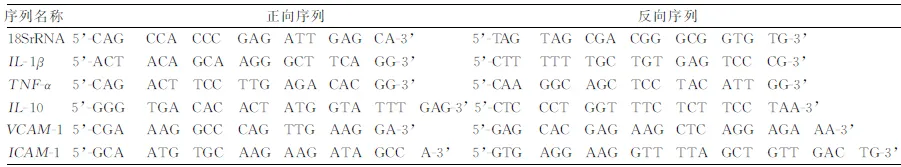
表1 引物序列
1.2.5 细胞内SOD活性和MPO含量检测 根据制造商的说明书步骤测量各组细胞内SOD活性和MPO含量,利用分光光度计进行结果定量,了解细胞氧化应激程度。
1.2.6 蛋白质印迹分析 将外泌体或HUVEC溶解在带有蛋白酶抑制剂的RIPA裂解液中,使用BCA蛋白测定试剂盒定量各组细胞蛋白质浓度。样品经过8%~10% SDS-PAGE处理,电泳后将蛋白质转移到硝酸纤维素膜。将膜用5%BSA封闭1 h后,浸泡于一抗中,4 ℃孵育过夜,后与适当的HRP偶联的二抗共同孵育。最后,通过信号增强化学发光检测系统检测各组细胞目的蛋白质的荧光强度,并以GAPDH(购自美国Cell Signaling Technology公司)作为标准化内参。应用Image J软件对各条带荧光强度进行定量。
1.2.7 细胞凋亡评估 采用TUNEL凋亡试剂盒测定各组细胞凋亡程度。4,6-二脒基-2-苯基吲哚(DAPI)染色归一化凋亡细胞核。使用显微镜观察细胞凋亡情况,应用Image J软件对其进行定量分析。

2 结 果
2.1 MSC-Exos形态与性质的鉴定 透射电镜图像显示,本实验提取的外泌体呈球状,其直径范围为30~100 nm。见图1A。免疫印迹法和流式细胞术检测结果显示,提取的外泌体表达CD63、CD81和TSG101。见图1B和1C。NTA结果表明,分离的微囊泡(含外泌体)平均浓度为4.05×1010/mL,直径范围为30~150 nm。见图1D。
2.2 MSC-Exos干预LPS对HUVEC功能损伤的影响 MSC-Exos组的HUVEC迁移面积显著大于LPS组(P<0.01)。见图2、表2。TUNEL染色细胞凋亡实验结果显示,LPS组HUVEC细胞凋亡数量显著多于对照组(P<0.05),而MSC-Exos组的HUVEC细胞凋亡数量显著少于LPS组(P<0.01)。见表2、图3。
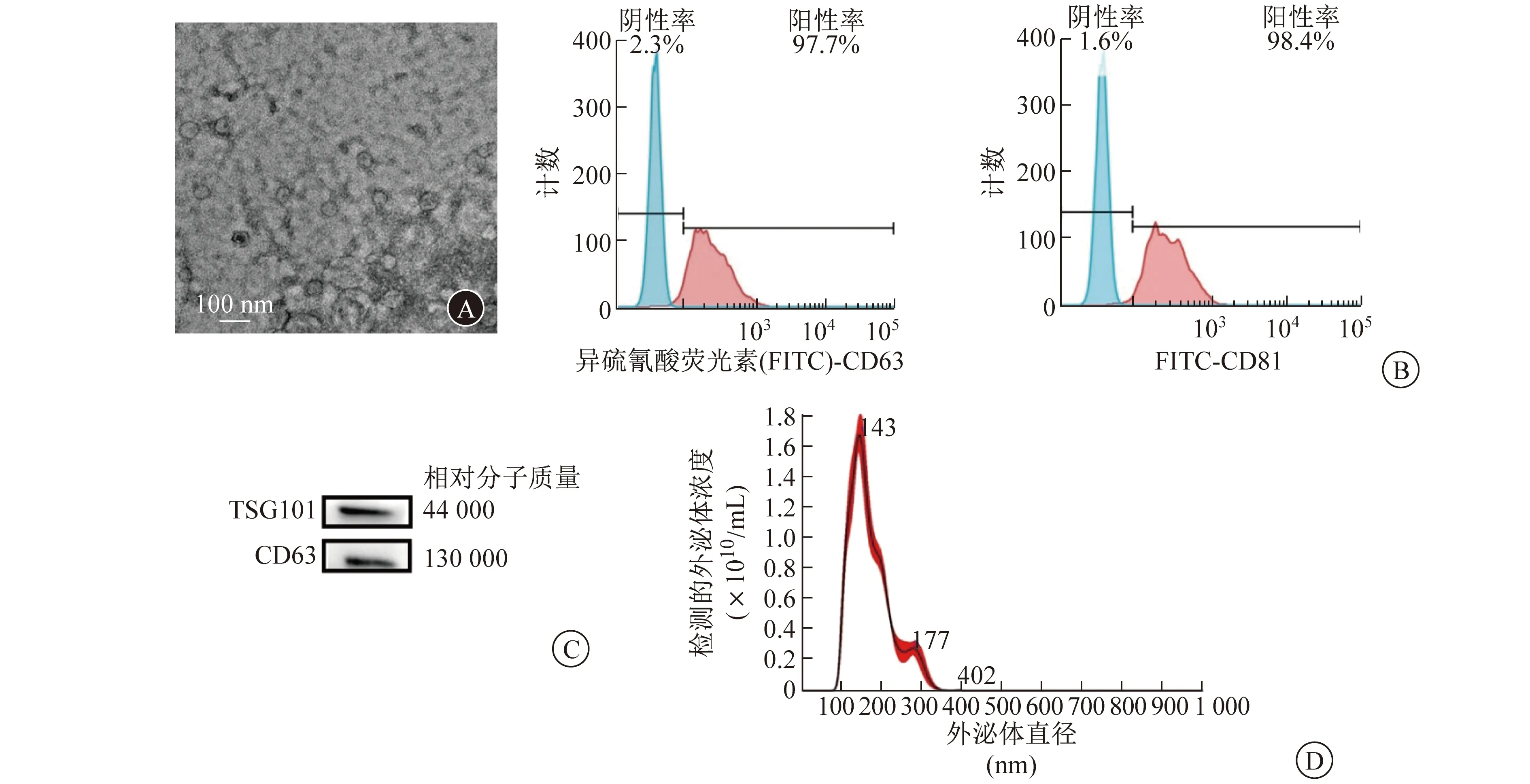
A 外泌体透射电镜图像 B 流式细胞术检测外泌体CD63和CD81的表达 C 免疫印迹法检测外泌体CD63和TSG101的蛋白质相对表达量 D NTA检测的外泌体浓度和直径范围图1 MSC-Exos形态与性质鉴定

A 对照组0 h B 对照组12 h C 对照组24 h D LPS组0 h E LPS组12 h F LPS组24 h G MSC-Exos组0 hH MSC-Exos组12 h I MSC-Exos组24 h图2 3组细胞各时间点细胞迁移面积
表2 3组细胞12 h、24 h细胞迁移面积和凋亡数量比较
2.3 MSC-Exos缓解LPS诱导的HUVEC氧化应激损伤 与对照组相比,LPS组HUVEC细胞SOD活性显著减弱(P<0.05)、 MPO表达量显著增多(P<0.01)。与LPS组相比,MSC-Exos组HUVEC细胞SOD活性显著增强(P<0.01)、MPO表达量显著减少(P<0.05)。基因水平的检测结果显示,LPS组促炎因子(TNF-α和IL-1β)的mRNA表达量较对照组显著增多(P<0.05)。与LPS组相比,MSC-Exos组HUVEC细胞TNF-α和IL-1β的mRNA表达量显著减少(P<0.05),抗炎细胞因子(IL-10 mRNA)表达量显著增多(P<0.01)。见表3。
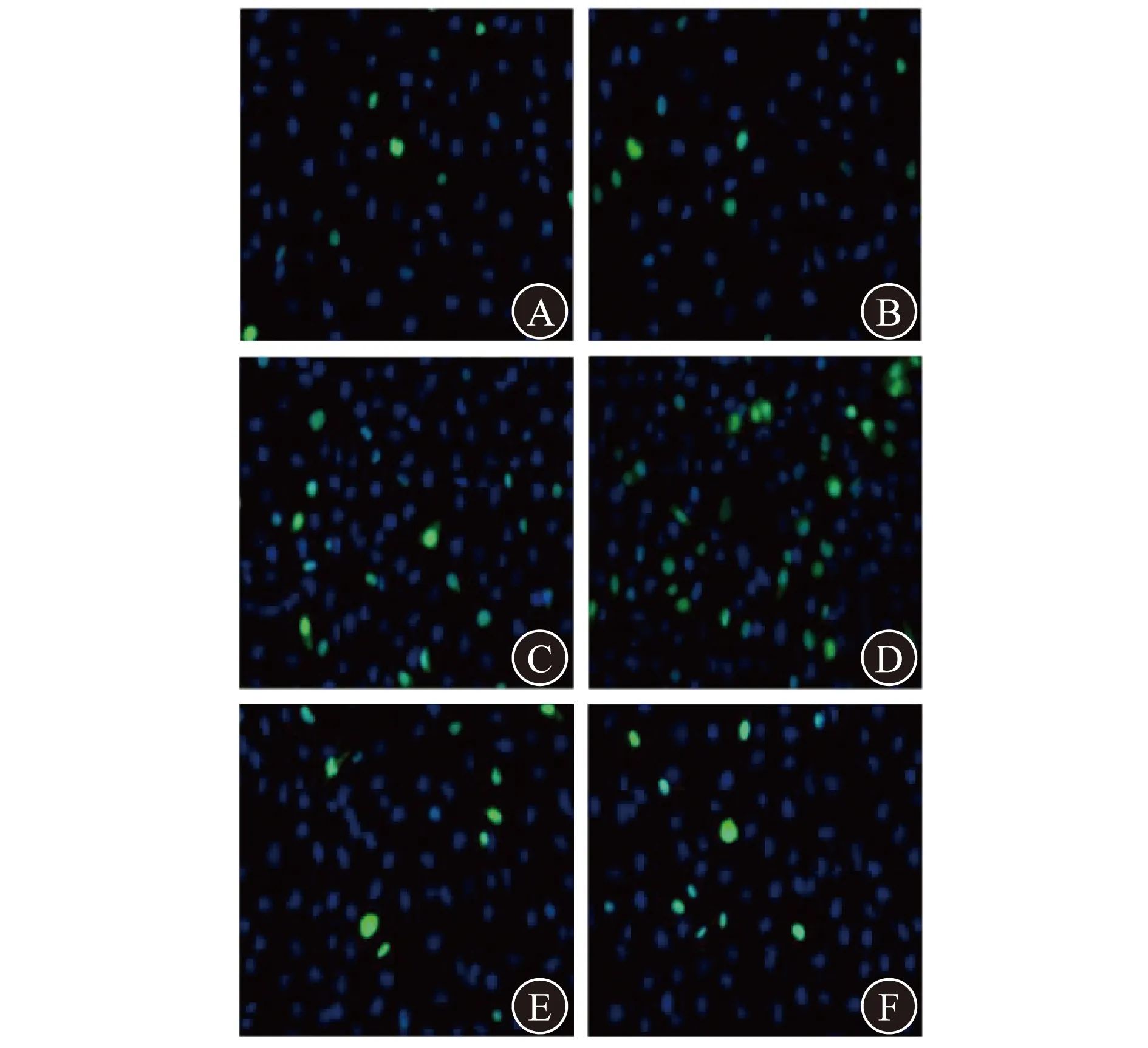
A 对照组样本1 B 对照组样本2 C LPS组样本1D LPS组样本2 E MSC-Exos组样本1 F MSC-Exos组样本2图3 3组细胞TUNEL法检测结果
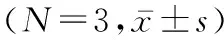
表3 MSC-Exos干预减轻LPS诱导的HUVEC氧化应激损伤
2.4 MSC-Exos调控LPS诱导的HUVEC细胞间内皮黏附分子表达水平 ICAM-1和VCAM-1是炎症反应的标志。VE-cadherin可减轻炎症反应介导的动脉粥样硬化的发生和发展。与LPS组相比,MSC-Exos组HUVEC细胞的ICAM-1和VCAM-1表达水平显著降低,VE-cadherin水平显著升高(P<0.05)。见图4、表4。
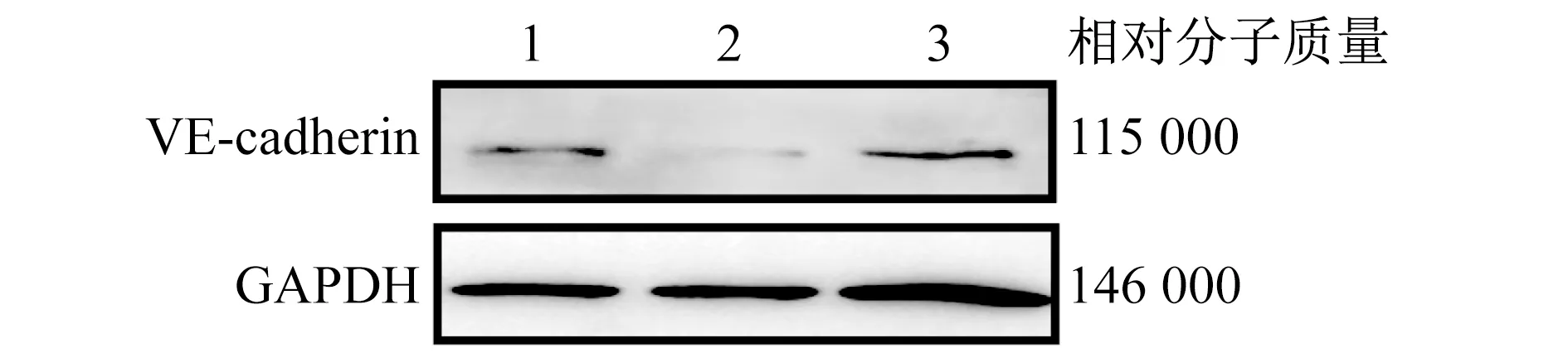
1 对照组 2 LPS组 3 MSC-Exos组图4 MSC-Exos调控LPS诱导的HUVEC细胞间内皮黏附分子表达
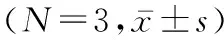
表4 MSC-Exos调控LPS诱导的HUVEC细胞间内皮黏附分子相对表达量
3 讨 论
广泛的微血管损伤和内皮功能障碍是脓毒症的病理生理学标志,与严重的全身性炎症反应密切相关。血管内皮细胞连接整个循环系统,维持内皮屏障完整性在体内平衡中起着至关重要的作用[13-14]。内皮的损伤和功能障碍使得微血管屏障被破坏,导致组织水肿和器官功能障碍的增加[15]。在内皮损伤状态下,内皮细胞的激活会增加促炎因子的释放、细胞黏附分子的表达,循环白细胞对内皮细胞黏附募集并增加内皮细胞的通透性[16]。免疫过度激活会使宿主免疫系统瘫痪。
近年来,越来越多证据显示了MSC的抗炎特性[17-19]。然而,将MSC直接用于治疗仍存在一些风险,如免疫排斥、低存活率、微脉管系统阻塞,以及不适当的细胞分化和肿瘤生成等。
而外泌体作为一种新型的载体可以转运各种大分子并介导细胞间通信。细胞选择性地将特定的非编码RNA包装进外泌体,主动转运至邻近细胞[20-21]。外泌体为运输功能性生物化学物质,可调控细胞并影响微环境。但是,对于外泌体的潜在功能仍有待进一步研究。
本研究以评估MSC来源的外泌体对内皮损伤的保护作用为目的,以1 mg/L的LPS处理HUVEC诱导损伤。然后,使用外泌体与HUVEC共孵育12 h以探索MSC-Exos的保护作用。本研究结果显示,提取的外泌体呈球状,具有典型的外泌体表面标记。同时,MSC-Exos显著增强了HUVEC的迁移能力,并减少了LPS诱导的细胞凋亡。
MPO和SOD活性的相关结果表明,LPS升高了HUVEC的氧化应激水平,而MSC-Exos明显减弱了此作用。故上述结果显示,MSC-Exos可介导促炎症和抗炎症状态之间的平衡。
细胞间内皮黏附分子包括ICAM-1和VCAM-1,是中性粒细胞黏附的关键细胞表面糖蛋白。内毒素通过NF-κB活化来诱导内皮活化而增加黏附力[22]。VE-cadherin为血管舒张剂,是心血管系统的保护因子,在控制炎症介导的动脉粥样硬化发病和发展中起关键作用。本研究显示,MSC-Exos抑制了HUVEC中LPS诱导的黏附分子表达;同时,VE-cadherin表达水平显著升高。
综上所述,MSC-Exos通过增强内皮细胞的增殖、迁移能力,以及抗炎症和抗凋亡能力,从而减轻LPS诱导的细胞损伤。未来仍有一些工作可继续探究:首先,优化提取方法以获得高纯度的外泌体;其次,可进一步研究明确MSC-Exos对于炎症影响的具体信号传导途径。这些工作将为MSC-Exos临床转化应用提供理论基础。

