简单节杆菌treS表达对大肠杆菌抗逆性能的影响
孙亚华,程洪金,鲁志毅,骆健美
简单节杆菌表达对大肠杆菌抗逆性能的影响
孙亚华,程洪金,鲁志毅,骆健美*
工业发酵微生物教育部重点实验室/天津科技大学;天津市工业微生物重点实验室;天津市微生物代谢与发酵过程控制技术工程中心;生物工程学院/天津科技大学, 天津 300457
简单节杆菌()是工业上普遍使用的甾体C1,2脱氢菌株,转化过程中常常需要添加乙醇等有机溶剂增加疏水性底物的溶解性,但高浓度的有机溶剂会对菌体产生毒害作用。课题组前期通过组学技术发现,海藻糖合成过程中的海藻糖合酶(TreS)与该菌株乙醇胁迫条件下的适应行为密切相关。在此基础上,本文以工业菌株TCCC 11037基因组为模板进行的克隆及其生物信息学分析。结果表明,该菌株的氨基酸序列与来源于sp. J54的海藻糖合成酶基因的同源性最高,为94%。蛋白的相对分子质量65202.39 Da,等电点为4.66,具有不稳定性和亲水性,无跨膜螺旋结构,主要存在于细胞质中。的表达对大肠杆菌的生长性能无明显影响,但能显著提高其对甲醇、高渗和高盐这三种压力的耐受性。该工作对简单节杆菌中基因克隆和表达的首次报道,为深入研究该基因的生物学功能提供基础数据。
简单节杆菌; 大肠杆菌; 抗逆性能
简单节杆菌()具有催化甾体C1,2脱氢的功能,因此在工业上普遍利用其作为反应菌株催化甾体转化,为促进底物的溶解性,常常添加乙醇等有机溶剂[1]。在之前的研究中,我们研究了乙醇对实验室保存的TCCC 11037菌体的一系列生理性能的影响,包括细胞生长、形态、细胞结构和组成、细胞生理性质等,获得了简单节杆菌乙醇压力下适应行为的大量基础数据[2-4]。通过比较菌株在有无乙醇压力下的蛋白质组学数据,进一步获得了一些与乙醇胁迫相关的重要蛋白,如海藻糖合成过程中的关键酶-海藻糖合酶[5-7]。
海藻糖合酶(Trehalose Synthase,TreS,EC 5.4.99.16)是近年来新被发现的一种酶,该酶属于分子内葡糖苷转移酶,能将麦芽糖的α-1,4糖苷键转化为α-1,1糖苷键,从而形成海藻糖。海藻糖合酶具有底物专一性,只能以麦芽糖与海藻糖作为底物,且生成麦芽糖(逆反应)的速率会随温度升高明显增大[8]。目前,已在水生栖热菌()、假单胞菌()、结核分支杆菌()和谷氨酸棒状杆菌()等细菌内发现了海藻糖合酶。进一步分析发现,这些不同微生物来源的海藻糖合酶在一级结构上存在很大的相似性,大多具有Trp-Phe/Pro-Arg-Thr/ Pro-Ala-Val/ Ala-Phe或是Ala-Val-Phe/Ile-Tyr的保守区域[8]。目前,关于该酶在提高微生物抗逆性能方面的报道较少。
本论文以TCCC 11037基因组为模板,通过PCR进行基因的克隆及其生物信息学分析,之后利用大肠杆菌异源表达菌株的构建及其性能分析进一步确定其在微生物抗逆作用方面的效果。对简单节杆菌中基因研究,本研究尚属首次报道,研究结果也为基因的生物学功能的进一步研究提供了基础数据。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒实验所用的简单节杆菌TCCC 11037(TCCC 11037)是实验室保存菌株;克隆菌株DH5α和表达菌株BL21(DE3)来自于实验室保藏菌株。pART2质粒来自Cristinel Sandu教授[10]的馈赠。
1.1.2 酶和试剂盒实验中试剂购买厂家:革兰氏阳性菌基因组提取试剂盒质粒购于Tiangen公司,DNA聚合酶HiFi DNA Polymerase购于Transgen公司,T4 DNA 连接酶和文中所用的H I与I限制性内切酶购于TaKaRa公司,质粒提取试剂盒及DNA凝胶回收试剂盒购于OMEGA公司。
1.2 方法
1.2.1 目标基因的克隆16S RNA基因比对结果表明,实验室保存菌株TCCC 11037与的VKM Ac-2033D的亲缘关系最近,利用其在GenBank公布的基因设计引物,引物序列如表1所示(酶切位点用方框标出)。基因组提取,按照细菌基因组提取试剂盒的说明书进行操作;扩增:基因组作为PCR模板,所用酶为HiFi DNA Polymerase酶;反应条件:94 ℃预变性5 min,94 ℃变性30 s,各自Tm温度退火30 s,72 ℃延伸1 min,30个循环。扩增产物验证:利用1%琼脂糖凝胶进行电泳,对处于目标位置的DNA条带进行切胶回收,回收后的DNA与pART2载体分别进行HI /I双酶切,在16 ℃条件下用T4连接酶连接,转入DH5α感受态后,涂布于LB平板,挑取单菌落培养后重提质粒,PCR及双酶切验证,将验证正确的质粒送至深圳华大基因公司测序。

表1 PCR扩增引物序列
1.2.2 treS的生物信息学分析 (1)序列同源性分析和系统发育树构建利用软件MEGA5构建系统发育树,这些序列选取NCBI数据库Blast得到的与目标DNA序列及其编码的氨基酸序列最为相似的序列;(2) 生物信息学分析分析过程中软件及相应的网站网址如下:蛋白质基本理化性质分析用ExPASy protparam Tool工具(http:// ca.expasy.org/tools/protparam. html),包括蛋白质的相对分子量、理论等电点、半衰期、不稳定系数等;蛋白的亲水性/疏水性利用ProtScale工具(http://ca.expasy.org/tools/protscale.html)分析;蛋白跨膜区预测利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM 2.0/);蛋白质亚细胞定位利用PSORT II server(http://psor.tims.utokyo.ac.jp/form2.html)预测;蛋白二级结构利用SOPMA工具(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行预测。
1.2.3 重组大肠杆菌的构建纯化PCR产物,将其与pART2质粒同时利用I/I进行双酶切后连接,构建重组表达质粒pART2-。利用化学法将连接产物转入DH 5α感受态细胞。挑取平板上的单菌落培养,依次进行质粒重提、PCR和双酶切验证,验证正确的进行测序,进而获得正确的DH 5α重组菌株。将上述验证正确的pART2-重组质粒,再次通过化转转入BL21 (DE3) 感受态细胞。采用上述步骤进行验证,最终获得正确的BL21(DE3)/pART2-重组表达菌株。含有空质粒的BL21(DE3)/pART2作为对照菌株。
1.2.4 TreS蛋白的表达将重组菌BL21(DE3)/pART2-和对照菌株BL21(DE3)/ pART2分别接种于LB培养基(含100 μg/mL卡那霉素)中,一级培养,培养条件如下:200 r/min,37 ℃;培养12 h后进行二级转接,接种量约1%,二级培养在250 mL锥形瓶中进行,瓶中装有50 mL抗性LB液体培养基的,初始OD600值至0.02(可以用LB培养基调节),二级培养仍为200 r/min,37 ℃,约20 h后收集菌体,加入5×Loading Buffer,于沸水中煮10 min,在室温下10000 r/min离心15 min,取上清液进行SDS-PAGE蛋白电泳。
1.2.5 大肠杆菌无压力条件下的生长特性分析菌株的一级和二级培养均与1.2.4的方法相同,二级接种后,每2 h取样测定OD600,时间为横坐标,OD600为纵坐标绘制生长曲线。
1.2.6 重组大肠杆菌抗逆性能的分析(1)大肠杆菌在高浓度压力冲击下的存活能力分析菌株的一级和二级培养均与1.2.4的方法相同,二级培养至对数中后期时,取1 mL菌液离心10 min收集菌体,离心条件为室温下6000 r/min,然后重悬于在5 mL LB液体抗性培养基中,该培养基中含有不同压力(分别为10%乙醇、15%甲醇、3 M山梨醇、2.5 M NaCl、pH=3.0以及0.1%的H2O2溶液),在37 ℃,200 r/min的条件下振荡冲击30 min。冲击后的培养液制成均匀的系列稀释液,稀释方法采用梯度稀释法,尽量使微生物细胞分散开,以单个细胞存在,选取合适的浓度,涂布于LB平板上,37 ℃过夜培养后,计数平板上的菌落数。存活率=菌株压力条件下的菌落数/菌株无压力条件下的菌落数;(2)大肠杆菌在适当压力条件下的生长特性分析菌株的一级和二级培养均与1.2.4的方法相同,在二级培养的初始加入不同的压力(分别为4%乙醇、5%甲醇、1M山梨醇0.6 M NaCl、pH=5.0以及0.025%的H2O2),在37 ℃,200 r/min的条件下振荡培养,在12、24和48 h时取样测定OD600值。相对OD600=菌株压力条件下的OD600值/菌株无压力条件下的OD600值。
2 结果与分析
2.1 简单节杆菌中treS基因的克隆
由图1可知,TCCC11037菌株的基因组的电泳条带清晰完整,说明DNA提取良好完整,并可用于下一步实验。
覆膜集雨种植能显著提高作物的产量和生物产量[2-4]。在西北干旱地区,覆膜被作为提高农作物产量最有效地方式大力倡导。本研究发现,地膜处理下啤酒大麦产量高于露地处理,出苗期、拔节期、抽穗期、成熟期也较早,但是倒伏较严重,倒伏面积是露地处理下的2倍,其余性状差别不显著。
图 1 简单节杆菌TCCC 11037基因组电泳图
M: DNA Marker;1:简单节杆菌基因组

图2 treS基因扩增结果
M:DL5000 DNA Marker;1:PCR产物
基因的PCR扩增产物电泳结果如图2所示。基因的的预期大小为1704 bp,图中电泳条带出现在1700 bp附近,条带清晰且无杂带存在。说明获得简单节杆菌中的基因的扩增产物。
2.2 简单节杆菌中treS的生物信息学分析
2.2.1 简单节杆菌中treS的同源性分析和系统发育树构建将基因的核苷酸与氨基酸同源比对后构建系统发育树,结果如下:TCCC 11037中的核苷酸和氨基酸序分别与sp78和sp. J54的同源性最高,分别达到87%和94%。利用TCCC 11037的构建的核苷酸和氨基酸系统发育树见图3。由图3可知,进化分析表明TCCC 11037的基因与氨基酸序列分别与诺卡氏菌的两个菌株中的序列最为接近,说明在亲缘关系上,与诺卡氏菌最近。
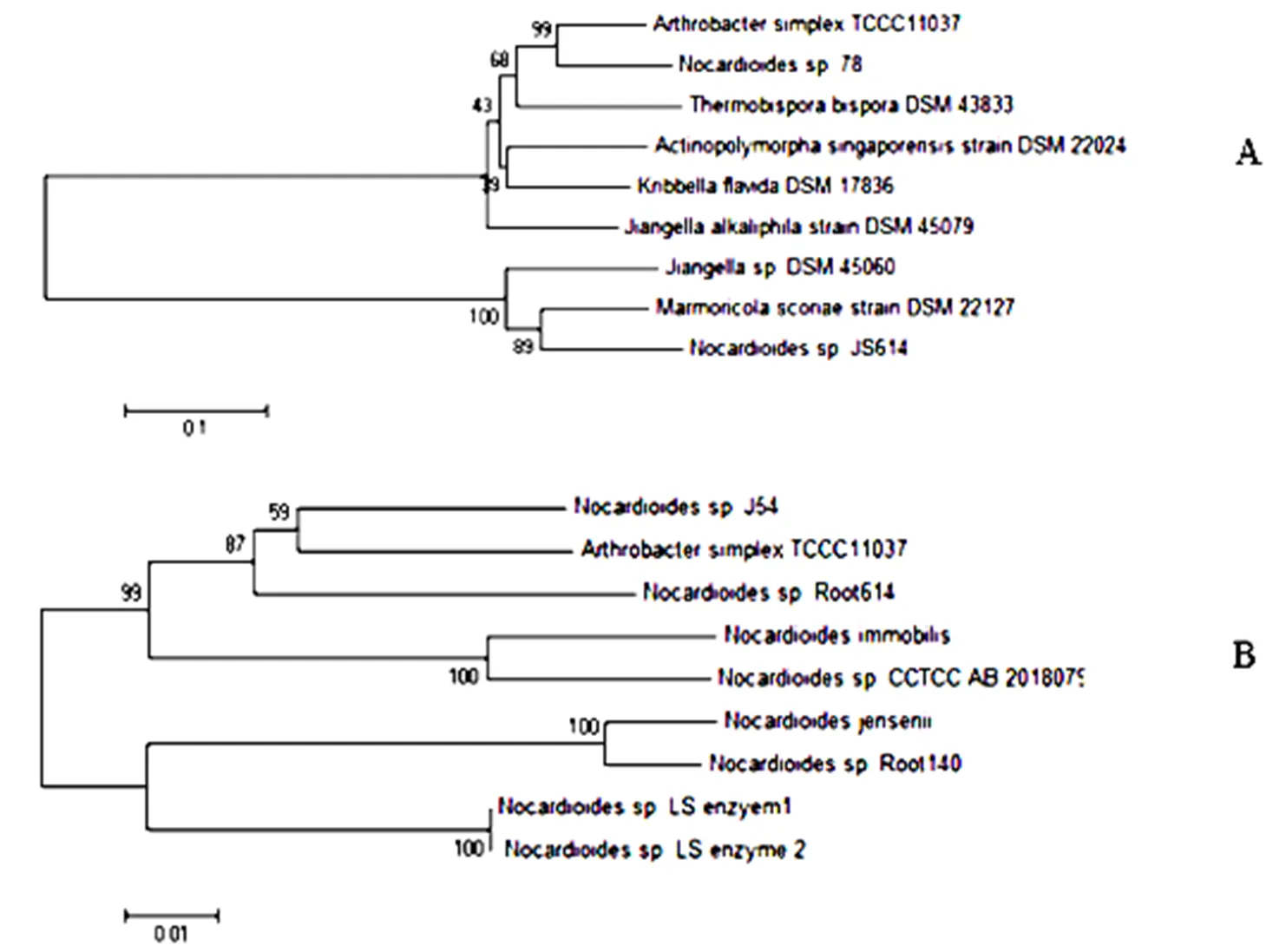
图 3 treS核苷酸(A)与氨基酸(B)序列的系统发育树
遗传距离用Tamura-Nei公式计算,系统发育树用Neighb Joint (NJ)法构建,枝长代表分歧程度,各枝上的数字是1000次bootsrap重抽样分析的支持百分比
2.2.1 简单节杆菌中TreS蛋白的生物信息学分析(1)理化性质分析简单节杆菌中TreS蛋白质的分子量是65202.39 Da,等电点(pI)为4.66,分子式C2948H4395N785O854S22,该蛋白质不稳定性参数为44.65高于阈值40,可视为不稳定蛋白质,根据软件,预估其半衰期分别为30 h(体外哺乳动物网状细胞),大于20 h(酵母体内);大于约10 h(大肠杆菌体内)。
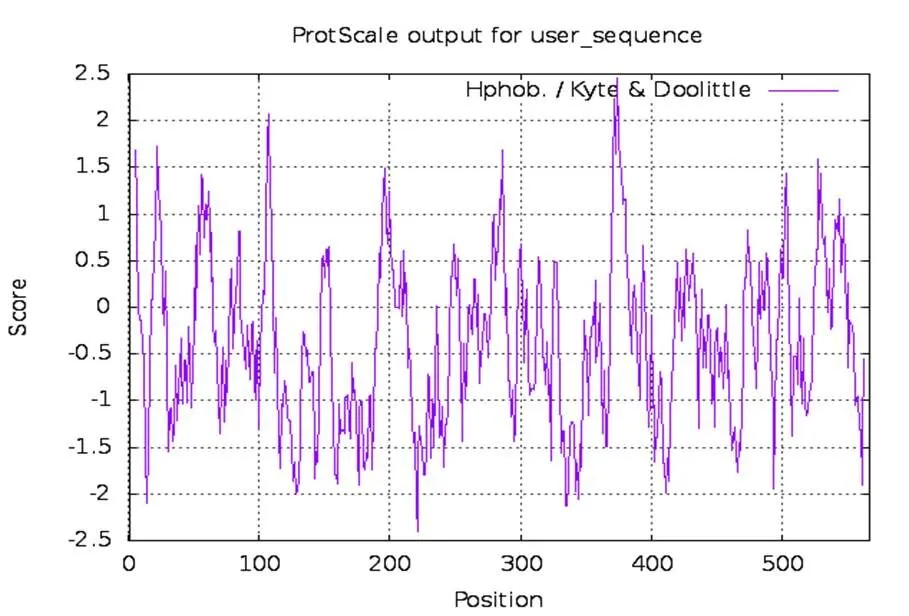
图 4 TreS蛋白各氨基酸亲疏水值

图 5 TreS蛋白跨膜结构分析
如图4可知,TreS蛋白在374个氨基酸处的疏水性最大,为2.456;在221个氨基酸处疏水性最小,为-2.400,并利用分析软件判断该蛋白为亲水性蛋白。
(2)蛋白跨膜结构及位置预测由图5可知,TreS蛋白不含跨膜螺旋结构,因此初步判断该蛋白不是跨膜蛋白。且预测可能存在于细胞质中。
(3)蛋白二级结构预测由图6可知,TreS蛋白的二级结构中无规则卷曲含量最高,为47.97%,其次是α-螺旋,含量为26.98%,延伸链为19.93%以及β-折叠5.11%。

图 6 TreS的二级结构
2.3 重组大肠杆菌的构建
由图7可知,各取上述重组菌株中提取的质粒pART2-分别进行PCR和双酶切,电泳后产物条带位置与预期位置相同,说明表达重组菌已经构建成功。

图7 重组质粒pART2-treS的PCR和双酶切结果
M: DNA Marker;1: 重组质粒的PCR扩增产物; 2: 重组质粒双酶切后的产物

图 8 TreS在大肠杆菌中的表达
M:蛋白质分子质量标准;1:BL21(DE3)/pART2-treS; 2:BL21(DE3)/pART2
2.4 TreS在大肠杆菌中的表达
由图8可知,相对于对照组,重组菌株BL21(DE3)/pART2-多一条蛋白条带,该条带位于约65 kDa处,与TreS蛋白的理论大小相吻合,说明已在大肠杆菌中成功表达。
2.5 treS基因表达对大肠杆菌生长特性的影响
图9是对照菌株及重组菌株在无压力条件下的生长曲线。由该图可知,重组菌株和对照菌株的生长阶段无明显的差异,在0~4 h间生长缓慢,为延滞期,在4 h后OD600迅速增加,即4-16 h为对数期,培养约16 h后菌体OD600没有明显变化,说明菌体生长进入稳定期。培养至18 h时菌体OD600达到最大值,约为1.10。在生长的各个周期,重组菌和对照菌株的生长差别不大,综上所述,基因表达对大肠杆菌生长特性没有明显影响。
2.6 简单节杆菌treS表达对大肠杆菌抗逆性能的影响
2.6.1表达对大肠杆菌高浓度压力冲击下存活情况的影响由图10可知,酸性条件(pH=3.0)、0.1%H2O2和10%乙醇冲击30 min后,重组菌株存活率未发现明显提高。而当冲击压力分别为15%甲醇、2.5 M NaCl和3 M山梨醇三种压力冲击后,重组菌株的存活率相对于对照菌均有了不同程度的提高。其中,甲醇冲击时,BL21/ pART2-的存活率为0.76,相对于对照菌株0.46,提高了约65%。3 M山梨醇和2.5 M NaCl冲击后,重组菌株的存活率分别为0.70和0.66,相对于对照菌株0.37和0.33,均提高了约一倍。这说明,简单节杆菌中基因的表达提高了大肠杆菌耐受甲醇、高渗透压力以及高盐压力的冲击的能力。值得注意的是,的表达对大肠杆菌在高浓度有机溶剂压力冲击后的存活能力产生了不同的影响,其中,该基因能显著提高菌株在甲醇压力冲击下的存活性能但却对乙醇压力冲击下的存活性能没有明显改善。
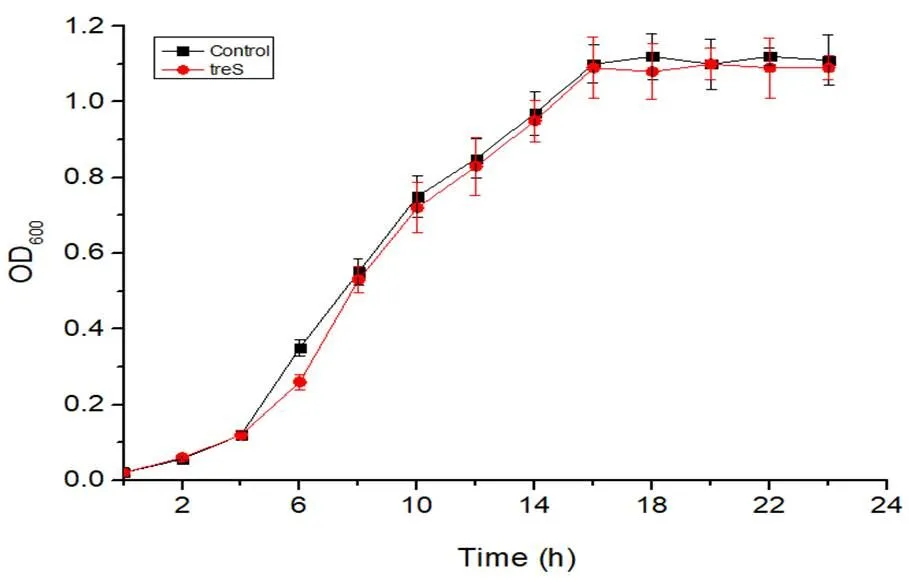
图 9 E. coli BL21/pART2和E. coli BL21/ pART2- treS重组菌株在无压力条件下的生长曲线

图10 E. coli BL21/pART2(Control)和E. coli BL21/ pART2- treS(treS)高浓度压力冲击下存活情况
2.6.2 海藻糖合成酶表达对大肠杆菌耐受适当压力的影响由图11可知,重组菌株在4%(v/v)乙醇、5%(v/v)甲醇、1 M山梨醇和0.6 M NaCl压力下的生长性能明显提高。其中,4%(v/v)乙醇培养48 h时的,对照菌株相对OD值为0.5重组菌株为0.6,约为对照菌的1.2倍,当压力条件为5%(v/v)甲醇培养12 h时,对照菌株为0.34,重组菌为0.46,重组菌是对照菌株的1.35倍;1 M山梨醇压力下培养12 h后时间后的相对OD值为0.20,比对照菌株(0.42)提高了110%,0.6 M NaCl压力下培养12 h后的相对OD值为0.41,比对照菌株(0.24)提高了71%。而在0.025%H2O2氧化压力和pH=5.0的弱酸压力下,和对照菌株相比,重组菌的相对OD提高较小。其中,氧化压力下培养12 h下的相对OD值为0.26,比对照菌株(0.23)提高了13%,pH=5.0酸性压力下培养48 h的相对OD值为0.81,比对照菌株(0.77)提高了约5%。综上可知,来源于的基因的可以明显提高大肠杆菌对有机溶剂、高渗和高盐压力的冲击压力,但是对氧化和酸性耐受抵抗效果提升不明显。

图 11 E. coli BL21/pART2(Control)和E. coli BL21/ pART2- treS(treS)适当压力下生长情况
3 讨 论
本文报道了来源于的海藻糖合酶编码基因的异源表达可以明显提高大肠杆菌对有机溶剂、高渗和高盐压力的冲击压力,但是对氧化和酸性胁迫的耐受效果提升并不明显。之前的研究较多关注的是海藻糖合成过程中的6-磷酸海藻糖合成酶(OtsA)和6-磷酸海藻糖酯酶(OtsB)在提高菌株耐受性方面的工作。如Nguyen等[11]发现基因的表达显著提高了大肠杆菌对有毒物质——粗脂肪酸及过氧化物的耐受性。Miller等[12]发现在大肠杆菌中过表达能明显提高菌株的耐盐和抗脱水能力,进而将乙醇的产率提高至90%。这些研究结果都说明,利用分子操作提高海藻糖的含量是显著提高微生物胁迫耐受性的有效手段,但目前关于海藻糖合酶的报道还相对较少,对于该基因的研究尚待加强。
4 结 论
本研究以实验室保存的简单节杆菌TCCC 11037菌株为模板,依靠分子生物学技术获得目标t基因并对其进行研究。结果表明,基因有1704 bp的核苷酸与sp. 78的同源性最高,编码产物为含有567个氨基酸的蛋白,sp. J54的同源性最高,分别为87%和94%。生物信息学分析的结果表明,该蛋白质的分子量是65202.39 Da,等电点pI=4.66,该蛋白具有亲水性、非跨膜蛋白,可能存在于细胞质中。结果表明,简单节杆菌中基因的表达对大肠杆菌无压力条件下生长特性没有明显影响,重组菌株在有机溶剂、高渗和高盐适当压力下的生长性能和高浓度压力冲击后的存活性能均明显提高,但对酸性和氧化压力的耐受性没有明显提高。这些结果说明,简单节杆菌中的treS基因对大肠杆菌的抗逆性能发挥着重要作用。
[1] 王艳霞,王红玲,王敏,等.简单节杆菌groEL基因表达对大肠杆菌抗逆性能的影响[J].生物技术通报,2016,32(5):180-186
[2] 宁静,刘莉娜,王敏,等.乙醇对简单节杆菌生长、生理特性和细胞结构的影响[J].天津科技大学学报,2013,28(6):9-14
[3] 骆健美,宋妍,王建锋,等.基于细胞性质分析不同有机溶剂对简单节杆菌C1,2脱氢反应的影响[J].化学与生物工 程,2012,29 (5):49-53
[4] 骆健美,王建锋,宋妍,等乙醇对简单节杆菌TCCC 11037生长和细胞性质的影响[J].化学与生物工程,2011,28(3):66-69
[5] Luo JM, Song ZY, Ning J,. The global ethanol-induced alteration inand its mutants with enhanced ethanol tolerance [J]. Applied Microbiology and Biotechnology, 2018,102:9331-9350
[6] Chen TH, Murata N. Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes [J]. Current Opinion Plant Biology, 2002,5:250-257
[7] González-Hernández JC, Jiménez-Estrada M, Peña A. Comparative analysis of trehalose production byunder saline stress [J]. Extremophiles. 2005,9(1):7-16
[8] Kobayashi K. Gene Analysis of Trehalose -producing enzymes fromin Sulfolobales, KM1 [J]. Bioscience Biotechnology Biochemistry, 1996,60(10):1720 -1723
[9] Nishimoto T, Nakano M. Puryfication and Properties of a novel enzyme, Trehalose Synthase, fromsp. R48 [J]. Bioscience Biotechnology Biochemistry, 1996,60(4):640-644
[10] Cristinel Sandu, Calin-Bogdan Chiribau, Paula Sachelaru,. Plasmids for nicotine-dependent and -independent gene expression inand other Arthrobacter species [J]. Applied and Environmental Microbiology, 2005:8920-8924
[11] Nguyen AD, Kim YG, Kim SB,. Improved tolerance of recombinantto the toxicity of crude glycerol by overexpressing trehalose biosynthetic genes (otsBA) for the production of b-carotene [J]. Bioresource Technology, 2013,143:531–537
[12] Miller EN, Ingram LO. Sucrose and overexpression of trehalose biosynthetic genes (otsBA) increase desiccation tolerance of recombinant[J]. Biotechnology Letters, 2008,30:503-508
The Heterologous Expression offromand Its Effects on the Resistance Performance of
SUN Ya-hua, CHENG Hong-jin, LU Zhi-yi, LUO Jian-mei*
300457,
with steroids C1,2 dehydrogenation ability has been widely used in the industry. During the biotransformation process, organic solvents (such as ethanol) are generally added to increase the solubility of hydrophobic substrates, but its high amount is tended to generates toxic effects on cells. Our previous omics analysis found that trehalose synthase (TreS) involved in the trehalose formation was closely related to cell adaptive behavior under ethanol stress condition. Based on it the geneswas amplified by PCR using the genome of an industrial strainTCCC11037 as the template and its bioinformatics analysis was performed. The results showed that amino acid sequence of thad the highest homology with the trehalose synthase gene derived fromsp. J54and the ratio were 94%. The molecular weight and the isoelectric point of the protein were predicted to be 65202.39 Da and 4.66, respectively. The protein was unstable, hydrophilic, and had no transmembrane helix, probably locating in the cytoplasm. The expression of this gene inBL21 (DE3) did not change obviously the cell growth performance, but significantly improved the cell tolerance to methanol, osmoticpressure and salt . This work is the first report on the cloning and expression ofgene from, which will provide basic data for further study of its biological function.
;;resistance performance
Q786
A
1000-2324(2021)02-0234-07
10.3969/j.issn.1000-2324.2021.02.013
2019-05-17
2020-01-04
国家自然科学基金面上项目(21978220);天津市自然科学基金重点项目(18JCZDJC32500)
孙亚华(1989-),女,硕士研究生,研究方向:微生物抗逆机制. E-mail:sunyahuavc@163.com
Author for correspondence. E-mail:luojianmei@tust.edu.cn
——一道江苏高考题的奥秘解读和拓展

