蛋白激酶PpMAPK3与PpDAM6互作调控桃花芽休眠进程研究
许琛,李森,张宇正,盖瑜,张新昊,李玲*,陈修德*
蛋白激酶PpMAPK3与PpDAM6互作调控桃花芽休眠进程研究
许琛1,2,李森1,2,张宇正1,2,盖瑜1,2,张新昊1,2,李玲1,2*,陈修德1,2*
1. 山东农业大学信息科学与工程学院,作物生物学国家重点实验室,山东 泰安 271018 山东省果树协同创新中心, 山东 泰安 271018
为了探究PpMAPK3在桃花芽休眠过程中起到的作用,桃花芽休眠调控通路,我们以‘中油5号’桃一年生枝条为试材,对桃花芽休眠阶段进行划分,通过荧光定量分析、酵母双杂交筛库、双分子荧光互补试验以及亚细胞定位对PpMAPK3在桃花芽休眠过程中的作用进行了研究。试验结果表明:(1)桃花芽的休眠过程可以划分为内休眠阶段、休眠转化阶段和生态休眠阶段3个阶段,花芽萌发率与低温积累量密切相关;(2)的表达量在休眠转化阶段随着花芽萌发率的增加而增加,并在整个休眠转化阶段保持较高的表达量,随后在生态休眠阶段逐渐降低;(3)PpMAPK3主要定位于细胞核中,酵母双杂交试验和双分子荧光互补试验表明PpMAPK3与PpDAM6存在蛋白水平上的互作关系。
蛋白激酶; 桃; 芽休眠
芽休眠是多年生落叶果树躲避温带和寒带地区冬季不利气候条件的重要生理机制,是受多种内部及外部因素调控的复杂过程[1,2]。冬季有效的低温积累是温带落叶果树的花芽在春季正常萌发必要的先决条件[3]。对于需要休眠的桃()来说,不同的桃品种需要低温积累量不同[4]。近年来,随着设施桃栽培技术的不断发展,由于对桃休眠知识的缺乏而引起的设施桃花芽萌发不齐等问题日渐严重,因此充分了解桃花芽休眠过程中的分子调控机制对设施桃生产至关重要。
促分裂原活化蛋白激酶(MAPKs)是一种广泛存在于生物体内的信号酶,在细胞分裂、发育、代谢和多种应激响应等生命活动中起着重要作用[5,6]。MAPK家族在所有真核生物中进化都十分保守,可以划分为三类,形成三级MAPK信号级联,其中包括:促分裂原活化蛋白激酶(MAPK)、促分裂原活化蛋白激酶的激酶(MAPKK)以及促分裂原活化蛋白激酶的激酶的激酶(MAPKKK)。这些激酶通过一级一级磷酸化的形式发挥信号放大的作用,最终传递给其下游靶蛋白[7]。然而,在某些情况下,MAPK可以通过自身磷酸化的方式独立于MAPKKK和MAPKK发挥功能[8-10]。根据动植物中MAPKs数量的比较可知,植物中MAPKs的数量明显高于动物。这可能是由于植物无法通过移动来避免不利条件,因此需要相对大量的MAPK来帮助植物适应各种环境胁迫因素[11]。在拟南芥中,MAPK3参与了抗冻性,病原体响应性和花药发育等过程的调控[12-14]。然而,桃PpMAPK3 (Prupe.6G091700)的功能仍然知之甚少。本试验通过酵母双杂交筛库、亚细胞定位等方法对PpMAPK3调控通路进行初步分析,为深入研究该基因在桃花芽休眠过程的作用提供了理论依据。
1 材料与方法
1.1 试验材料
试验于2018-2019年在山东农业大学园艺科学与工程试验站、设施果树实验室进行。所用的植物试材为8年生油桃(var.)‘中油5号’,树体长势状况一致且管理良好。
1.2 试验方法
1.1.1 桃花芽休眠阶段界定于2018年10月15日起至次年1月30日取25枝一年生枝条置于温度25 °C,光照强度为40 μmol·m-2·s-1,昼/夜14 h/10 h的培养箱内,根据花芽萌发情况对桃花芽休眠阶段进行划分。
1.1.2 RNA提取与荧光定量分析取0.5 g花芽组织用植物总RNA提取试剂盒(RNAprep Pure Plant Kit)提取RNA,以提取后的RNA为模板使用预混液两步法RT-qPCR首选试剂(HiScript Q RT SuperMix for qPCR)反转录得到cDNA,使用SYBR premix Ex Taq进行定量PCR分析,以为内参基因,使用2−ΔΔCT法计算目标基因的相对表达水平。
1.1.3基因克隆使用2×Phanta Max Master Mix(诺唯赞)以桃花芽cDNA为模板克隆PpMAPK3全长开放阅读框。
1.1.4 酵母双杂交试验使用Matchmaker酵母双杂交系统(Clontech)进行酵母双杂交(Y2H)分析。
1.1.5 PpMAPK3亚细胞定位用携带GFP融合蛋白的载体(PpMAPK3-GFP以及对照GFP构建体)转染洋葱表皮细胞。使用ZEN lite软件(Zeiss)定量GFP荧光信号。
1.1.6 双分子荧光互补分析在洋葱表皮细胞中瞬时共表达含有PpMAPK3-CYFP和PpDAM6-NYFP的融合载体,以空载体为对照,使用ZEN lite软件(Zeiss)鉴定YFP荧光信号。
1.1.7 数据分析方差分析采用SPSS18.0软件Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 桃花芽休眠阶段鉴定
我们从2018年10月15日至次年1月30日记录每天温度低于7.2 °C的小时数(表1),并根据低温积累量和一年生枝条的花芽萌发率对‘中油5号’桃花芽休眠阶段进行划分,结果如图1所示,2018年10月15日到12月15日此阶段花芽萌发率低于50%,我们将其定义为内休眠阶段;11月15日花芽开始萌发到12月15日花芽萌发率达到50%,我们将其定义为休眠转化阶段;2018年12月15日到次年1月30日此阶段花芽萌发率超过50%,我们将其定义为生态休眠阶段。

表 1 2018~2019年低温积累量
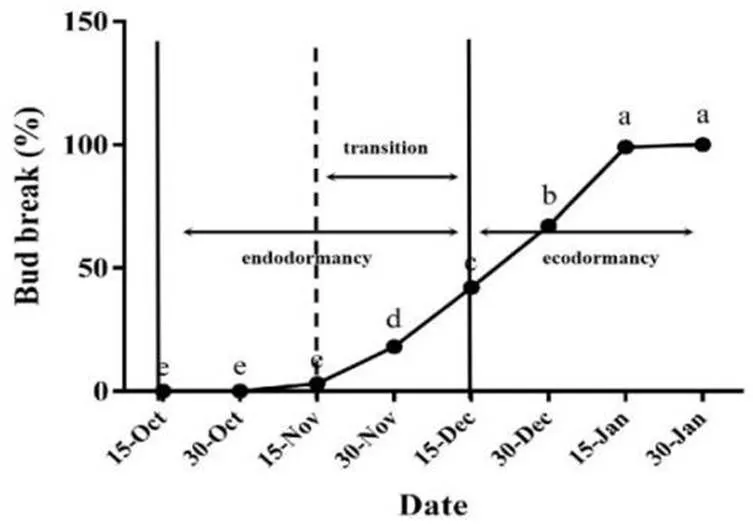
图 1 桃花芽休眠阶段鉴定
2.2 PpMAPK3荧光定量分析
我们对休眠过程中桃花芽内进行荧光定量分析,结果如图2所示,在内休眠阶段前期维持较低的表达量,当到达休眠转化阶段时,的表达量显著上调,并在整个休眠转化阶段维持较高的表达水平,当进入生态休眠阶段时,的表达量开始逐渐下调,由此可以说明参与调控桃花芽休眠解除进程。
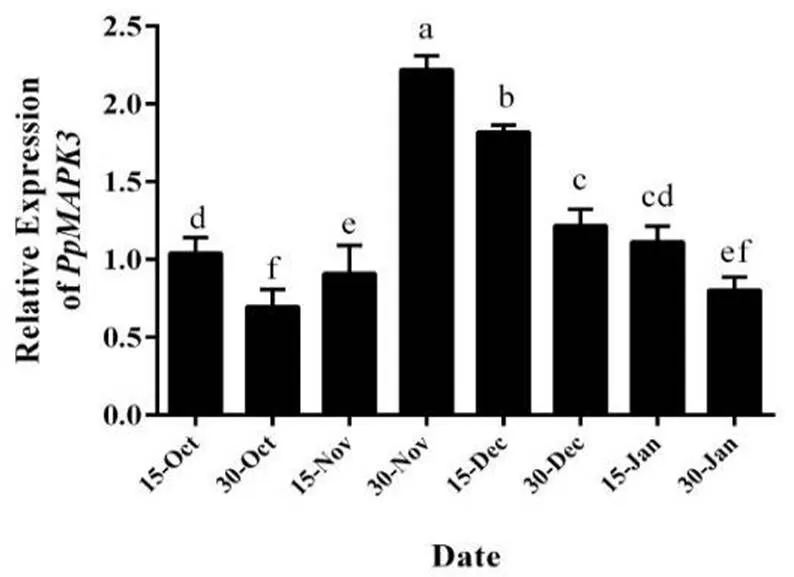
图 2 休眠过程中花芽PpMAPK3荧光定量分析
2.3 PpMAPK3基因克隆
我们以花芽中提取的总RNA反转录得到的cDNA作为模板对进行克隆,克隆得到了CDS序列全长(图3)。对克隆得到的基因测序得出克隆产物与CDS序列一致,全长为1113bp。

图 3 PpMAPK3基因克隆
2.4 PpMAPK3自激活鉴定
为了筛选PpMAPK3的互作蛋白,我们对PpMAPK3的自激活活性进行了鉴定,由图4可知,含有重组质粒的酵母在SD/-T with X-α-Gal培养基上变蓝,说明PpMAPK3蛋白有自激活活性,在SD/-T with X-α-Gal、200 ng/mL AbA的缺陷培养基酵母不生长,这说明200 ng/mL AbA能够抑制PpMAPK3蛋白的自激活活性,可以进行下一步酵母双杂交筛库实验。
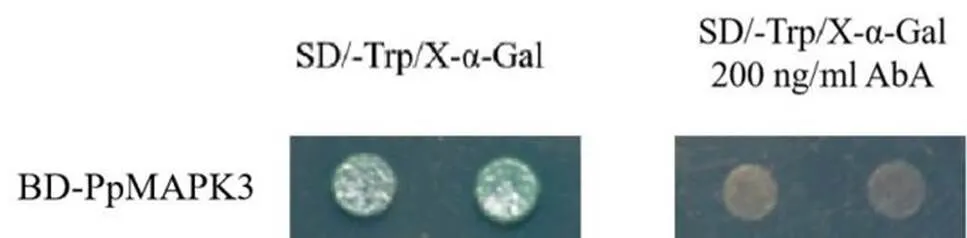
图 4 PpMAPK3自激活鉴定
2.5 PpMAPK3亚细胞定位
为了检测PpMAPK3的亚细胞定位,我们把含有GFP荧光蛋白的融合质粒PpMAPK3-GFP在洋葱上表皮细胞中表达。由图5可知,使用激光共聚焦显微镜对洋葱上表皮细胞进行观测,绿色萤光主要定位在PpMAPK3-GFP转化的洋葱上表皮细胞的细胞核内,对照处理的空GFP侵染的洋葱上表皮细胞绿色萤光在细胞内均有分布。这说明PpMAPK3主要定位在细胞核内。

图 5 PpMAPK3亚细胞定位(比例尺=20 μm)
2.6 PpMAPK3互作蛋白筛选
以含有CDS序列全长的pGBKT7融合质粒作为诱饵载体进行酵母双杂交筛库。我们筛选出7个可能存在互作的蛋白(表2),对这些蛋白功能进行分析和筛选,最后我们筛选出一个MADS-BOX蛋白(PpDAM6)与休眠最为相关,我们将PpDAM6作为兴趣蛋白进行进一步互作验证。

表 2 PpMAPK3酵母双杂交筛库结果
2.7 PpMAPK3和PpDAM6酵母双杂交验证
为了验证PpMAPK3是否是PpDAM6的互作蛋白,我们进行酵母双杂交实验,以BD-PpMAPK3作为诱饵载体,AD-PpDAM6作为目标载体,融合质粒转化酵母感受态细胞,进行点对点验证。由图6可知,BD-PpMAPK3加空AD能够在SD/-T-L缺陷培养基上正常生长,在SD/-T-L-A-H with 200 ng/mL AbA的缺陷培养基上不能生长;BD-PpMAPK3加AD-PpDAM6能够在SD/-T-L缺陷培养基上正常生长,且BD-PpMAPK3加AD-PpDAM6也可以在SD/-T-L-A-H with 200 ng/mL AbA的缺陷培养基上正常生长。这说明PpMAPK3与PpDAM6在酵母内蛋白互作。

图 6 PpMAPK3与PpDAM6在酵母内互作
2.8 PpMAPK3和PpDAM6双分子荧光互补验证
为了进一步确认PpMAPK3与PpDAM6之间的互作关系,我们进行了双分子荧光(BiFC)实验。结果如图7所示,当在洋葱上表皮细胞中共表达PpMAPK3-CYFP+PpDAM6-NYFP时,能够在514 nm光源下观测到黄色萤光,而当在洋葱上表皮细胞中共表达PpMAPK3-CYFP+NYFP、CYFP+PpDAM6-NYFP时,使用激光共聚焦显微镜在514 nm光源下不能观测到黄色萤光。这说明在洋葱上表皮细胞中PpMAPK3能够和PpDAM6互作。

图 7 PpMAPK3与PpDAM6双分子荧光互补(BiFC)验证(比例尺=50 μm)
3 讨论
休眠是典型的落叶果树的重要生态以及农艺性状,对于温带和部分寒冷地区的落叶果树来说,芽内休眠是果树躲避不利气候条件的重要过程[3]。需要休眠的落叶果树需要经历一定时间的芽休眠才能完成芽内部的各种生理生化转化,因此休眠不仅是躲避不良的外部气候条件,还是花芽萌发的必要条件[15-17]。我们根据低温积累量与花芽萌发率对‘中油5号’花芽的休眠阶段进行了划分,包括三个阶段:内休眠阶段、休眠转化阶段和生态休眠阶段。
PpMAPK3是一种苏氨酸/丝氨酸蛋白激酶,能够参与植物的各项生命活动[10]。在拟南芥中MAPK3已被证明是植物先天免疫系统的基本组成部分[12],且在促进被膜中的细胞分裂中也起着重要作用,特别是在胚珠发育过程中[11]。酵母双杂交筛库试验筛选出7个可能的互作蛋白,这些蛋白参与桃生长发育等各个方面,这说明PpMAPK3能够广泛参与调控桃的各项生命活动。荧光定量结果表明,在休眠转化阶段的表达量随着花芽萌发率的增加而增加,并在整个休眠转化阶段保持较高的表达量,在生态休眠阶段逐渐降低。说明PpMAPK3能够参与调控桃花芽休眠进程,是桃花芽休眠解除的正调控因子。
基因是属于MADS-box家族中的一类转录因子[18]。对桃树进行延长低温条件处理和休眠解除剂处理,发现和与桃芽的内休眠过程最相关[1,19]。将因转入杨树中验证了其对芽生长有抑制功能,且的表达受短时低温诱导,是休眠的负调控因子[20,21]。本试验研究发现,在酵母中PpMAPK3可以与PpDAM6蛋白互作,双分子荧光互补(BiFC)试验进一步验证了它们的互作关系。PpDAM6是转录因子,前人研究发现PpDAM6主要定位于细胞核中,我们对PpMAPK3进行亚细胞定位发现,PpMAPK3同样定位于细胞核中,这说明PpMAPK3能够在细胞核中与PpDAM6互作。
4 结论
在桃花芽休眠过程中,PpMAPK3通过与PpDAM6互作参与桃花芽休眠解除进程,PpMAPK3是花芽休眠解除的正调控因子。推测PpMAPK3可能是通过磷酸化PpDAM6相应的结构域位点来调控桃花芽休眠解除,但仍待进一步试验验证。
[1] Wang QJ, Xu GX, Zhao XH,. TCP transcription factor PpTCP20 is involved in peach bud endodormancy by inhibiting PpDAM5/PpDAM6 and interacting with PpABF2[J]. Journal of Experimental Botany, 2019,71(4):1585-1597
[2] Egea JA, José E, David R. Reducing the uncertainty on chilling requirements for endodormancy breaking of temperate fruits by data-based parameter estimation of the dynamic model: a test case in apricot [J]. Tree Physiology, 2020,50:112-124
[3] Cooke JEK, Eriksson ME, Junttila O. The dynamic nature of bud dormancy in trees: environmental control and molecular mechanisms[J]. Plant, Cell & Environment, 2012,35(10):1707-1728
[4] WangDL, Gao ZZ, Du PY,. Expression of ABA metabolism-related genes suggests similarities and differences between seed dormancy and bud dormancy of peach ()[J]. Frontiers in Plant Science, 2016,6(233):1248
[5] Goyal RK, Dan T, Chomistek N,. Analysis of MAPK and MAPKK gene families in wheat and related Triticeae species[J]. BMC Genomics, 2018,19(1):178
[6] Zhang XT, Wang GH, Guo JP,. Functional analysis ofuncovers its positive role in response to Pseudomonas syringae pv. tomato DC3000 in tobacco [J]. Plant Molecular Biology, 2016,90:19-31
[7] 杜培勇,王东岭,谭秋平,等.油桃花芽休眠解除过程中MAPK家族基因表达分析[J].植物生理学报,2016,52(2):216-224
[8] Chen LH, Wei H, Tan SL,. Genome-wide identification and analysis of MAPK and MAPKK gene families in[J]. Plos One, 2012,7(10):e46744
[9] Jin X, Zhu LP, Yao Q,. Expression profiling of mitogen-activated protein kinase genes reveals their evolutionary and functional diversity in different rubber tree (s) cultivars[J]. Genes, 2017,8(10):261
[10] 龙琴,谢宇,雷天刚,等.柑橘MAPK基因的生物信息及其响应溃疡病菌侵染的表达分析[J].园艺学报,2020,47(11):28-39
[11] Lee H, Jun YS, Cha OK,. Mitogen-activated protein kinases MPK3 and MPK6 are required for stem cell maintenance in the Arabidopsis shoot apical meristem[J]. Plant Cell Reports, 2019,38:311-319
[12] McNeece BT, Sharma K, Lawrence GW,. The mitogen activated protein kinase (MAPK) gene family functions as a cohort during thedefense response to[J]. Plant physiology and biochemistry, 2019,137:25-41
[13] Mao XX, Zhang JJ, Liu WG,. The MKKK62-MKK3-MAPK7/14 module negatively regulates seed dormancy in rice [J]. Rice, 2019,12:2-16
[14] Li H, Ding YL, Shi YT,. MPK3- and MPK6-Mediated ICE1 phosphorylation negatively regulates ICE1 stability and freezing tolerance in Arabidopsis[J]. Developmental Cell, 2017,43(5):630-642
[15] 孙凌俊,马丽,高圣华,等.落叶果树休眠期糖代谢研究进展[J].北方果树,2019(2):1-4
[16] 王海波,王孝娣,史祥宾,等.秋促早栽培鲜食葡萄元旦,春节成熟上市技术[J].中国果树,2020(3):107-110
[17] 孙利鑫,张亚红.落叶果树休眠期解除界定的研究进展[J].中国果树,2016(2):55-59
[18] 上官凌飞,王子诚,方项,等.DAM基因调控多年生果树芽休眠的机制[J].南京农业大学学报,2020,(5):790-799
[19] 张伟富,郝心愿,杨亚军,等.DAM基因在植物芽休眠调控中的研究进展[J].植物生理学报,2019(8):1047-1053
[20] JiménezS, Lawton-Rauh AL, Reighard GL,. Phylogenetic analysis and molecular evolution of the dormancy associated MADS-box genes from peach[J]. BMC Plant Biology, 2009,9:81
[21] Xie YH. Cloning, expression analysis, and transformation vector construction of DAM homologs in peach and poplar [D]. Clemson US:Clemson University, 2011
Study on the Process Regulating Peach Flower Bud Dormancy by Mitogen-activated Protein Kinases PpMAPK3 and PpDAM6
XU Chen1,2, LI Sen1,2, ZHANG Yu-zheng1,2, GAI Yu1,2, ZHANG Xin-hao1,2,LI Ling1,2*, CHEN Xiu-de1,2*
1.271018,2.271018,
In order to explore the role of PpMAPK3 in the dormancy process of peach flower buds and the regulation pathway of peach flower bud dormancy, we use the annual peach shoots of 'Zhongyou 5' as the test material to classify the dormancy stages of peach flower buds through fluorescence quantitative analysis and yeast two-hybrid screening library, bimolecular fluorescence complementation test and subcellular localization have been carried out to study the role of PpMAPK3 in the process of peach flower bud dormancy. The test results show that: (1) The dormancy process of peach flower buds can be divided into three stages: endodormancy stage, transition stage and ecodormancy stage. The germination rate of flower buds is closely related to the accumulation of low temperature; (2) The expression ofincreases with the increase of flower bud germination rate in the transition stage, and maintains a high expression level throughout the transition stage, and then gradually decreases in the ecdormancy stage; (3) PpMAPK3 is mainly located in the nucleus, yeast two-hybrid assay and two-molecule fluorescence complementation experiments show that PpMAPK3 interacts with PpDAM6 at the protein level.
Protein kinases;; bud dormancy
S662.1
A
1000-2324(2021)02-0168-06
10.3969/j.issn.1000-2324.2021.02.002
2020-11-25
2021-01-11
山东省自然基金面上项目(ZR2018MC023);山东省农业良种工程项目(2020LZGC007);山东省农业重大应用技术创新项目资助
许琛(1996-),男,硕士研究生,主要从事果树分子生物学及生理研究. E-mail:xuchensdau@163.com
Author for correspondence. E-mail:liling217@sdau.edu.cn; chenxiude@163.com

