苹果黑腐皮壳菌侵染苹果枝干过程的转录组分析
靳纪洋,刁雨菲,于成明,熊雄,赵涛,何邦令,刘会香
苹果黑腐皮壳菌侵染苹果枝干过程的转录组分析
靳纪洋1,刁雨菲1,于成明1,熊雄1,赵涛2,何邦令1,刘会香1
1. 山东农业大学植物保护学院/山东省林业有害生物防控工程技术研究中心, 山东 泰安 271018 2. 徂徕山林场, 山东 泰安 271027
苹果黑腐皮壳菌(var.)引起的苹果树腐烂病是我国苹果产区发生严重的病害之一,了解病原菌侵染寄主不同时期的基因表达有助于揭示病菌的致病机制和苹果抗病机制。本实验应用Illumina平台对苹果黑腐皮壳菌侵染不同时期的寄主枝干发病过程进行转录组测序,同时通过与未侵染的病原菌和寄主组织进行比较。在病原菌侵染过程中,病原菌中发现4092个差异表达基因,寄主中发现16966个差异基因,通过对三个时期的上调差异表达基因进行GO和KEGG分析,结果表明病原菌侵染导致了寄主细胞壁降解、毒素物质合成、寄主抗毒物质分解和自身营养调节等过程;寄主主要通过膜脂过氧化作用、活性氧清除酶和防御酶抵抗病原菌的入侵。上述研究明确了苹果黑腐皮壳菌与寄主互作的生物学过程,为探讨病菌与寄主的分子互作机制奠定基础。
苹果腐烂病; 苹果黑腐皮壳菌; 侵染过程; 转录组分析
由苹果黑腐皮壳菌()引起的苹果腐烂病(canker of apple)是危害我国苹果的重要病害。分布广泛,危害严重,几乎所有苹果产区均有发生[1]。苹果腐烂病主要侵害苹果的枝干和果实,导致苹果树皮腐烂,果实产量和品质严重下降[1,2]。因此,深入研究病菌的的致病机制和寄主植物的抗病机制可为病害的科学防控提供理论依据。
转录组学是从RNA水平研究基因表达的情况,可研究病菌不同侵染阶段与寄主互作基因瞬时表达情况。柯希望2014年通过Illumina RNA-Seq技术对在PDA上生长和感染苹果枝干的苹果黑腐皮壳菌进行转录组测序,通过GO和KEGG富集分析,发现病原菌的侵染期间与果胶酶分解代谢、水解酶活性和次生代谢产物合成相关的基因表达普遍上调[3]。并在寄主与病原菌互作数据库注释了一些与致病性丧失和致病力降低相关的上调基因,这些可能也参与细胞壁水解和次级代谢产物运输,明确了苹果黑腐皮壳菌侵染寄主期间次级代谢产物和细胞壁水解酶的重要性。本研究以苹果黑腐皮壳菌在PDA培养基3 d、6 d、12 d生长的病菌和及苹果枝干部寄主材料为对照,以上述侵染阶段发病部位组织为试验材料进行转录组分析以期解析病原菌与寄主互作的代谢途径及生物学过程,为探讨病菌与寄主植物的分子互作机制奠定基础。
1 材料与方法
1.1 供试菌株的培养和人工接种
病菌为苹果黑腐皮壳菌()强致病力菌株sdau11-175,采集自山东烟台,本实验室分离,20%甘油,4 ℃保存待用。
病原菌接种:选取自山东农业大学植保实验站直径1~2 cm两年生生长一致的富士苹果枝条。将枝条切成25 cm长的段,用自来水冲洗,后浸泡在1%次氯酸钠中10 min,再用无菌水冲洗3次,顶端封蜡,每个枝条用打孔器打取间隔5 cm直径5 mm伤口[3]。然后将PDA培养6 d相同直径的病菌菌饼接种于上述伤口中,脱脂棉保鲜膜保湿度,25 ℃水培,于第3 d、第6 d、第12 d分别收集0.2 g PDA病菌菌丝体、空白培养基接种苹果组织和病斑组织置于1.5 mL无菌离心管中,液氮冷冻﹣80 ℃保存、每一个时段样本重复3次。
1.2 RNA的提取和测序
按照试剂盒(miRNA ISOlation Kit,Ambion-1561,mirVana™公司)说明提取各样品的RNA,并使用DNase消化DNA后,用带有OligodT的磁珠富集真核生物mRNA,以打断后的mRNA为模板合成二链cDNA,将纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后进行片段大小选择,最后加入PCR Primer Cocktail和PCR Master Mix混匀,进行PCR扩增,纯化后得到文库,用Agilent 2100 Bioanalyzer[4]质检合格后,Illumina HiSeqTM 2500进行测序,产生125 bp或150 bp的双端数据。
1.3 原始数据的过滤、比对和序列注释
对通过Illumina平台所获得的大量双端测序数据,采用Trimmomatic[5]软件对原始数据进行质量预处理,并对整个质控过程中的reads数进行统计汇总,去除接头(Adaptor)和低质量Reads得到Clean Reads。利用hisat2[6]将Clean Reads与指定的参考基因组进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样品特有的序列特征信息。用已知的参考基因序列以及注释文件的数据库为依据,采取序列相似性比对的方法鉴定出各蛋白编码基因在各样本中的表达丰度,使用htseq-count[7]软件获取每个样本中比对到蛋白编码基因上的reads数,利用cufflinks[8]软件来计算蛋白编码基因的表达量FPKM值。
1.4 差异表达基因筛选
利用DESeq[9]软件对各个样本基因的counts数目进行标准化处理(采用basemean值来估算表达量),计算差异倍数,并采用NB(负二项分布检验的方式)对reads数进行差异显著性检验[10],最终根据差异倍数及差异显著性检验结果来筛选差异蛋白编码基因(默认筛选差异的条件为<0.05且差异倍数大于2)。
1.5 差异表达基因GO和KEGG富集分析
得到差异表达基因之后,对上调的差异表达基因进行GO富集分析,结合GO注释结果对其功能进行描述和分类。利用KEGG[11]数据库对差异蛋白编码基因进行Pathway分析,找到富集差异基因的Pathway条目,寻找不同样品的差异蛋白编码基因所参与的代谢过程和细胞信号通路。
2 结果与分析
2.1 数据产出与统计
通过对苹果树腐烂病侵染苹果枝干过程中的27个样品的有参转录测序,其中苹果树腐烂病获得62.18G的Clean Data,各样本的有效数据量分布在6.84~6.95G,Q30碱基分布在92.96~94.00%,平均GC含量为54.83%。通过将reads比对到苹果黑腐皮壳菌()参考基因组上,得到各个样本的基因组比对情况,比对率为89.52~97.19%;寄主苹果枝干获得124.03G的Clean Data,各样本的有效数据量分布在6.76~7.00G,Q30碱基分布在94.71~95.57%,平均GC含量为49.43%。通过将reads比对到苹果()参考基因组上,得到各个样本的基因组比对情况,比对率为8.31~94.42%(见表1)。
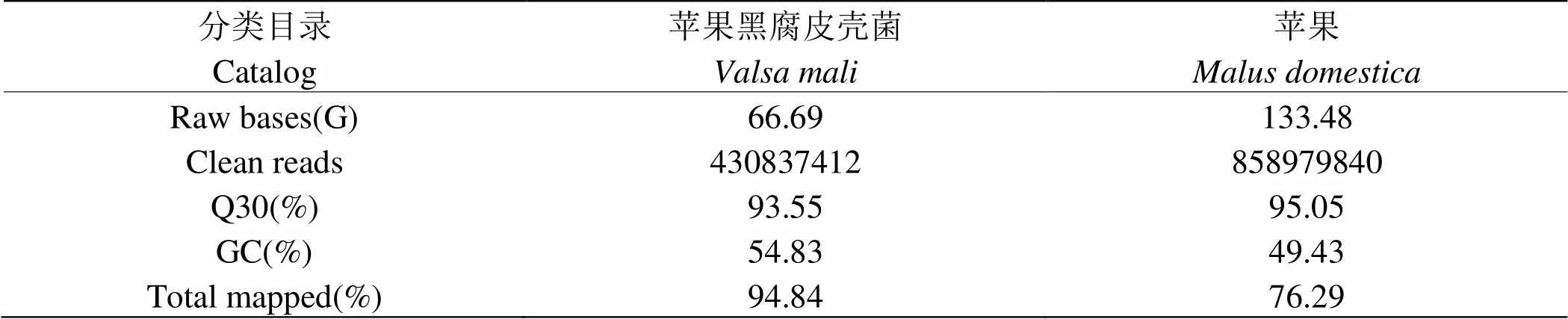
表 1 转录组测序数据统计
2.2 差异表达基因筛选
将过滤后的数据进行比对发现侵染后的病原菌与寄主都具有较高的蛋白编码基因丰富度。根据筛选标准(<0.05&| FoldChange |>2)从病原菌中找到差异表达基因4092个,其中上调基因含2363个,在三个时期(3 d、6 d、12 d)分别有294、721、1348个上调基因,而在寄主中找到16966个差异表达基因,在三个时期分别有2073、2063、3121个上调基因,下调基因分别有1203、2700、5806个(见图1)。

图 1 病原菌和寄主不同时期差异表达基因
2.3 黑腐皮壳菌侵染苹果不同时期差异表达基因GO和KEGG富集分析
GO term用于整个转录组的功能分类,基于序列同源性将上调差异表达基因分成三个最基本类别:生物过程(biological process)、细胞成分(cellular component)、分子功能(molecular function)。病原菌侵染第3 d时,主要富集的生物过程有次级代谢产物合成、糖异生和碳水化合物代谢,水解酶类活性增强,KEGG表明碳代谢、丙酮酸代谢和甘油脂代谢得到了富集;侵染第6 d时,多糖代谢分解过程、果胶分解代谢过程为主要的生物过程,KEGG富集的代谢途径有:果糖和甘露醇代谢、芳香族化合物的降解和药物代谢(细胞色素P450);侵染第12 d时,GO term富集了视黄醇代谢过程、纤维素和果胶分解代谢过程和色素生物合成过程,KEGG富集的信号途径有抗坏血酸和醛酸代谢、苯丙酸生物合成和水杨酸代谢(见表2和表3)。
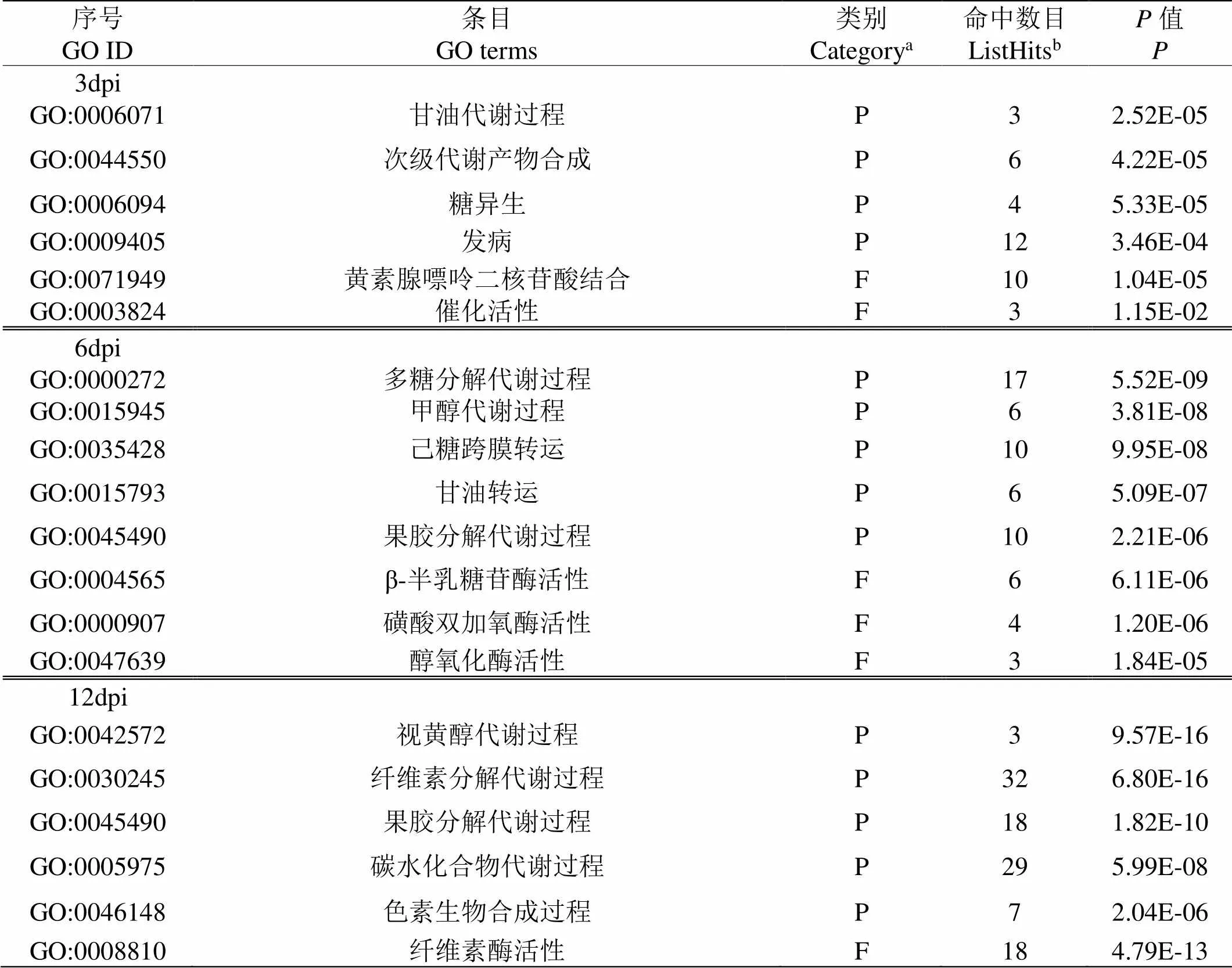
表 2 苹果黑腐皮壳菌侵染苹果不同时期的GO富集分类
aGO分类类别,“P”代表“生物过程”;“F”代表“分子功能”,b该GO条目中上调的差异基因数
aGO classification category, "P" stands for "biological process"; "F" stands for "molecular function";bthe number of differential genes up-regulated in GO term.

表 3 苹果黑腐皮壳菌侵染苹果不同时期KEGG富集分类
a该KEGG条目中上调的差异基因数。
aThe number of differential genes up-regulated in KEGG.
2.4 苹果枝干受病菌侵染不同时期差异表达基因GO和KEGG富集分析
被侵染期间苹果枝干组织与细胞壁修复和抗菌物质分泌的基因上调表达。侵染第3 d时,主要富集的生物过程有成纤维细胞化过程、调节对营养水平的反应、调节DNA模板转录对应激的反应和木质素生物合成过程,KEGG表明次级代谢产物合成、植物病原相互作用和植物激素信号传导等途径富集;侵染第6 d时,GO富集到了酚类化合物合成、对几丁质的反应和木质素生物合成过程;KEGG表明谷胱甘肽代谢、烟酸代谢、脂肪酸代谢以及MAPK信号通路富集;侵染第12 d时,GO表明半胱氨酸氧化、水杨酸分解代谢过程和细胞色素氧化酶富集,KEGG表明维生素B6代谢途径、戊糖和葡萄糖醛酸的相互转化和氨基酸代谢途径富集(见表4和表5)。

表 4 苹果枝干受病菌侵染不同时期GO富集分类
aGO分类类别,“P”代表“生物过程”;“F”代表“分子功能”;b该GO条目中上调的差异基因数。
aGO classification category, "P" stands for "biological process"; "F" stands for "molecular function";bthe number of differential genes up-regulated in GO term.
2.5 苹果黑腐皮壳菌与苹果互作机制分析
从上述表2~3可以看出,苹果黑腐皮壳菌接触苹果枝干时,与寄主互作和信号传导的代谢过程主要产生了植物细胞壁降解酶、有毒物质、生长调节剂等次级代谢产物。病原菌产生的果胶酶将寄主细胞胶层中的果胶多糖降解,纤维素酶对细胞壁中的纤维素有软化和分解作用,β-半乳糖甘酶促进细胞壁中乳糖降解成半乳糖和葡萄糖,加速细胞壁松弛,生成的葡萄糖通过代谢与转化为病原菌生理活动提供营养。毒素是病原菌主要的致病因子,大多数毒素作用于寄主叶绿体、质膜、线粒体和细胞膜外,使细胞膜透性改变,针对寄主植物产生的抗毒素物质,病原菌通过药物代谢外援物质、调整自身生理活动来应对。

表 5 苹果枝干受侵染不同时期KEGG富集分类
a该KEGG条目中上调的差异基因数。
aThe number of differential genes up-regulated in KEGG.
从上述表4~5可以看出,受到侵染后的苹果枝干的防御体系主要依靠防御酶的活性催化活动完成。过氧化物酶(POD)参与了木质素前体生物合成,加速自身伤口愈合和抑制病原菌水解酶的活性;苯丙氨酸解氨酶(PAL)参与催化酚类物质、类黄酮、木质素等次级代谢产物合成;多酚氧化酶(PPO)将酚类物质转化成醌类化合物起到解毒作用,阻碍病原菌进一步侵入;活性氧清除系统减少氧自由基和过氧化物的迫害作用,如过氧化物歧化酶(SOD)清除寄主体内的O2·-,产生大量过氧化氢(H2O2),最后被过氧化氢酶(CAT)分解。最后谷胱甘肽作为细胞内重要的调节代谢物质,含量降低,产生的氧自由基促使细胞发生凋亡。
3 结论与讨论
3.1 结论
本研究通过对不同侵染阶段的苹果黑腐皮壳菌与苹果枝干进行转录组测序,通过测序得到了186.21G的数据,GC含量均衡,Q30正确识别率高,与参考基因组比对率高,转录组数据质量高。
苹果黑腐皮壳菌在侵染过程中的生理功能主要表现为四个方面:降解寄主植物细胞壁、合成毒素物质、分解寄主抗病物质和调节营养水平。降解细胞壁的酶主要有果胶酶、纤维素酶、半纤维素和蛋白酶等。与果胶水解相关的基因在侵染的三个时期有很大差别。毒素作为病原菌产生的对寄主组织具有损伤破坏性的次级代谢产物,作用于寄主植物体内的不同位点,它的产生依靠丙酮酸代谢、脂肪酸代谢和芳香化合物合成等多种代谢途径,同时细胞色素酶P450代谢寄主植物分泌的抗菌物质。
苹果体内的氧自由基反应和脂质过氧化反应在病原菌侵染过程中膜脂发生过氧化,在寄主体内的氧自由基在脂氧合酶(LOX)的催化作用下生成的丙二醛(MDA)具有细胞毒性。病原菌的入侵诱导寄主体几丁质酶和葡聚糖酶的积累,抑制病原菌的生长。寄主受到病原菌侵染后,单酚类、类黄酮类、过氧化物酶、香豆素类物质迅速合成,抑制病菌孢子萌发和菌丝生长,香豆素是木质素的合成前体,过氧化物酶通过催化合成杀菌物质,提高合成木质素,从而形成苹果的抗病性。
3.2 讨论
本研究通过转录组初步分析了苹果黑腐皮壳菌与苹果枝干互作机制,与柯希望的结果相比各有异同,虽然发现了果胶酶、纤维素酶对寄主的细胞壁的降解作用,但是酶的种类与数量却有所差异。在柯希望的研究中用于转录组分析的组织为感染5 d后的苹果树枝,而本研究中选取了3、6、12 d 3个侵染时期的寄主为材料,包含整个侵染过程,对每个时期的代谢通路进行分析得到了病原菌中致病的转录因子,同时对被侵染的寄主进行转录组测序,本研究通过上述转录组分析发现了大量的差异表达基因,但这些基因所参与的代谢通路及其与其它相关基因的分子互作机制还需要深入解析,下一步将继续通过酵母双杂文库构建及其筛选等方法,解析病菌与寄主的分子互作机制,为苹果分子抗病育种寻找新的途径提供依据。
[1] 李保华,王彩霞,董向丽.我国苹果主要病害研究进展与病害防治中的问题[J].植物保护,2013,39(5):46-54
[2] Wang C, Li C, Li B,. Toxins produced byvar.and their relationship with pathogenicity [J]. Toxins, 2014,6:1139-1154
[3] Ke XW, Yin ZY, Song N,Transcriptome profiling to identify genes involved in pathogenicity ofon apple tree [J]. Fungal genetics and biology, 2014,68:31-38
[4] Ahn JH, Walton JD. A fatty acid synthase gene inrequired for production of HC-toxin, cyclo (D-prolyl-L-alanyl-D-alanyl-L-2-amino-9, 10-epoxi-8- oxodecanoyl) [J]. Molecular plant-microbe interactions, 1997,10(2):207-214
[5] Bolger AM, Lohse M, Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data [J]. Bioinformatics, 2014,30(15):2114-2120
[6] Kim D, Langmead B, Salzberg SL. HISAT: a fast spliced aligner with low memory requirements [J]. Nature methods, 2015,12(4):357-360
[7] Anders S, Pyl PT, Huber W. HTSeq--a Python framework to work with high-throughput sequencing data [J]. Bioinformatics, 2015,31(2):166-169
[8] A Roberts , Pimentel H, Trapnell C,. Identification of novel transcripts in annotated genomes using RNA-Seq [J]. Bioinformatics, 2011,27(17):2325-2329
[9] Ke XW, Huang L, Han Q,. Histological and cytological investigations of the infection and colonization of apple bark byvar.[J].Australasian plant pathology application, 2012,42(1):85-93
[10] Johnson RD, Johnson L, Itoh Y,. Cloning and characterization of a cyclic peptide synthetase gene fromapple pathotype whose product is involved in AM-toxin synthesis and pathogenicity [J]. Molecular plant-microbe interactions, 2000,13:742-753
[11] Kanehisa M, Araki M, Goto S,. KEGG for linking genomes to life and the environment [J]. Nucleic acids research, 2008,36(1):480-484
Transcriptome Analysis during Apple Stem Infected by
JIN Ji-yang1, DIAO Yu-fei1, YU Cheng-ming1, XIONG Xiong1, ZHAO Tao2, HE Bang-ling1*, LIU Hui-xiang1*
1.271018,2.271027,
s:Apple Valsa canker caused byis one of the most serious diseases in apple producing areas in China. Understanding the gene expression of pathogen infected host at different periods is helpful to find out pathogenic mechanism of the pathogen infection and resisting mechanism of host plant. This paper mainly using Illumina platform to sequence the transcriptome of pathogen and host during infection of, and compare with the uninfected pathogen and host, 4092 differential expressed genes from pathogen and 16966 differential expressed genes from host were obtained. Go and KEGG analysis of the up-regulated differential expressed genes in the three periods were carried out respectively. The results showed that degradation of host cell wall, synthesis of toxin, decomposition of anti toxin and self nutrition regulation during the pathogen infection process, and the host mainly resisted the invasion of pathogen through membrane lipid peroxidation, active oxygen scavenging enzyme and defense enzyme. All results above explained the biological process of interaction between theand host, and provided a basis for probing molecular interaction mechanism between pathogen and apple.
Apple valsa canker disease;; infection process; transcriptome analysis
S436.629
A
1000-2324(2021)02-0187-07
10.3969/j.issn.1000-2324.2021.02.005
2020-02-12
2020-05-04
山东省自然基金项目(ZR2017MC042);国家自然基金项目(31770684)
靳纪洋(1995-),男,硕士研究生,主要从事林果病原与寄主互作机制研究. E-mail:869270039@qq.com
Author for correspondence. E-mail:hebangling@126.com; hxliu722@126.com

