利拉鲁肽联合二甲双胍对2型糖尿病患者胰岛素抵抗及氧化应激的影响
牛 瑶,翁孝刚
(新乡医学院第三附属医院内分泌科,新乡 453000)
2型糖尿病多发于成人,其确切的病因和发病机制目前不明确,且其显著的病理生理学特征为胰岛素调控葡萄糖代谢能力下降(胰岛素抵抗)伴随胰岛β细胞功能缺陷所导致的胰岛素分泌减少(或相对减少)。我国2型糖尿病的发病率逐年上升,若无及时有效的干预,将导致视网膜病变、糖尿病足等多种并发症,甚至死亡,严重危害患者生命健康[1-2]。临床上,通过控制饮食、运动并联合药物治疗,可有效控制2型糖尿病病情发展,如吡格列酮、格列美脲、二甲双胍、阿卡波糖等[3]。但由于糖尿病致病因素复杂,长期服药患者依从性较差、饮食运动控制差,药物治疗效果常常不理想。因此,探寻对2型糖尿病血糖、胰岛素控制更安全有效的药物意义重大。利拉鲁肽属人胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)类似物,半衰期长、毒性小,被证明可通过减轻饥饿感和能量摄入降低体重,控糖效果较好[4-5]。近年有研究发现[6-7],氧化应激反应与糖尿病发展密切相关。基于此,本研究旨在探究皮下注射利拉鲁肽对2型糖尿病患者血糖控制、胰岛素抵抗及氧化应激水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月~2019年10月本院收治的180例2型糖尿病患者为研究对象,采用随机数字表法分为对照组和观察组,每组90例。两组一般资料比较无统计学差异(P>0.05),具有可比性,见表1。本研究经本院医学伦理委员会审批通过。
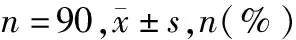
表1 两组一般资料比较
纳入标准:① 符合2型糖尿病诊断标准者[8]。② 知情并同意参与本项研究者。
排除标准:① 合并严重肝肾功能障碍者。② 合并酮症酸中毒者。③ 合并甲状腺、胰腺疾病者。④ 合并严重精神疾病或智力障碍者。⑤ 近1个月内有中药或利拉鲁肽治疗史者。⑥ 妊娠或哺乳期妇女。
1.2 治疗方法
两组均行饮食运动管理。对照组予以盐酸二甲双胍片(中美上海施贵宝制药有限公司,国药准字H20023370,规格0.5 g)治疗,随餐服用,每次0.5 g,tid;观察组在对照组基础上加用利拉鲁肽注射液[(Novo Nordisk A/S公司,国药准字J20160037,规格3 ml∶18 mg(预填充注射笔)]治疗,皮下注射,qd,初始剂量每次0.6 mg,1周后增加剂量至每次1.2 mg。两组均连续治疗3个月。
1.3 观察指标
① 血糖控制使用葡萄糖氧化酶法检测并比较两组治疗前后空腹血糖(fasting blood glucose,FPG)和餐后2 h血糖(postprandial 2 h blood glucose,2hPG),使用高效液相层析法检测HbA1c,以评价血糖控制水平。② 稳态模型胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR)、稳态模型胰岛β细胞功能指数(homeostasis model assessment-β,HOMA-β)及稳态模型胰岛素敏感指数(homeostasis model assessment-insulin sensitivityindex,HOMA-ISI)。使用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定两组治疗前后空腹胰岛素(fasting insulin,FINS)含量,并以化学发光法计算HOMA-IR=FPG×FINS/22.5,HOMA-β=20×FINS/(FPG-3.5),HOMA-ISI=l/(FPG×FINS)。③ 氧化应激水平检测并比较两组治疗前后血清丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GSH-Px)、超氧化物歧化酶(superoxidedismutase,SOD)、8-异前列腺素(8-iso-prostaglandin F2α,8-iso-PGF2α)含量,硫代巴比妥酸法检测MDA,比色法检测GSH,黄嘌呤氧化酶法检测SOD,ELISA法检测8-iso-PGF2α,试剂盒均由美国R&D生产。④ 观察并记录两组治疗期间不良反应发生情况。
1.4 统计学方法
2 结果
2.1 两组血糖控制及BMI变化比较
治疗前,两组FPG、2hPG、HbA1c、BMI比较无统计学差异(P>0.05)。治疗后,两组FPG、2hPG、HbA1c下降(P<0.05),且观察组各指标含量低于对照组(P<0.05);治疗后观察组BMI下降,且较对照组更低(P<0.05)。见表2。
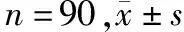
表2 两组治疗前后血糖水平比较
2.2 两组胰岛功能指标比较
治疗前,两组HOMA-IR、HOMA-β、HOMA-ISI指数比较无统计学差异(P>0.05)。治疗后,两组HOMA-IR指数下降,HOMA-β、HOMA-ISI指数升高(P<0.05);观察组较对照组HOMA-IR指数更低,HOMA-β、HOMA-ISI指数更高(P<0.05)。见表3。
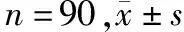
表3 两组治疗前后胰岛抵抗、分泌、敏感、指数比较
2.3 两组氧化应激水平比较
治疗前,两组血清MDA、GSH-Px、SOD、8-iso-PGF2α含量比较无统计学差异(P>0.05)。治疗后,两组GSH-Px、SOD含量上升,MDA、8-iso-PGF2α含量下降(P<0.05);观察组较对照组GSH-Px、SOD含量更高,MDA、8-iso-PGF2α含量更低(P<0.05)。见表4。
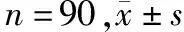
表4 两组治疗前后氧化应激水平比较
2.4 两组不良反应发生率比较
两组治疗期间均无因明显药物不良反应而退出的患者。观察组药物不良反应总发生率(10.00%)高于对照组(6.67%),但两组组间比较无统计学差异(P>0.05)。见表5。
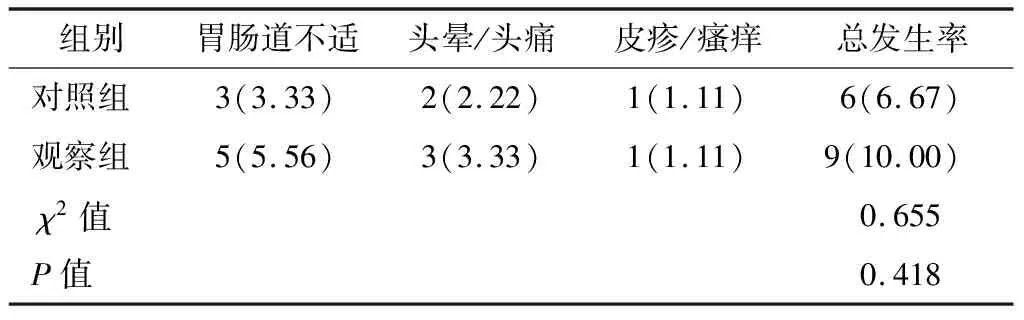
表5 两组治疗期间不良反应发生率比较 n=90,n(%)
3 讨论
2型糖尿病是由遗传及环境因素共同作用引发,属慢性代谢性疾病,临床上以持续的高血糖水平为主要特征,其慢性并发症可遍及全身重要器官,严重影响患者生命质量。临床上可通过药物治疗控制疾病进展,但糖尿病为终生疾病,需持续治疗。患者依从性较差,且发病机制复杂,部分患者以胰岛素抵抗为主,常出现血糖控制效果不佳,预后较差。研究发现[9],降低氧化应激水平可有效控制糖尿病及其并发症的发生和发展。因此,探寻对2型糖尿病血糖、胰岛素、氧化应激反应调节效果更好的药物有临床价值。
利拉鲁肽属GLP-1类似物,血浆半衰期长、注射给药生物利用度高,每日仅需给药1次,且与人GLP-1序列同源性高(97%),几乎无遗传、生殖、致癌等毒性,安全性较高[10]。GLP-1是一种肠源性激素,一方面利拉鲁肽可同人GLP-1受体结合并激活GLP-1受体(GLP-1R),促进胰腺β细胞分泌胰岛素;另一方面,利拉鲁肽可呈葡萄糖浓度依赖模式,抑制胰高血糖素过多分泌,同时调节胰岛素与胰高血糖素分泌,调节血糖平衡。已有研究表明[11],利拉鲁肽对2型糖尿病肥胖患者血糖、BMI控制效果好,并可缓解氧化应激状态。本研究发现,与对照组相比,治疗后观察组FPG、2hPG、HbA1c水平更低,且两组治疗期间药物不良反应发生率比较无统计学差异,表明皮下注射利拉鲁肽对2型糖尿病患者血糖控制效果良好,安全性较好。
胰岛素抵抗是2型糖尿病患者发病的主要病因之一,由机体对胰岛素(內源分泌或外源注射)反应下降的异常生理状态造成,肥胖是其主要致病因素。临床上对原发性或遗传性胰岛素抵抗尚无特效疗法,但可通过药物控制血糖联合饮食控制、规律运动,降低体重、减轻胰岛素抵抗[12]。传统糖尿病治疗药物着重于血糖控制效果,对肥胖型胰岛素抵抗患者效果甚微。GLP-1R分布广泛,Mate分析显示,GLP-1R受体激动剂(如利拉鲁肽)具有减肥适应症,可有效减轻体重[13],其可通过刺激GLP-1R增加饱腹感/降低饥饿感来降低能量摄入、抑制胃排空等多重作用减轻体重[14-15]。本研究发现,治疗后观察组BMI低于对照组,且观察组较对照组HOMA-IR指数更低,HOMA-β、HOMA-ISI指数更高,表明皮下注射利拉鲁肽可有效降低2型糖尿病患者BMI、缓解其胰岛素抵抗、调节胰岛β细胞分泌、提高胰岛素敏感性。
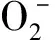
综上所述,皮下注射利拉鲁肽联合二甲双胍对2型糖尿病患者疗效良好且安全性较好,可有效控制血糖、降低MBI、缓解胰岛素抵抗、改善胰岛β细胞分泌、提高胰岛素敏感性、抑制氧化应激水平,且安全性良好。

