基于铱纳米棒的电致化学发光生物传感器用于多巴胺检测
杜钦芝,杨国敏,陈时洪*
(1.重庆市第八中学校,重庆 400030;2.西南大学 化学化工学院,重庆 400715)
多巴胺(DA)作为控制人体新陈代谢、中枢神经、心血管、激素和肾系统的重要神经递质,其浓度水平的变化与诸如阿尔茨海默症、精神分裂症、帕金森病等神经系统疾病直接相关[1-2]。现已采用多种分析技术来检测DA,包括比色法[3]、荧光法[4]、表面等离子体共振法[5]、电化学法[6]、光化学分析法[7]等。然而,上述方法操作过程较为复杂,或仪器设备昂贵,或耗时较长。因此建立一种简便快捷、成本低、灵敏度高、可控性好的分析方法测定DA尤为重要。
近年来,电致化学发光(ECL)已成为临床、环境、药物及食品等领域的一种常用分析技术。电化学和化学发光的巧妙结合,使得ECL具有简单、快捷、高灵敏及高可控性等优点[8-9]。基于此,ECL可作为DA检测的理想选择。如Tian等[10]以钌(Ⅱ)配合物为发光物质构建ECL传感器,借助DA对Ru(Ⅱ)的猝灭作用,实现了对DA的灵敏检测。Zhao等[11]基于铜纳米簇(Cu NCs)构建ECL生物传感器以检测DA。Wang等[12]设计合成聚合物点(Pdots),以其为ECL探针用于DA检测。尽管各种ECL材料用于DA检测已取得较好效果,但开发更多的ECL发光材料,并将其用于DA分析是必要的。
铱(Ⅲ)配合物作为一种新型的ECL发光材料,因具有化学和光稳定性高,偏振光强度高,斯托克斯位移大及可通过调节环金属配体和辅助配体实现发光颜色及波长的调控等优点,而受到越来越多的关注[13-15]。但由于Ir(Ⅲ)配合物的水溶性差[16],因此检测一般需在乙腈及二甲基亚砜等有毒的有机溶液中进行。例如,Park等[17]以环金属铱配合物为ECL发光体,在乙腈-二甲基亚砜溶液中实现了对硫化氢的检测。Qian 等[18]制备了铱配合物为ECL探针,在二甲基亚砜-磷酸缓冲溶液中实现对酸性pH值的检测。Han等[19]设计合成含二茂铁的环金属铱配合物信号探针,在乙醇-磷酸缓冲溶液中检测次氯酸盐(ClO-)。Ir(Ⅲ)配合物差的水溶性极大限制了其在生物分析领域中的应用。因此,改善Ir(Ⅲ)配合物的水溶性,以扩展其在ECL领域的应用具有重要价值。目前,以水溶性官能团如磺酸基团、羧基、糖基以及双环金属化水合物将辅助二亚胺配体功能化是提高Ir(Ⅲ)配合物水溶性的常见策略[20-21]。如Kiran等[22]以4,7-二苯基-1,10-菲咯啉二磺酸盐为配体合成Ir(Ⅲ)配合物,以显著增加Ir(Ⅲ)配合物在水中的溶解度。Xia等[21]将羧基引入β-乙酰丙酮中并作为辅助配体,合成了水溶性良好的环金属化铱(Ⅲ)配合物。但上述方法操作繁琐,因此有必要寻找一种简便策略以改善Ir(Ⅲ)配合物的水溶性。
本文将三(2-苯基吡啶)铱(Ⅲ)(Ir(ppy)3)用聚(苯乙烯-马来酸酐)(PSMA)羧基功能化以合成水溶性铱纳米棒(Ir NDs)。在共反应试剂三丙胺(TPrA)存在下,Ir NDs 表现出优良的ECL性能。以Ir NDs修饰电极制备传感器,借助DA对Ir NDs-TPrA体系ECL发射的高效猝灭作用,实现了对DA的高灵敏检测。该研究不仅扩展了Ir(Ⅲ)配合物在ECL传感领域的应用,亦为DA的检测提供了新方法。
1 实验部分
1.1 仪器与试剂
MPI-E型电致化学发光分析系统(西安瑞迈分析仪器有限公司);CHI600D型电化学工作站(上海辰华仪器有限公司);Lambda 17紫外可见光谱仪(美国 PerkinElmer公司);Nicolet 6700傅里叶变换红外光谱仪(美国FEI公司);Talos 200S透射电子显微镜(美国FEI公司);ECL 发射光谱仪(上海辰华的CHI 760E 与日本东京安道尔公司的Newton EMCCD 光谱检测器组合);Escalab 250XiX光电子能谱仪(美国热电公司)。
三(2-苯基吡啶)铱(Ir(ppy)3)(ADS 染料源公司,加拿大魁北克);聚(苯乙烯-马来酸酐)(PSMA,平均分子量为1 700,苯乙烯含量68%);盐酸多巴胺(98%)、尿酸(99%,UA)(上海阿拉丁公司);精氨酸(L-Arg)、甘氨酸(Gly)、葡萄糖(一水)(Glu)、抗坏血酸(AA)(成都市科龙化工有限公司);去甲肾上腺素(NA,上海麦克林生化科技有限公司);三丙胺(TPrA,上海梯希爱化成工业发展有限公司);四氢呋喃(THF,上海泰坦科技有限公司);磷酸缓冲溶液(PBS,用0.10 mol/L Na2HPO4,0.10 mol/L KH2PO4和0.10 mol/L KCl配制);以上试剂均为分析纯,实验过程中均使用超纯水。
1.2 Ir NDs的合成
通过纳米沉淀法制备Ir NDs:将2.0 mg Ir(ppy)3和1.0 mg PSMA分别溶于2.0 mL和1.0 mL THF中,于室温下超声4 h后分别制得质量浓度均为1.0 mg/mL的储备溶液A和B。将溶液B注入溶液A中,继续超声2 h后,在超声处理下将上述混合溶液快速注入20.0 mL水中,随后在75 ℃下搅拌以除去THF,最终得到0.1 mg/mL的Ir NDs分散液。上述整个超声过程应避光处理。
1.3 传感器的构建
玻碳电极(GCE,直径4.0 mm)依次用0.3 μm和 0.05 μm的氧化铝粉末抛光,再用乙醇和水交替进行超声清洗。待GCE自然晾干后,在其表面滴涂10.0 μL Ir NDs分散液,室温下晾干制得传感器,其制备过程如图1所示。

图1 传感器的制备及响应机理Fig.1 Schematic description of the preparation and response of the ECL biosensor
1.4 检测方法
采用三电极体系进行测试:修饰的GCE为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极。以含有0.75 mmol/L TPrA 的3.0 mL PBS(0.10 mol/L,pH 7.4)为检测底液,进行ECL信号采集。设置电位扫描范围为0.0~1.2 V,光电倍增管(PMT)为800 V。在3.0 mL 5.0 mmol/L的铁氰化钾溶液(K3[Fe(CN)6]/K4[Fe(CN)6])中进行循环伏安(CV)及电化学阻抗(EIS)测定。
2 结果与讨论
2.1 Ir NDs的表征
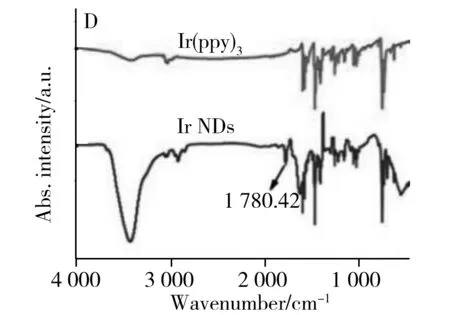
以透射电子显微镜(TEM)表征Ir NDs的形貌。如图2A所示,Ir NDs呈现长度为204~1 158 nm的棒状结构。由长度分布图(图2B)可知,Ir NDs的平均长度为543 nm。同时,对Ir NDs的ECL光谱进行测定,可观察到其在575 nm处发光(图2C)。图2D为Ir(ppy)3和Ir NDs的红外光谱(IR)。与未羧基化的Ir(ppy)3相比,Ir NDs在1 780.42 cm-1处出现一新的吸收峰,其为—COOH的特征吸收峰。接着,对Ir(ppy)3和Ir NDs的紫外可见光谱(UV-Vis)进行测定,结果显示Ir(ppy)3的特征吸收峰位于377 nm,经过羧基化后得到的Ir NDs,其吸收峰红移至388 nm(图2E),这可能是因为Ir NDs分子通过π-π 相互作用聚集而引起。最后,测试了Ir NDs的X光电子能谱(XPS)。如图2F所示,可明显观察到Ir4f(61.19 eV)、O1s(532.57 eV)、N1s(399.51 eV) 和 C1s(284.74 eV)的特征峰。以上测试结果证明Ir(ppy)3已被羧基化而成功制备为Ir NDs。

2.2 传感器构建过程的表征
在5.0 mmol/L铁氰化钾(K3[Fe(CN)6]/K4[Fe(CN)6])溶液中进行CV及EIS测定,在含0.75 mmol/L TPrA 的PBS(0.10 mol/L,pH 7.4)中进行ECL测试,以对传感器的构建过程进行表征。
CV表征结果如图3A所示,裸电极的氧化还原峰电流值较大(曲线a)。当Ir NDs修饰于电极表面后,氧化还原峰电流减小(曲线b),这是由于纳米材料阻碍了氧化还原探针[Fe(CN)6]3-/4-的电子传递。EIS表征结果示于图3B中。可见,裸电极显示出小的半圆直径,说明裸电极上(曲线a)电子传输阻力小。Ir NDs修饰电极的EIS曲线的半圆直径显著增大,说明氧化还原探针与电极表面之间的电子传递受到Ir NDs阻碍,阻抗值增大。综上,EIS与CV表征结果一致,表明该生物传感器已成功制备。
为进一步证明传感器的成功构建,在含有0.75 mmol/L TPrA的PBS缓冲溶液(0.10 mmol/L,pH 7.4)中对传感器进行ECL测试。如图4所示,在裸电极(曲线a)上几乎未检出任何ECL信号,这是因为此时无发光物质存在。当在电极上修饰 Ir NDs后(Ir NDs/GCE,曲线b),可在1.2 V处观察到强的ECL发射,表明在共反应试剂TPrA存在下,Ir NDs展现出好的ECL性能。为了证明DA对Ir NDs中ECL的猝灭作用,在含有4.0×10-4mol/L DA的底液中,对其ECL信号进行测试。结果如曲线c所示,传感器的ECL信号明显降低。根据文献报道[13],ECL机理可能为:在1.2 V电压下,Ir NDs被氧化为Ir NDs+·(式1),TPrA被氧化为TPrA+·(式2);Ir NDs+·与TPrA+·反应,生成激发态的Ir NDs*(式3);Ir NDs*回到Ir NDs时产生ECL信号(式4)。关于DA猝灭四苯乙炔基共轭微孔聚合物的ECL发射的机理已有报道[23],据此推测,在本体系中,DA的氧化产物如亮多巴胺铬、多巴胺铬、5,6-二羟基吲哚和5,6-吲哚醌等与Ir NDs*可发生能量转移而导致Ir NDs的ECL发射受到抑制。


图4 0.75 mmol/L TPrA溶液中,裸GCE(a)及Ir NDs/GCE在加入4.0×10-4 mol/L DA前(b)后 (c)的ECL曲线Fig.4 ECL curves of bare GCE(a),Ir NDs/GCE without(b) and with(c) 4.0×10-4 mol/L DA 0.10 mol/L PBS(pH 7.4) containing 0.75 mmol/L TPrA,scan range:0-1.2 V
(1)

(2)

(3)

(4)
(P代表TPrA的反应产物)
2.3 实验条件的优化
2.3.1 TPrA用量的优化研究了共反应试剂TPrA浓度对ECL信号强度的影响。在3.0 mL含有不同浓度(0.25、0.50、 0.75、1.00、1.25 mmol/L)TPrA的PBS缓冲溶液(0.10 mol/L,pH 7.4)中,对修饰了10.0 μL Ir NDs分散液的电极的ECL响应进行测试。当TPrA浓度从0.25 mmol/L增加到0.75 mmol/L,Ir NDs修饰电极的ECL信号强度逐渐增大。当浓度达到1.0 mmol/L时,ECL信号强度已超过仪器检测量程,为确保实验的准确度,本实验选择TPrA的最佳浓度为0.75 mmol/L。
2.3.2 Ir NDs修饰量的优化为进一步探究Ir NDs修饰量对生物传感器ECL信号强度的影响,在3.0 mL含有0.75 mmol/L TPrA的PBS 缓冲溶液(0.10 mol/L,pH 7.4)中,测试了电极在修饰不同量(4.0、6.0、8.0、10.0、12.0、14.0 μL)Ir NDs情况下的ECL响应。结果显示,当Ir NDs修饰量由4.0 μL增至10.0 μL时,Ir NDs的ECL信号强度逐渐增加。当Ir NDs修饰量达到12.0 μL时,ECL信号强度已超出仪器的检测量程。为保证检测的准确度,本实验选择10.0 μL Ir NDs 作为传感器的最佳修饰量。
2.4 传感器对DA的响应
在最佳实验条件下,探究该生物传感器对DA的响应情况。如图5A所示,随着DA浓度的增加,Ir NDs的ECL强度下降。结果表明,DA浓度在2.0×10-8~4.0×10-4mol/L范围内,ECL信号与DA浓度的对数呈良好的线性关系,其线性方程为I=-1 927.9 lgc-2 725.7(I为ECL信号强度,c为DA的浓度),相关系数(r)为 0.993 4,检出限(S/N=3)为6.3×10-9mol/L。将该方法与所报道的其他检测DA的方法进行比较,如表1所示。本文所构建的传感器具有较宽的线性范围和较低的检出限。
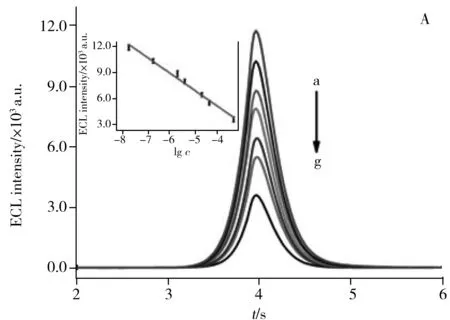

表1 检测DA的不同方法比较Table 1 Comparisons of different methods for DA detection
2.5 传感器的稳定性、重现性及选择性
为检测该传感器的稳定性,在3.0 mL含有0.75 mmol/L TPrA和0.2 μmol/L多巴胺的PBS缓冲液中,对所构建的传感器进行测试。连续扫描10圈,其ECL信号值的相对标准偏差(RSD)为 1.7 %,表明该生物传感器的稳定性良好。为探究该传感器的重现性,使用同一批次和不同批次制备的4只传感器对含有4.0×10-4mol/L DA的溶液进行批内和批间重复性测试,获得相应的RSD分别为2.8%和1.4%,表明该传感器具有良好的重复性。为评估该传感器的选择性,以葡萄糖(Glu)、尿酸(UA)、抗坏血酸(AA)、精氨酸(L-Arg)、甘氨酸(Gly)、K+和去甲肾上腺素(NA)为干扰物质,控制干扰物质的浓度为2.0 μmol/L(为DA浓度的10倍),测试了传感器的选择性。结果如图5B所示,除NA以外,其余物质对DA的响应无干扰,其ECL响应几乎与空白值相同。而0.2 μmol/L DA存在时,ECL响应显著下降。实验结果表明,该传感器对NA与DA均具有好的响应,而对测试的其余物质无响应,可能的原因在于:(1)NA与DA结构相似,均属于儿茶酚胺类物质,具有邻苯二酚结构,该结构易被氧化成苯醌,对Ir NDs信号起到猝灭作用;(2)Ir NDs被羧基功能化,带负电荷,可以通过静电作用吸附带正电的DA与NA,利于传感器对二者的ECL响应。

表2 人体血清中DA的回收率Table 2 Recoveries of DA in human serum samples
2.6 实际样品的检测
为评估所构建的ECL传感器的实际应用能力,对人体血清样品进行加标回收。在稀释了50倍的人体血清样品中分别加入4.00、 20.0、 100 μmol/L的DA,并用所构建的ECL传感器进行检测。测定结果如表2所示,实际样品的回收率为97.5%~106%,3次测定的RSD均在5.0%以内。表明该传感器具有良好的实际应用潜力。
3 结 论
本文采用PSMA将Ir(ppy)3羧基功能化以制备具有优良ECL性能的水溶性Ir NDs,并基于Ir NDs构建ECL生物传感器,借助DA对Ir NDs-TPrA体系 ECL信号的高效猝灭作用实现了对DA的高灵敏检测。羧基功能化的Ir NDs为铱(Ⅲ)配合物在ECL领域的应用提供了理想的平台,也为DA的检测提供了新方法。

