阻塞性睡眠呼吸暂停综合征患者发生嗅觉功能障碍的影响因素分析
高吉 龚哲 陈菊萍
阻塞性睡眠呼吸暂停综合症 (obstructive sleep apnea syndrome, OSAS)是指以在睡眠中混乱打鼾以及呼吸道重复性阻塞为主要特点的睡眠呼吸疾病,常伴有晨起头痛、日间疲倦嗜睡、精神涣散、情绪过激以及记忆力退减等症状,不但影响患者的睡眠,还会累及心血管系统,严重者导致猝死[1]。在我国,OSAS 的发病率约为4%,且好发于中老年人,随着年龄的增加而增加[2]。我们临床发现,越来越多OSAS患者会发生嗅觉障碍。嗅觉功能障碍是指嗅觉功能部分或全部下降、异常或丧失,临床表现为嗅觉减退、嗅觉倒错、幻嗅、嗅觉缺失、嗅觉丧失以及嗅觉刺激敏感性增加等[3]。嗅觉障碍会导致患者食欲下降、营养不良、社会交流障碍、焦虑抑郁等,大大降低患者的生活质量[4]。目前OSAS 导致嗅觉功能障碍的机制尚不明确,可能与嗅球体积改变、中枢神经系统受损等因素影响[1]。本研究回顾性分析OSAS 患者的临床资料,旨在找出OSAS 患者发生嗅觉功能障碍的影响因素,为防治嗅觉功能障碍提供参考。现将结果报道如下。
资料与方法
1 一般资料
回顾性分析2017 年1 月~2019 年6 月因OSAS到我院治疗的168 例患者临床资料。纳入标准:①符合OSAS 的临床诊断标准[5];②进行嗅觉功能测试;③进行多导睡眠呼吸监测;④临床资料完整;⑤具有嗅上皮组织病理检查者;⑥患者均签署知情同意书。排除标准:①由其他疾病引起睡眠障碍者;②先天性失嗅;③既往史合并其他影响嗅觉疾病者;④有鼻腔咽喉部手术史者。
2 方法
2.1 多导睡眠呼吸监测
采用多导睡眠脑电监测系统(澳大利亚Compumedics Greal 系列)对患者进行夜间7 小时监测,检查当天禁止服用催眠药、镇静剂、咖啡因以及饮酒,同步监测口鼻气流、胸腹式呼吸、鼾声、脉搏、血氧饱和度、体位、眼动图、颏肌电图、脑电图以及心电图等参数。呼吸暂停、低通气等皆采用美国医学会睡眠及其相关判读手册[6]的标准进行判断。呼吸暂停低通气指数(AHI)≥5 次/小时,并且阻塞性睡眠呼吸暂停为主为OSAS,监测数据先采用电脑自动分析,然后人工进行校正。
2.2 嗅觉功能测试
采用 Sniffin’Stick 嗅觉测试笔进行评估[7],测试内容为:①嗅阈(odor threshold,T):在 16 支测试笔中装进逐级递减稀释的不同浓度的正丁醇,标记1~16 个等级,将患者闻到的浓度级别标记为其阈值分数;②气味区分(odor distinction,D):在 3 支测试笔中,2 支注入生理盐水,另外1 支为嗅阈的16 支测试用笔,总共进行16 次不同浓度的测试,答对总个数为其评分;③气味辨别(odor identification,I):16 种不同气味给予患者辨别,答对总个数为其评分。TDI 评分为以上3 项总和,<16 分表示嗅觉功能丧失,16~28 表示嗅觉功能减退,>28 分表示嗅觉功能正常。
2.3 研究分组
根据《嗅觉障碍诊断和治疗专家共识(2017年)》[8]对所有患者进行判断,将TDI 值≥28 分为正常组,其他为障碍组。其中老年的年龄分段为≥50岁。
2.4 收集资料
收集所有患者的年龄、性别、体重指数(BMI)、文化程度、病程、打鼾强度、嗅上皮病理改变、嗅球体积、鼻腔容积(V0-5、V2-5)、鼻腔最小截面积(MCA)、AHI、最低血氧饱和度(LSaO2)、Epworth 嗜睡量表(ESS)评分等临床资料。
3 嗅上皮病理检查
患者在术中取0.5cm×0.5cm 大小的嗅区组织一片,切片厚约3μm,采用4%多聚甲醛进行固定,用嗅觉正常的样本为对照,将所有患者的样本进行伊红染色,观察其上皮厚度,嗅细胞、基底细胞、支持细胞的核层结构以及嗅细胞数量,再进行半定量分析;将嗅细胞无减少、厚度正常;嗅细胞、基底细胞和支持细胞的核层结构良好的定为无嗅上皮病理改变;将嗅细胞减少、嗅上皮萎缩、呼吸上皮化生等记为嗅上皮病理改变[9]。
4 统计学方法
应用SPSS 22.0 软件对本研究数据进行分析及处理,分类资料用率(%)表示,用卡方(χ2)检验;定量资料用()表示,用 t 检验。相关性因素采用单因素分析,并通过ROC 曲线下面积(area under the cure, AUC)获取相关影响因素的最佳截断值;以二元logistic 回归分析OSAS 患者发生嗅觉功能障碍的危险因素。以P<0.05 表示差异有统计学意义。
结果
1 OSAS 患者发生嗅觉功能障碍的单因素分析
正常组113 例(67.26%),障碍组55 例(32.74%),其中青年4 例,中年15 例,老年36 例;正常组的年龄、嗅上皮病理改变、嗅球体积、AHI、ESS 与障碍组对比,差异有统计学意义(P<0.05);正常组的性别、BMI、文化程度、打鼾强度、病程、V0-5、V2-5、MCA、LSaO2与障碍组对比,差异无统计学意义(P>0.05),见表1。

表1 OSAS 患者发生嗅觉功能障碍的单因素分析

因素 正常组(例=113) 障碍组(例=55) χ2/t P≥24 24(21.24) 12(21.82) 0.073 0.964文化程度小学 16(14.16) 9(16.36)初中 63(55.75) 35(63.64)高中及其以上 34(30.09) 11(20.00) 1.921 0.383打鼾强度(d)<50 23(20.35) 13(23.64)50~60 68(60.18) 34(61.82)>60 22(19.47) 8(14.55) 0.705 0.703病程(年)<2 45(39.82) 23(41.82)≥2 68(60.18) 32(58.18) 0.061 0.805嗅上皮病理改变是48(42.48) 36(65.45)否65(57.52) 19(34.55) 7.812 0.005嗅球体积(mm3) 62.17±10.28 31.45±5.47 20.762 <0.001 V0-5(cm3) 4.99±1.45 4.93±1.43 0.253 0.801 V2-5(cm3) 3.12±1.04 3.15±1.01 0.177 0.860 MCA(cm2) 0.39±0.12 0.38±0.11 0.521 0.603 AHI(次/h)12.45±3.4826.18±5.6219.441<0.001 LSaO2 0.62±0.23 0.71±0.25 2.313 0.022 ESS(分) 8.14±2.41 12.15±3.21 6.821 <0.001
2 嗅球体积、AHI、ESS 预测 OSAS 患者发生嗅觉功能障碍风险的ROC 曲线分析
嗅球体积、AHI、ESS 预测 OSAS 患者发生嗅觉功能障碍的 AUC 面积分别为 0.707、0.755、0.664,三个指标均具有较高的灵敏度和特异性,见图1 与表2。
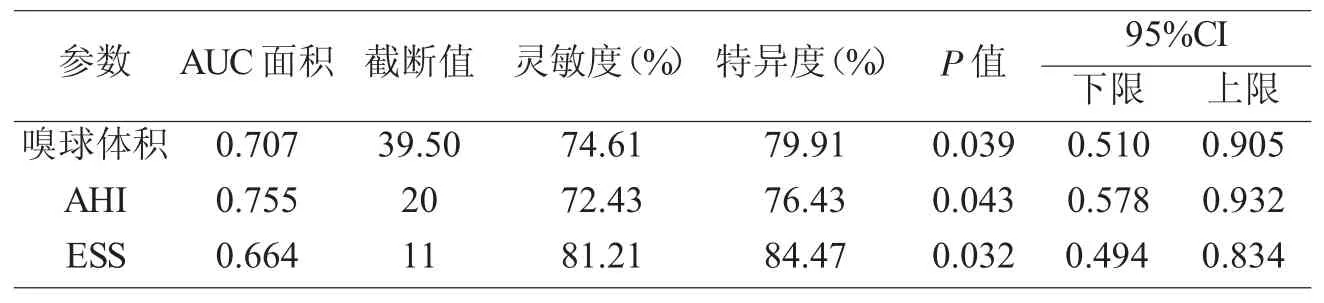
表 2 嗅球体积、AHI、ESS 指标的 ROC 曲线分析结果

图 1 嗅球体积、AHI、ESS 预测 OSAS 患者发生嗅觉功能障碍风险的ROC 曲线分析
3 OSAS 患者发生嗅觉功能障碍的多因素logistic 回归分析
以表1 分析中具有统计学意义的项目(年龄、嗅上皮病理改变、嗅球体积、AHI、ESS)为自变量,并结合表2 截断值,进行相关赋值,见表3。Logistic 回归分析显示:年龄≥50 岁、嗅上皮病理改变、嗅球体积<39.50mm3、AHI>20 次/h、ESS≥11 分是 OSAS 患者发生嗅觉功能障碍的独立危险因素,差异有统计学意义(P<0.05)。见表 4。

表3 影响OSAS 患者发生嗅觉功能障碍的因素与赋值
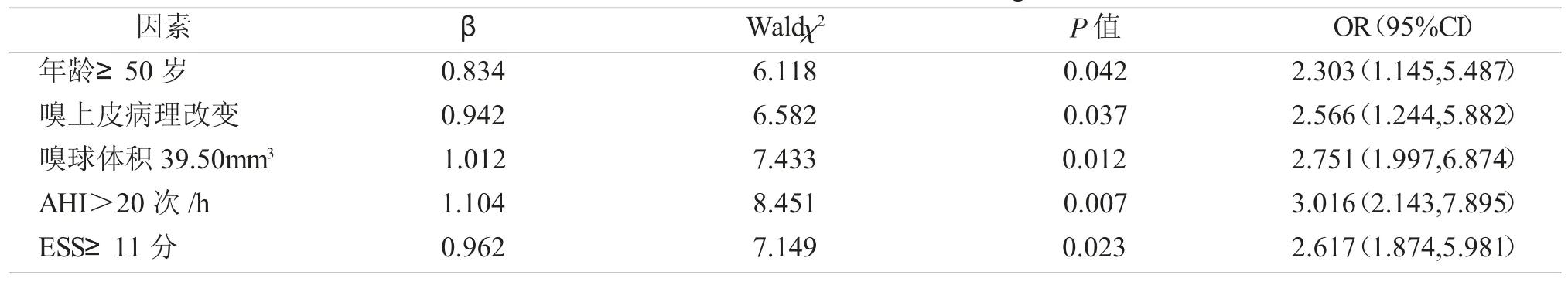
表4 影响OSAS 患者发生嗅觉功能障碍的多因素logistic 回归分析
讨论
嗅觉是人类五种基本生理感觉之一,其形成过程复杂,随着身体的生长发育,除嗅神经以外,舌咽神经、迷走神经、三叉神经等共同参与,且与个体的习惯、爱好、阅历等息息相关,因此嗅觉也会影响个体的心理、生理发展[10]。据报道,全球嗅觉障碍的发病率可高达22%[11]。导致嗅觉功能障碍的因素众多,如癫痫、鼻息肉、鼻塞、上气道感染、中风、抑郁、听力障碍等,其中鼻-鼻窦疾病占到全部病因的7%~56%[12],上呼吸道感染18%~45%[13],头颅外伤8%~20%[14]。本研究显示,OSAS 患者嗅觉功能障碍的发生率为32.74%,相对较高,可能与本研究的中老年的患者较多、饮食结构变化以及生活习惯的改变有关。OSAS 患者引发嗅觉功能障碍的病情变化复杂,关于嗅觉障碍的机制尚未有明确,因此找出OSAS患者引发嗅觉功能障碍的影响因素具有重要意义。
本研究结果显示,年龄≥50 岁、嗅上皮病理改变、嗅球体积<39.50mm3、AHI>20 次/h、ESS≥11 分是OSAS 患者发生嗅觉功能障碍的独立危险因素。其原因分析可能是:(1)人体的嗅觉功能与年龄有显著的相关性,其会随着年龄的增长而逐渐减退[15]。其机制可能包括①鼻黏膜会随年龄变化而变化,特别是50 岁以后嗅黏膜会呈进行性萎缩,嗅黏膜面积逐渐减小、嗅上皮数量减少和传入嗅球神经纤维减少[16];②人体嗅觉神经上皮感受器在人们50 岁之后会明显减少,且嗅球内的小球周细胞也会随年龄增大而减少[17];③眶额叶皮质体积在40 岁以前呈相对稳定的规律,40 岁后开始下降。眶额叶皮质在嗅觉传递过程中发挥重要的作用,且主要与嗅觉辨别功能有相关,眶额叶皮质体积降低,嗅觉能力降低[18]。当OSAS 患者年龄不断增长,嗅觉功能不断降低,最终导致嗅觉障碍。(2)嗅上皮主要由嗅感觉神经元、基底细胞、支持细胞、微绒毛细胞构成,在嗅觉功能中发挥重要作用[19]。OSAS 患者嗅上皮会出现不同程度的病理改变。当嗅上皮被破坏时,其代偿功能发挥作用,水平基底细胞参与嗅上皮的修复,在轻度的损伤与修复之后,机体可维持一定的嗅觉功能;当损伤超过一定强度时,嗅上皮内部分结构被破坏,嗅感觉神经元、支持细胞、球状基底细胞、微绒毛细胞等消失时,嗅上皮内环境受损,水平基底细胞激活被抑制,甚至发生凋亡,嗅觉神经元不能及时更新,嗅觉下降,另外,水平基底细胞向呼吸上皮分化,最终导致嗅觉功能障碍[20]。(3)嗅觉的产生是通过上鼻甲表面嗅黏膜上的纤毛与气体分子进行结合,将嗅觉信号传递至黏膜下的嗅神经,在嗅球内的嗅小球发生突触传递,经过嗅束传递至嗅觉中枢梨状皮质,再由梨状皮质发出信号传递至嗅觉的高级中枢眶额叶皮质来完成的[19]。嗅球在感知气味中发挥重要作用,嗅球体积与嗅觉功能呈负相关[20]。有研究发现[21],嗅觉功能障碍的患者嗅球、嗅束及下额叶的损伤率与嗅觉功能正常的患者比较,嗅球及嗅束体积明显缩小。研究发现,嗅球体积<39.50mm3是引起嗅觉功能障碍的危险因素,与本研究结果一致。(4)AHI 是判断 OSAS 患者的重要指标,AHI 越大,OSAS 越严重,当 AHI>20 次/h 时为中度 OSAS,OSAS 患者的嗅觉功能障碍与患病程度密切相关[22]。OSAS 会导致上气道解剖结构异常,会不同程度造成鼻阻力增加,而通常鼻阻力占到上气道阻力50%以上[23]。当OSAS 上气道解剖结构异常时,微小的阻力增加也会导致上气道阻力明显增加。当患者鼻腔通气功能下降时,导致嗅皮质中枢损伤及外周嗅觉感应能力下降,从而造成主观嗅觉感知能力下降,进而导致患者出现嗅觉功能障碍。(5)有研究显示[23],OSAS 患者存在认知缺陷,如注意力不集中、执行困难、记忆力缺损、精细动作的协调性降低等。睡眠暂停、睡眠不足、白天过度嗜睡均对注意力有重大的影响,被证实为认知障碍的机制[24]。剥夺睡眠可导致白天嗜睡状态,减少丘脑、前额叶以及后顶叶皮层的活跃性,而这些功能性的改变,可能会造成不同神经结构和大脑组织的损伤和代谢应激的发生[25]。睡眠暂停和间断的低氧皆可引起前额叶皮层神经元以及海马的缺失,而这些区域与人的执行功能和记忆密切相关[26]。研究表明[27],个体的认知能力可影响人的嗅觉功能,好的执行力可以让患者正确地辨别出更过的气味。因此,OSAS 患者的白天嗜睡状态以及长期的低氧血症均会引起患者的认知功能减退,损伤嗅觉传导通路的感觉神经纤维,导致患者嗅觉退减,严重到一定程度时,发生嗅觉功能障碍。
综上所述,年龄≥50 岁、嗅上皮病理改变、嗅球体积<39.50mm3、AHI>20 次/h、ESS≥11 分是 OSAS患者发生嗅觉功能障碍的独立危险因素,对于这类患者临床上应予以重视。

