新型国产商业化链球菌药敏板的体外药敏检测性能评估
杜伟鹏,陈向阳,吕高原,周 雨
1.河南省南阳市中心医院检验科,河南南阳 473003;2.河南省郑州市人民医院检验科,河南郑州 450000; 3.郑州安图生物工程股份有限公司,河南郑州 450016
链球菌是临床能够分离到的常见致病菌之一[1],尤其是肺炎链球菌、化脓链球菌、无乳链球菌等,对于人类,尤其是儿童的健康存在巨大威胁[2]。随着目前广谱抗菌药物在临床中的应用日益增多,临床上链球菌对于某些抗菌药物的耐药情况也日益严重[3]。因此,临床分离链球菌属的体外药敏试验检测显得尤为重要。目前,临床上已经有商业化的链球菌药敏检测试剂,并且已得到较为普遍的应用,但是不同厂家或不同方法学之间存在较大差异[4-6]。本文通过考察一种国产商业化链球菌药敏板与微量肉汤稀释法对327株不同种类链球菌的体外药敏试验检测,进而评估该新型商业化链球菌药敏板卡的体外药敏检测性能,以期为临床链球菌属引起的感染性疾病提供更合理的用药指导。
1 材料与方法
1.1材料 收集2018-2019年来源于郑州市中心医院、郑州市人民医院、南阳市中心医院和河南省人民医院的327株链球菌属临床菌株,包括肺炎链球菌107株,化脓链球菌41株,缓症链球菌51株,无乳链球菌55株,停乳链球菌7株,星座链球菌13株,咽颊炎链球菌15株,草绿色链球菌8株,中间链球菌22株,血链球菌8株。标准菌株:肺炎链球菌(ATCC49619)。
1.2仪器与试剂 上海精科科技公司的酸度计,厦门致微公司的高压灭菌锅,瑞士METTLER TOLEDO公司的电子天平,金坛市科析仪器公司的振荡仪,上海跃进公司的恒温培养箱,法国生物梅里埃公司的比浊仪,美国SIGMA公司的快速离心机,中国海尔集团的-20 ℃冰箱,美国Thermo公司的移液器,美仑生物科技公司的头孢曲松、利福平、氨苄西林、头孢呋辛、美罗培南、青霉素、氯霉素、头孢噻肟、阿莫西林/克拉维酸、头孢吡肟、四环素、利奈唑胺、替加环素、左氧氟沙星、克林霉素、莫西沙星、甲氧苄啶、复方磺胺甲噁唑、万古霉素、红霉素抗菌药物标准品,购自Oxoid公司的M-H干粉、脱纤维绵羊血、矿物油,血琼脂平板(郑州安图生物工程股份有限公司),链球菌药敏检测试剂盒(比色/比浊法,郑州安图生物工程股份有限公司),洛阳昊华公司的无水乙醇,国药集团公司的二甲基亚砜。
1.3方法 使用血琼脂平板对质控菌株和临床菌株进行活化,利用0.85%生理盐水将各临床菌株制备成0.5麦氏单位的菌悬液,根据美国临床和实验室标准协会(CLSI)《需氧菌的稀释法药敏试验方法》关于链球菌属细菌药敏试验所用培养基制备的规定[7],将M-H干粉按照要求的量充分溶解并调节pH值至7.0左右,121 ℃高温高压灭菌15 min,灭菌的M-H肉汤冷却后,添加2.5%~5.0%的脱纤维绵羊血,混匀后备用。分别称取头孢噻肟等20种抗菌药物标准品,根据需要考核试剂的各种抗菌药物浓度分布及CLSI标准对于肉汤稀释法操作过程的严格规定,使用合适的溶解试剂进行抗菌药物的溶解并加入96孔板内,每孔加入10 μL的10倍于检测浓度的抗菌药物溶解液,并使用大型真空干燥箱进行快速干燥处理,保存备用。微量肉汤稀释法操作:取90 μL加血M-H肉汤加入96孔酶标板;每种抗菌药物进行3次平行试验,将已制得的0.5麦氏单位质控菌悬液稀释200倍后,各取10 μL加入酶标板各孔内,滴加1滴矿物油液封并置于35~37 ℃温箱内培养24 h。待评价链球菌药敏试剂盒操作过程:取出1瓶培养液,向其中添加1滴显色液和100 μL菌悬液,混匀后向120孔链球菌药敏板每孔加入100 μL菌悬液,滴加矿物油后盖上盖子置于35~37 ℃温箱内培养24 h。两种操作均要求首先进行肺炎链球菌(ATCC49619)的质控,合格后才能进行临床菌株试验。依据CLSI文件M100-S29标准,对药敏试验结果和敏感性结果进行记录和统计分析。
1.4统计学处理 对两种方法所测得的最小抑菌浓度(MIC)结果及菌株敏感性结果按照菌株分类进行统计学分析,采用SPSS23.0统计软件对数据进行分析处理。计数资料以例数或百分率表示,采用χ2检验进行比较。以P<0.05为差异有统计学意义。根据CLSI的M52标准[7]进行菌株敏感性比较分析[8];统计出3种方法的基本一致性(EA,即不同MIC测定方法在±1个稀释倍数范围内的结果一致性)和分类一致性(CA,即不同方法测定的菌株对抗菌药物敏感性的一致性),另外,对于菌株敏感性,需要进行非常重大误差(VME,即耐药误判为敏感)、重大误差(ME,即敏感误判为耐药)和微小误差(mE,即中介报告为敏感或耐药)结果的测定。美国食品药品监督管理局标准规定指出,CA≥90%、EA≥90%、VME≤1.50%、ME≤3.00%、mE<3.00%为可接受范围。
2 结 果
2.1考核试剂盒与微量肉汤稀释法EA测定结果 统计链球菌药敏试剂盒与微量肉汤稀释法的检测结果,对其EA进行统计分析,按照CLSI标准对于不同方法学结果差异的规定,不同测定方法的MIC差值≤1个倍比梯度认为是正确测定值。EA检测结果见表1。新型链球菌药敏板与“金标准”微量肉汤稀释法共测定327株链球菌的体外药敏检测,在EA方面,按照测试结果总量统计,新型链球菌药敏板与微量肉汤稀释结果差异在±1个稀释倍数内的整体符合结果个数/总结果个数为6 509/6 540,整体EA为99.53%。对于所涵盖的抗菌药物种类:头孢曲松、利福平、头孢呋辛、青霉素、氯霉素、头孢噻肟、阿莫西林/克拉维酸、头孢吡肟、四环素、利奈唑胺、替加环素、左氧氟沙星、克林霉素、莫西沙星、万古霉素、红霉素的EA均为100.00%;氨苄西林EA为97.86%;美罗培南EA为96.94%;复方磺胺甲噁唑EA为97.55%;红霉素/克林霉素诱导试验EA为98.17%;对于所测临床菌株,随机选取10株进行结果重复性测试,检测结果与已测结果一致。
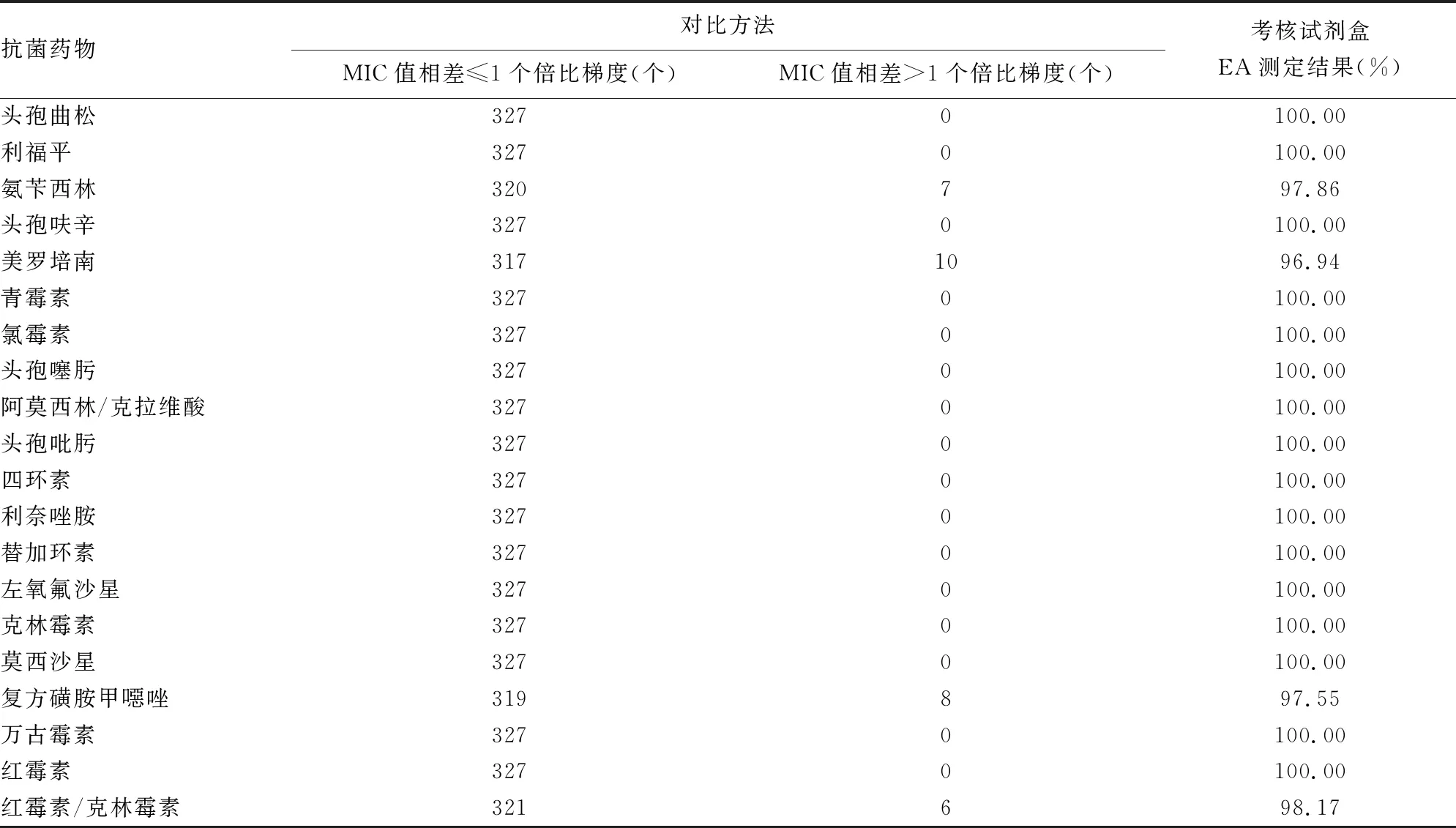
表1 考核试剂盒与微量肉汤稀释法EA测定结果
2.2考核试剂盒与微量肉汤稀释法CA测定结果 对两种测定方法的体外药敏检测的CA进行统计,结果表明,新型链球菌药敏板与“金标准”微量肉汤稀释法测定共进行327株链球菌的体外药敏检测,两种方法的整体CA为97.40%,VME为0.09%,ME为0.59%,mE为1.92%。新型链球菌药敏板与“金标准”微量肉汤稀释法的CA测定结果差异无统计学意义(P>0.05)。见表2。

表2 考核试剂盒与微量肉汤稀释法CA测定结果[n(%)]
3 讨 论
链球菌常分布于人体的口腔、鼻咽、眼部,少量存在于血液或脑脊液等体液中,常引起肺炎、支气管炎、胸膜炎、脑膜炎、败血症等,尤其是对儿童的健康影响较大[9]。另外,随着抗菌药物应用于链球菌感染的治疗日益普遍,链球菌对抗菌药物耐药也逐渐增多[10]。因此,针对链球菌属的体外药敏检测,对于临床用药的指导意义就显得更加重要。
链球菌属耐药性的变迁,全国细菌耐药监测网作为国家级的临床细菌耐药监测机构,出台的全国细菌耐药监测网技术方案也明确规定了链球菌属细菌为必须进行监测的抗菌药物种类,比如对于分离自脑脊液的肺炎链球菌,必须监测青霉素、万古霉素、头孢曲松(或头孢噻肟)、美罗培南等抗菌药物耐药性变迁;对于分离自脑脊液以外的其他标本类型的肺炎链球菌,必须监测青霉素、红霉素、克林霉素、左氧氟沙星或莫西沙星、复方磺胺甲噁唑等抗菌药物的耐药性变迁。因此,对于商业化的链球菌药敏板卡,其能够覆盖的抗菌药物种类必须包含全国细菌耐药监测网技术方案规定的必须监测的抗菌药物种类,并且尽可能多地覆盖链球菌属细菌的检测种类。
商业化药敏板目前已经在临床体外药敏检测方面有比较普遍的应用[11],但是针对链球菌的体外药敏检测,由于链球菌对于营养物质要求的特殊性,进口和国产的商业化药敏板检测性能参差不齐,不同种类试剂能够检测的链球菌种类差异也较大。目前,国内临床常用的链球菌药敏进口检测试剂盒有法国梅里埃的GP68型号和GP67型号药敏卡、美国BD公司的PHOENIX SMIC/ID-2型号药敏卡、美国贝克曼公司的PC33型号和PMIC29型号及美国赛默飞公司的Sensititre STP6F型号药敏卡。法国梅里埃公司的GP68只能用来测定肺炎链球菌药敏试验,GP67只能用来检测无乳链球菌药敏试验,其他种类的链球菌药敏试验均无法进行检测。熊安英等[12]对Vitek-Compact肺炎链球菌GP68药敏卡的性能评估指出,GP68药敏板卡由于检测原理缺陷,对青霉素、头孢曲松、头孢噻肟、美罗培南等药敏试验检测结果出现假耐药情况,需要使用其他方法复核测定结果,GP68其余抗菌药物测定肺炎链球菌的EA和CA均>90.00%。美国BD公司链球菌专用SMIC/ID-2药敏板条能够检测75种链球菌的药敏试验,包括了15种抗菌药物;美国贝克曼公司MicroScan AutoScan-4 PC系列两种板卡能够对链球菌属进行检测,但是不能覆盖氨苄西林、克林霉素、红霉素和四环素的敏感折点,PMIC29则不能覆盖氨苄西林的敏感折点;美国赛默飞公司的Sensititre STP6F能够检测链球菌属药敏试验结果,但是对于β溶血链球菌的检测,板卡未包含克林霉素,因此需要使用其他方法来进行补充。MITTMAN等[13]对肺炎链球菌BD Phoenix与Vitek 2、MicroScan microstreps及药敏试验的比较研究指出,BD Phoenix与Vitek 2、MicroScan microstreps与微量肉汤稀释的EA>95.00%,CA分别为95.50%、94.20%、98.70%,检测性能良好。
另外,考虑到进口药敏检测产品与国产药敏检测产品比较,虽然性能方面能够明显优于国产药敏检测产品,但是其使用成本太高,这也限制了进口试剂在部分临床机构的应用;一旦国产药敏检测试剂能够在产品检测性能方面达到或接近进口产品检测水平,国产药敏检测试剂能在解决临床实际药敏检测问题的同时,明显降低检验科微生物室的成本。
与纸片扩散法和E test法比较,商业化药敏板能够与自动化仪器设备进行配套,减少人工操作过程,能够同时检测多种抗菌药物的体外药敏情况,缩短药敏试验结果报告时间,但是菌株检测范围有一定限制,比如厌氧菌、对营养要求苛刻的少见菌目前还没有商业化药敏板实现对其的检测。
本文考核的国产商业化链球菌药敏试剂盒采用比浊法和比色法相结合的检测方法学,板卡为120微孔设计,不仅覆盖了全国细菌耐药监测网技术方案规定的必须检测抗菌药物的种类,还能检测替加环素、利福平等共19种抗菌药物,各抗菌药物能够检测浓度梯度平均数大于6个,实现2020年最新版CLSI标准折点全覆盖,检测更加精准;考核试剂盒应用改良的特殊链球菌培养基代替了“金标准”微量肉汤稀释法所用的加血培养基(2.5%~5.0%裂解马血或脱纤维绵羊血),使用更加方便;另外,本国产链球菌药敏板能够同时用于肺炎链球菌、α-溶血和β-溶血链球菌等多种链球菌的药敏试验检测,通用性强。
本文以微量稀释法作为比对标准,研究了一种新型国产商业化链球菌药敏板对于不同种类链球菌的体外药敏检测性能。研究表明,新型链球菌药敏板与“金标准”微量肉汤稀释法在测定结果的EA方面,整体符合结果个数/总结果个数为6 509/6 540,整体EA为99.53%,CA为97.40%,VME为0.09%,ME为0.59%,mE为1.92%。新型链球菌药敏板与“金标准”在测定结果的CA方面比较,差异无统计学意义(P>0.05),也能够充分说明新型国产商业化链球菌平板具有良好的体外药敏检测性能,能够满足临床检测的需要。