南充地区汉族健康人群血清胃蛋白酶原和胃泌素-17参考区间调查研究*
唐 伟,李 琳,赵全能,张 兵,杜利君
川北医学院第二临床医学院/南充市中心医院检验科,四川南充 637000
近年来,胃癌的发病率不断上升。胃蛋白酶原(PG)和胃泌素-17(G-17)作为血清学检测指标,对萎缩性胃炎和早期胃癌的诊断价值受到越来越多的关注。PG和G-17在临床上被称为“血清学活检”[1]。根据分泌部位和性质PG可分为PGⅠ和PGⅡ两种类型。G-17是由胃窦和十二指肠G细胞分泌的一种胃肠道激素。血清PG和G-17的参考区间目前还没有统一标准,不同地区人群的饮食习惯、生活习惯及地理环境等因素都会造成PG和G-17参考区间不同[2],但大多数临床实验室使用的PG和G-17参考区间一部分是参考其他国家的相关标准,一部分是直接使用试剂说明书上的参考区间,其在各地区的适用性有待考证。南充地区位于四川东北部,是胃癌的高发区[3-4],本研究初步建立了南充地区汉族健康人群血清PG及G-17的参考区间,以期为临床研究提供参考。
1 资料与方法
1.1一般资料 选取2019年1-8月在本院进行血清PG和G-17检测的3 444例汉族健康体检者作为研究对象,排除体检时发现有明确胃肠道疾病者。其中男1 972例,年龄21~92岁,中位年龄49.1岁;女1 472例,年龄20~89岁,中位年龄47.6岁。
1.2仪器与试剂 仪器为烟台艾迪康生物科技有限公司生产的ADC ELISA-Ia流水线式全自动酶联免疫工作站,试剂为芬兰百得公司生产的PG和G-17检测试剂盒。
1.3方法 所有研究对象均在清晨空腹抽取静脉血5 mL,采集后立即混匀标本,室温放置,自然凝固后以3 000 r/min离心10 min,分离血清,并在2 h内完成检测。使用酶联免疫吸附试验检测血清PGⅠ、PGⅡ和G-17水平,PGⅠ/PGⅡ由仪器软件自动计算得出。试剂更换批号时使用配套校准品进行校准,每次检测前都使用高、低两种水平的质控品进行室内质控,严格按照检验项目标准操作规程进行操作。
1.4统计学处理 采用SPSS19.0软件进行数据分析。采用Kolmogorov-Smirnov检验进行正态性验证,偏态分布的计量资料以M(P25,P75)表示,两组之间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验。以P<0.05为差异有统计学意义。
2 结 果
2.1血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17检测结果的百分位分布 Kolmogorov-Smirnov检验结果显示,所纳入研究对象的血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17水平均呈偏态分布(P<0.05)。血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17的中位水平分别为94.21 μg/L、9.29 μg/L、12.26、2.57 pmol/L。见表1。
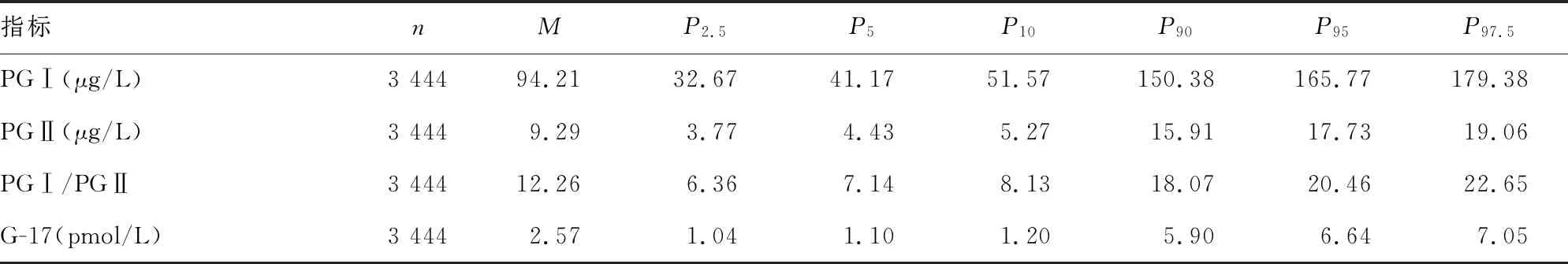
表1 血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17检测结果的百分位分布
2.2血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17水平与性别和年龄的关系 男性汉族健康人群血清PGⅠ、PGⅡ水平均明显高于女性,差异均有统计学意义(P<0.05);血清PGⅠ/PGⅡ和G-17在不同性别间比较,差异均无统计学意义(P>0.05),见表2。男性汉族健康人群不同年龄段血清PGⅠ、PGⅡ水平比较,差异均有统计学意义(P<0.05);其中21~30岁与>30~40岁男性血清PGⅠ、PGⅡ水平差异无统计学意义(P>0.05);>40~50岁与>50~60岁男性血清PGⅠ、PGⅡ水平差异无统计学意义(P>0.05),其余各年龄段两两比较差异均有统计学意义(P<0.05)。女性汉族健康人群不同年龄段血清PGⅠ、PGⅡ水平比较,差异均有统计学意义(P<0.05);其中20~30、>30~40、>40~50岁女性血清PGⅠ、PGⅡ水平差异均无统计学意义(P>0.05);而>50~60、>60岁女性血清PGⅠ、PGⅡ水平均明显高于20~30、>30~40、>40~50岁女性,差异均有统计学意义(P<0.05);>60岁女性血清PGⅠ、PGⅡ水平均明显高于>50~60岁女性,差异均有统计学意义(P<0.05)。男、女汉族健康人群中,各年龄段血清PGⅠ/PGⅡ、G-17水平差异均无统计学意义(P>0.05),见表3。

表2 男、女汉族健康人群血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17水平比较[M(P25,P75)]
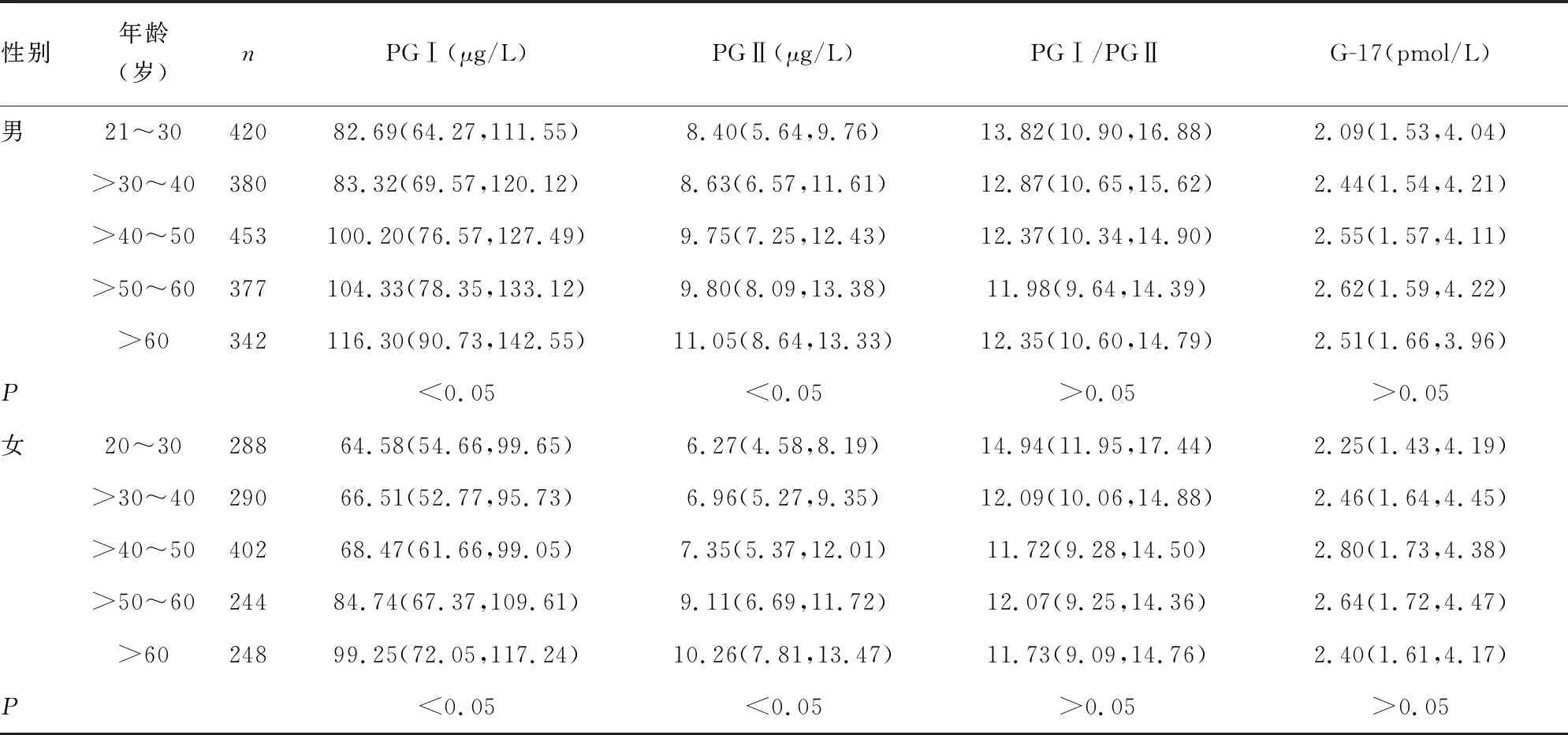
表3 男、女汉族健康人群各年龄段血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17水平比较[M(P25,P75)]
2.3汉族健康人群血清PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17参考区间建立 根据以上结果,不同性别汉族健康人群血清PGⅠ、PGⅡ水平差异有统计学意义(P<0.05),血清PGⅠ/PGⅡ和G-17水平差异无统计学意义(P>0.05),因此,需要建立不同性别汉族健康人群血清PGⅠ、PGⅡ参考区间,而血清PGⅠ/PGⅡ和G-17不需要建立不同性别人群的参考区间。此外,由于21~30岁与>30~40岁、>40~50岁与>50~60岁男性血清PGⅠ、PGⅡ水平差异均无统计学意义(P>0.05),因此,男性汉族健康人群需要建立血清PGⅠ、PGⅡ参考区间的年龄段为21~40、>40~60、>60岁。由于20~30、>30~40、>40~50岁女性血清PGⅠ、PGⅡ水平两两比较差异均无统计学意义(P>0.05),因此女性汉族健康人群需建立血清PGⅠ、PGⅡ参考区间的年龄段为20~50、>50~60、>60岁。依据《WS/T402-2012临床实验室检验项目参考区间的制定》,偏态分布的数据参考区间下限为P2.5,上限为P97.5。PGⅠ/PGⅡ参考区间为6.36~22.65,G-17参考区间为1.04~7.05 pmol/L。不同性别、不同年龄段汉族健康人群血清PGⅠ、PGⅡ参考区间见表4。
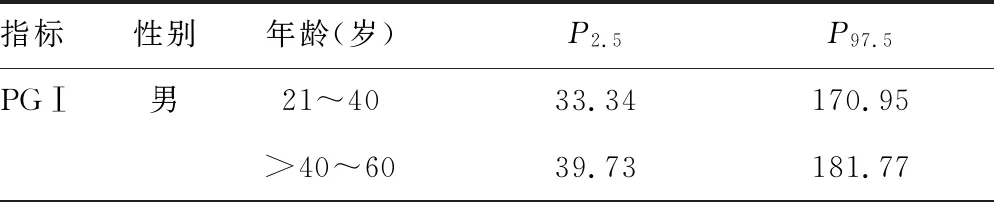
表4 不同性别、不同年龄段汉族健康人群血清PGⅠ、PGⅡ参考区间(μg/L)

续表4 不同性别、不同年龄段汉族健康人群血清PGⅠ、PGⅡ参考区间(μg/L)
3 讨 论
血清PG水平反映了胃黏膜腺体和细胞的数量,同时也能够提示不同部位胃黏膜的分泌功能。PGⅠ来源于胃底腺的主细胞和颈黏液细胞,PGⅡ则来源于全胃腺(胃贲门腺、胃底腺、胃窦幽门腺)和远端十二指肠Brunner氏腺[5]。目前认为胃癌的形成一般由幽门螺杆菌感染引起,可依次经历慢性胃炎、萎缩性胃炎、化生和异常增生、胃癌4个阶段。在胃癌的发生、发展过程中,随着胃黏膜腺体萎缩和化生的程度逐渐升高,PGⅠ的分泌量持续减少。PGⅡ则来源于全胃腺,即使胃体部出现假幽门腺化生,血清PGⅡ水平也可以保持相对稳定,在后期可能还会出现水平升高,而血清PGⅠ/PGⅡ水平则不断降低,在发展为胃癌时水平最低。因此,检测血清PGⅠ、PGⅡ、PGⅠ/PGⅡ水平可反映胃黏膜从幽门腺进展至贲门口侧的萎缩性变化及胃黏膜的功能状态[6]。胃泌素是一种多肽类的胃肠激素,具有刺激胃酸分泌、促进胃黏膜再生、调节胃肠功能等作用,主要由胃窦部的G细胞分泌,空肠及十二指肠也可少量分泌,其中80%~90%的胃泌素为G-17,胃黏膜细胞受刺激或发生病变时,血清G-17水平会发生变化[7]。胃体萎缩性胃炎和胃癌患者血清G-17水平明显升高,PGⅠ、PGⅠ/PGⅡ水平明显降低;在胃窦萎缩性胃炎中,血清G-17水平降低,PGⅠ、PGⅠ/PGⅡ水平正常;全胃萎缩性胃炎则血清G-17、PGⅠ、PGⅠ/PGⅡ水平均降低[8]。因此,联合检测血清PG和G-17水平可以用于评估胃功能,评价胃黏膜发生病变的部位和程度。
健康人群血清PG及G-17参考区间受到多种因素的影响,不同地区、种族、性别及年龄均可能会造成参考区间的差异[9-10],建立适合本地区汉族健康人群的血清PG和G-17参考区间,不仅有利于临床诊疗工作的开展,更有利于进一步开展临床相关研究[11-12]。但目前关于血清PG及G-17的参考区间并没有统一标准,各实验室使用的参考区间来源也不同。本研究回顾性分析了南充地区汉族健康人群血清PG和G-17水平,结果显示,南充地区男性汉族健康人群血清PGⅠ、PGⅡ水平均明显高于女性,差异均有统计学意义(P<0.05);且在男、女汉族健康人群中,各年龄段血清PGⅠ、PGⅡ水平差异也均有统计学意义(P<0.05),说明血清PGⅠ、PGⅡ水平受年龄和性别的影响明显,与相关文献研究结果一致[13-15]。而不同性别汉族健康人群血清PGⅠ/PGⅡ和G-17水平差异均无统计学意义(P>0.05);且在男、女汉族健康人群中,各年龄段血清PGⅠ/PGⅡ、G-17水平差异也均无统计学意义(P>0.05),说明血清PGⅠ/PGⅡ、G-17水平不受性别和年龄因素的影响。刘孝桢等[16]的研究也发现,G-17水平不受性别和年龄因素的影响。本研究所建立的血清PGⅠ/PGⅡ参考区间为6.36~22.65,G-17参考区间为1.04~7.05 pmol/L,同时针对不同年龄段、不同性别汉族健康人群建立了PGⅠ、PGⅡ的参考区间。
本研究初步建立了南充地区汉族健康人群血清PG和G-17的参考区间,可以基本了解该地区汉族健康人群血清PG和G-17水平,为进一步研究提供参考依据。但因纳入人群中可能存在居住在该地区的外地人群、可能有隐性胃肠道疾病患者,以及个体生物学差异、检验方法学限制等相关因素,本研究仍存在一定的局限性,后期将在排除相关干扰因素后进一步扩大样本量进行研究。