流式细胞分析仪检测细胞因子方法学性能验证*
吴 晗,刘晨玢,毛胤祺,陈 炜,陈淑英
1.上海交通大学医学院,上海 200025;2.复旦大学附属华山医院检验医学科,上海 200040
细胞因子是一种由淋巴细胞、单核细胞和成纤维细胞等产生的具有调控机体生长、细胞分化和相关免疫激活等作用的小分子蛋白质,在感染、炎症和癌症发生和发展过程中发挥重要作用,从而维持机体的稳态[1]。目前,细胞因子常用的检测方法主要包括细胞生物学检测、分子生物学检测、酶联免疫吸附试验和流式细胞术等[2],其中流式细胞术能方便快捷地在单细胞浓度方面进行细胞因子等蛋白分子的检测,具有准确、微量、高效的优点,广泛应用于临床及科研相关项目的检测[3],从而监视体内的炎症和免疫状态,为疾病筛查诊断、药效评估及预后治疗提供重要参考[4]。根据CNAS-CL02:2012《医学实验室质量和能力认可准则》的规定[5],开展使用新项目前,实验室必须对指标的相关性能进行方法学验证评估。本实验室以血浆细胞因子作为检测项目,通过测定这些细胞因子的精密度、准确度、线性范围、最低检测限、参考区间和抗干扰能力等,从而验证实验室使用的多重微球流式免疫荧光发光法在BD FACSCanto Ⅱ流式细胞分析仪上检测8项细胞因子的性能,现报道如下。
1 资料与方法
1.1一般资料 采集复旦大学附属华山医院健康体检者及门急诊住院患者的血浆标本,应确保标本无溶血、脂血和血凝块。
1.2仪器与试剂 BD FACSCanto Ⅱ流式细胞分析仪,青岛瑞斯凯尔生物科技有限公司生产的8项细胞因子检测试剂盒及其配套的具有溯源性的校准品,8项细胞因子检测试剂盒[批号:191005,试剂成分:捕获微球抗体、检测抗体、链霉亲和素(SA-PE)、实验缓冲液、洗涤缓冲液(10×)];校准品(批号:20190801)。
1.3方法
1.3.1检测项目 本实验室使用青岛瑞斯凯尔生物科技有限公司生产的8项细胞因子检测试剂盒,对体内白细胞介素(IL)-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、干扰素γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)的浓度和分布进行流式细胞术多参数检测和分析。
1.3.2检测原理 试剂盒基于免疫学分析方法,采用直接夹心法原理,与经典的“三明治”免疫分析方法一致。以荧光发光微球作为免疫反应的固相,利用免疫学分析方法与流式细胞分析仪分析相结合,用于测定人体血浆或血清中的细胞因子浓度。技术原理:荧光发光微球耦联的细胞因子抗体与生物素标记的细胞因子配对抗体和标本或校准品中的细胞因子结合形成“三明治”复合物,再与加入的标记有藻红蛋白的SA-PE反应。通过流式细胞分析仪进行荧光发光强度检测,从而得到标本中的细胞因子浓度。
1.3.3预处理 在进行性能验证试验前,必须对仪器进行相关校准和质量控制检测,确保仪器在控后方可开展性能检测。
1.3.4检测步骤 (1)将实验用试剂恢复到室温。(2)基质准备:将5 mL实验缓冲液加到冻干粉基质中,静置至少15 min,待冻干粉溶解,涡旋使其充分混匀。剩余的基质分装在EP管中,可储存于-20 ℃1个月。(3)校准品制备:向校准品冻干粉中加入250 μL实验缓冲液,使冻干粉完全充分溶解;室温下静置10 min,此溶液浓度为1 000.00 pg/mL,将其标记为A7;准备6只空管,分别标记为A6、A5、A4、A3、A2、A1;每只试管中加入75 μL实验缓冲液,并进行倍比稀释,即取25 μL A7溶液到A6中,充分混匀;同样的方法,依次进行稀释,分别得到A5、A4、A3、A2和A1校准品。A0中只加入实验缓冲液。各校准品终浓度:A0为0.00 pg/mL,A1为2.44 pg/mL,A2为9.77 pg/mL,A3为39.06 pg/mL,A4为156.25 pg/mL,A5为625.00 pg/mL,A6为2 500.00 pg/mL,A7为10 000.00 pg/mL。(4)洗涤缓冲液配制:将稳定到室温,完全溶解的5 mL 10×洗涤缓冲液加到45 mL去离子水中。(5)标本稀释:血清或血浆标本可根据实际情况使用实验缓冲液进行适当稀释。(6)加样:向校准品管中分别加入25 μL基质和校准品,向标本管中分别加入25 μL实验缓冲液和稀释的样品。向所有管中加入25 μL捕获微球抗体,震荡混匀1 min,再加入25 μL检测抗体,用锡箔纸包被管子,室温(25±1)℃避光震荡2 h。加入25 μL SA-PE,用锡箔纸包被管子,室温(25±1)℃避光震荡0.5 h,2 500 r/min离心5 min,去除上清液,加入200 μL 10×洗涤缓冲液,通过涡旋将微球重悬(30 s),离心(1 600 r/min,5 min)去除上清液。根据流式细胞分析仪上样需求,向每管中加入150~300 μL洗涤缓冲液,通过涡旋将微球重悬,上机检测。
1.3.5精密度验证试验 采用两种不同值的具有溯源性的校准品;参考WS/T492-2016《临床检验定量测定项目精密度与正确度性能验证》要求[6],首先将校准品冻干粉按要求配置成溶液,注意校准品需现配现用,并按规定储存。分别检测线性范围内的IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、IFN-γ和TNF-α精密度参考品各2份,浓度为2 500 pg/mL(P1)、625 pg/mL(P2)。对精密度校准品进行为期5 d的连续检测,每天对同一浓度的精密度具有溯源性的校准品进行5次测定,每份标本得到25组数据。统计结果,计算其变异系数(CV)值。判断标准:(1)精密度误差范围应小于该项目在医学上允许的最大误差范围,原则上应小于厂家提供的范围。如果无法满足,则应参照CLIA′88等其他资料提供的可接受范围。如果上述情况均未满足,则该项目的最大允许误差应由实验室自建。(2)厂家提供的精密度范围CV≤15%,分别计算本实验室批内和批间两组数据的CV,若CV均≤15%,则表明厂家声明的精密度通过验证。(3)如果计算所得CV≥15%,考虑到人为实验操作误差,则每种浓度增加5次孵育实验上机检测,将所得数据与之前数据合并计算,剔除明显人为误差的数据,每组剔除数据必须≤2个,以增加结果的可靠程度,若CV均≤15%,则表明厂家声明的精密度通过验证。
1.3.6准确度验证试验 采用具有溯源性的校准品进行准确度验证。分别检测线性范围浓度内的IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、IFN-γ和TNF-α准确度参考品各2份,浓度为2 500 pg/mL(P1)和625 pg/mL(P2)。对准确度校准品进行为期5 d的连续检测,每天对同一浓度的准确度校准品进行3次测定,每份标本得到15组数据,记录数据并分析统计结果。判断标准:(1)准确度误差范围应小于该项目医学上允许的最大误差范围,原则上应满足厂家声明的范围,如果无法满足,则应参照CLIA′88等其他资料提供的可接受范围或由实验室负责人根据实验室具体情况而定。(2)对厂家提供的两种不同值的具有溯源性的校准品进行连续3次检测,连续检测5 d,其相对偏差在±15%以内,则通过厂家声明的验证。(3)若厂家提供的两种不同值的具有溯源性的校准品连续3次检测,其相对偏差不在±15%以内,则每种浓度增加1~2个批次检测,将所得数据与之前的数据合并计算,增加结果的可靠程度,如其相对偏差在±15%以内,则通过厂家声明的验证。
1.3.7线性范围验证试验 选用厂家声明分析测定范围是2.44~10 000.00 pg/mL,7份线性参考品浓度分别为2.44、9.77、39.06、156.25、625.00、2 500.00、10 000.00 pg/mL,范围包括预期的整个可检测报告范围。根据WS/T 408-2012《临床化学设备线性评价指南》要求[7],所有浓度在一个批次中完成实验。每种浓度随机、重复测定最少2次,共得到最少14个数据,记录数据并统计结果。结果判断:(1)以Grubbs法剔除离群值。(2)用Excel进行回归方程的线性检验,判断是否为非线性。(3)依照系列浓度血清的配制稀释关系计算出各实验样品内含分析物的浓度,为系列样品的理论值。按实验要求对系列浓度血清进行重复测定,计算均值,此值为系列浓度样品的实测值,和理论值形成7对理论值、实测值。各份实测均值与理论值进行相关分析,偏离应小于10%,计算Y=bX+a。
1.3.8参考区间验证试验 依据美国临床实验室标准化委员会(NCCLS) C28-A2文件[8],随机选取40例健康的男女性体检标本进行检测。判断标准:参照C28-A2文件,先初步检查所得的检测数据,用1/3规则判断数据中是否出现离群值,如有离群值存在必须剔除,并用其他标本替换。判断标准为R值≥90%,若满足要求,则可判定厂家提供的参考区间适用于本实验室,若不满足要求,则需根据本实验室建立参考区间。按以下公式计算R值:R=检测值在引用参考区间的个体数/总个体数×100%。
1.3.9干扰验证试验 在具有溯源性的校准品(浓度为625.00 pg/mL和2 500.00 pg/mL)中加入干扰物(三酰甘油、血红蛋白和胆红素),分别测定2次各参考品IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、IFN-γ和TNF-α浓度,并计算平均值及其偏差,偏差应在厂家提供的干扰偏差(≤10%)范围内。
1.4统计学处理 采用Microsoft Excel 2013软件和SPSS16.0统计软件进行数据分析处理。并计算相应的CV和相对偏差。线性验证中各浓度理论值与实测值关系采用Pearson相关分析。计数资料以例数或百分率表示。
2 结 果
2.1精密度验证试验结果 对厂家提供的低值和高值两种浓度的校准品进行批内精密度和批间精密度试验,测定结果及统计分析见表1。低值和高值两种浓度的校准品连续检测5 d,所有项目每天检测的批内CV均≤15%。低值和高值8项细胞因子(IL-2、IL-6、IL-10、IFN-γ、IL-17、IL-4、IL-12p70、TNF-α)的批间CV分别为(低值/高值)2.04%/4.66%、9.02%/6.35%、1.76%/4.51%、8.37%/14.39%、3.12%/5.57%、 2.41%/4.33%、5.46%/5.11%、3.75%/11.10%。由表1可见,无论是批内CV还是批间CV,外周血细胞因子的所有项目结果均小于厂家声明的不精密度(CV≤15%)。
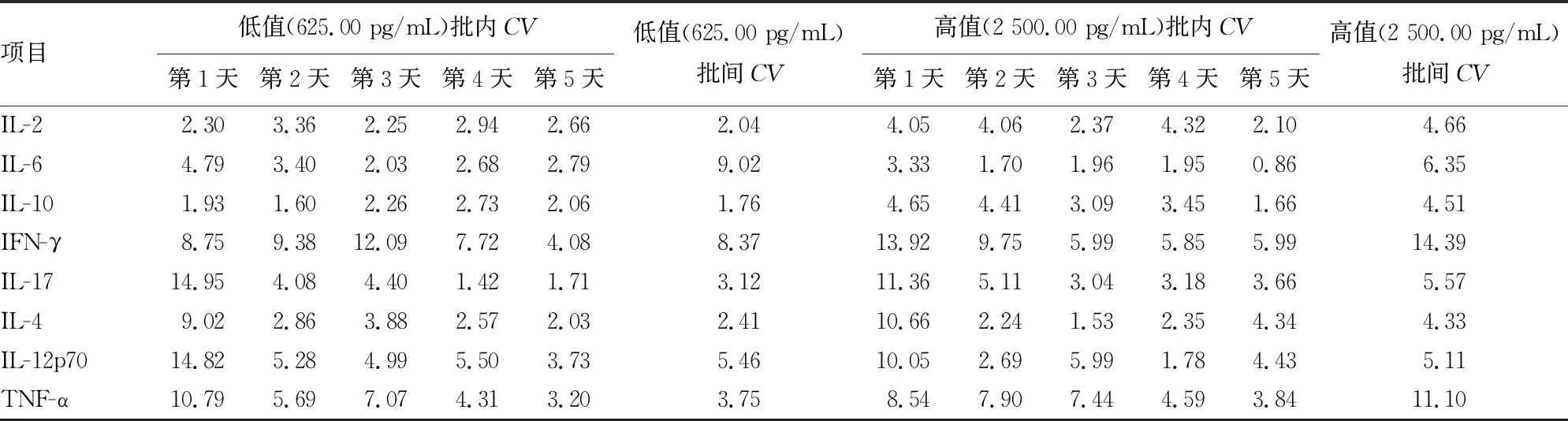
表1 8项细胞因子精密度分析(%)
2.2准确度验证试验结果 厂家提供的两种不同值的具有溯源性的校准品连续检测3次,连续检测5 d,测定结果及统计分析见表2。低值和高值8项细胞因子(IL-2、IL-6、IL-10、IFN-γ、IL-17、IL-4、IL-12p70、TNF-α)的批间相对偏差分别为(低值/高值)-2.61/2.99、2.85/-3.57、-3.78/2.51、0.93/-3.77、-0.78/-1.11,-4.59/-2.52、-1.53/-8.86、-0.55/-5.95。其相对偏差均在厂家声明的±15%以内。因此,在BDFACS Canto Ⅱ流式细胞分析仪上检测结果的准确度符合厂家声明的要求(偏差≤±15%)。

表2 8项细胞因子准确度分析
2.38项细胞因子线性范围验证试验结果 在标本状态良好、无干扰的情况下,测定结果及统计分析见表3。已验证8项细胞因子检测试剂盒(多重微球流式免疫荧光发光法)在BDFACS Canto Ⅱ流式细胞分析仪上检测结果在范围内呈线性,各细胞因子线性理论范围为2.44~10 000.00 pg/mL,r2≥0.98,符合准确度要求。
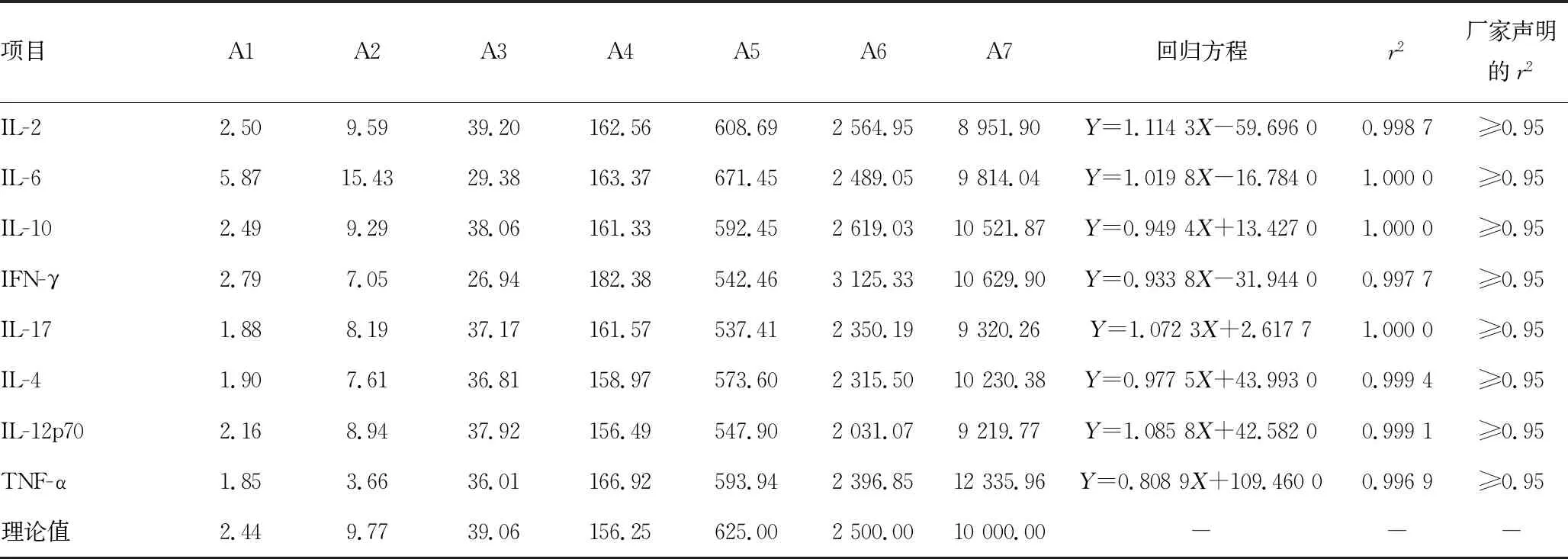
表3 8项细胞因子线性范围验证试验结果(pg/mL)
2.4最低检测限验证试验结果 8项细胞因子检测试剂盒(多重微球流式免疫荧光发光法)在BDFACS Canto Ⅱ流式细胞分析仪上最低检测限符合预期,测定结果及统计分析见表4。IL-2的最低检测限为0.00 pg/mL,IL-6的最低检测限为1.47 pg/mL,IL-10的最低检测限为1.05 pg/mL,IFN-γ的最低检测限为0.00 pg/mL,IL-17的最低检测限为0.56 pg/mL,IL-4的最低检测限为1.12 pg/mL,IL-12p70的最低检测限为0.47 pg/mL,TNF-α的最低检测限为0.00 pg/mL。
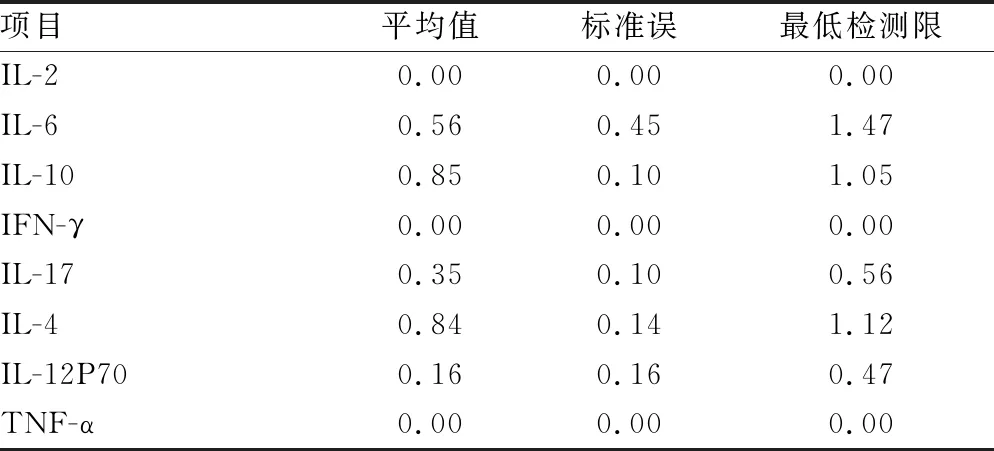
表4 最低检测限验证试验结果(pg/mL)
2.5参考区间验证试验结果 BD FACSCanto Ⅱ流式细胞分析仪对外周血8项细胞因子参考区间的验证结果见表5,8项细胞因子(IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、IFN-γ、TNF-α)的R值分别为95.0%、97.5%、92.5%、97.5%、100.0%、97.5%、95.0%、92.5%,厂家提供的参考区间均≥90.0%,适合本实验室。
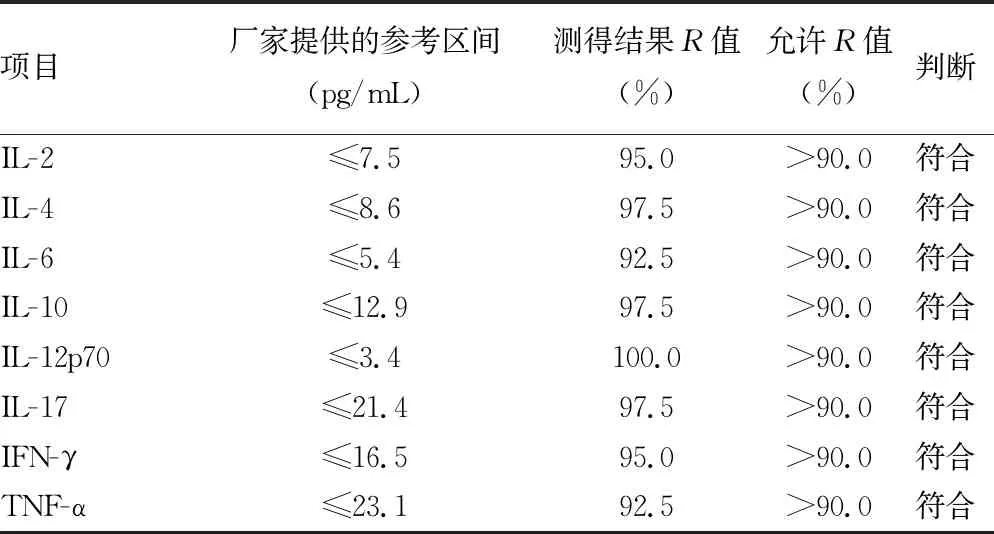
表5 外周血细胞因子参考区间验证试验结果
2.6干扰验证试验结果 在干扰物三酰甘油≤10 mmol/L、血红蛋白≤5.0 mg/mL、胆红素≤258 μmol/L时,干扰偏差小于或等于厂家提供的10%偏差范围。
3 讨 论
细胞因子是由多种组织细胞合成和分泌的小分子蛋白质,在细胞信号转导中发挥重要作用,具有多种生物学功能,如参与细胞生长分化和成熟的调控,以及免疫应答和炎性反应的调节等过程[9-10]。流式细胞术具有高速、高精度、高准确度的优点,能够对上万个细胞进行高速分析,获取每个细胞的多种参数特征,从而在细胞分子浓度上应用单克隆抗体对单个细胞或单个分子进行多参数、快速的定量分析[11]。
一般来说,科室对于送检标本通常只进行一次检测,这必然要求检验方法应该具有良好的精密度。本研究中无论是低浓度还是高浓度的参考品,应用多重微球流式免疫荧光发光法检测外周血细胞因子各项指标的批内精密度结果和批间精密度结果均满足厂家声明的精密度要求,说明本实验方法具有较高的重复性与精密度。
准确度是指某一指标多次检测的平均值和真实值相一致的程度。目前,进行准确度验证的方法有很多种,本实验室使用厂家提供的校准品作为参考物质,用来验证多重微球流式免疫荧光发光法检测结果的准确度和稳定性。通过检测参考物质并对参考物质的赋值进行对比,从而计算得到实验室参考物质的测量偏移值和赋值的不确定度。本实验准确度检测结果中所有外周血细胞因子检测项目的实验室参考物质测量偏移值均小于或等于其所对应的参考物质赋值的不确定度,因此,可认为该方法的准确度性能符合要求。
线性范围是待测物质的变化范围,对应于校准曲线的直线部分。依据厂家提供的信息,多重微球流式免疫荧光发光法检测外周血细胞因子的浓度范围为2.44~10 000.00 pg/mL。在验证线性范围时,实验室应在厂家声明的线性范围内取5~7种浓度的标本,所测标本浓度间隔应尽可能保持一致。本研究选取了7种不同浓度的标本作为本研究的线性范围检测对象,根据针对各项细胞因子检测结果所绘制的线性回归图与差异图发现,本实验方法测量的线性范围基本符合厂家所提供的线性范围,说明该仪器具有良好的线性范围。
按照NCCLS C28-A2文件推荐的方法,对外周血细胞因子的参考区间进行方法学验证,测定结果提示,IL-2有95.0%的测定数据在厂家引用的参考区间内,IL-4为97.5%、IL-6为92.5 %、IL-10为97.5%、IL-12p70为100.0%、IL-17为97.5%、IFN-γ为95.0%、TNF-α为92.5%,均大于90.0%的要求,表明厂家提供的参考区间适合本实验室,故可以直接引用。但值得注意的是,厂家提供的参考区间是对192例健康人群血清或血浆标本进行研究,厂家提供的这些参数可能会受患者性别、年龄、种族等因素的影响,所以,必要时实验室应建立自己的参考区间。
干扰物的存在常常是引起临床实验室检测项目误差的重要来源之一,因此,对常规临床实验室定量检测项目进行抗干扰评价极其重要。本研究中8项细胞因子(IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、IFN-γ、TNF-α)对三酰甘油、血红蛋白和胆红素的抗干扰能力均符合厂家所提供的偏差范围要求。干扰试验反映了流式细胞术在检测细胞因子方面对于三酰甘油、血红蛋白和胆红素的抗干扰能力较强,保证了结果的准确度,在一定程度上降低了实验室对待检标本的要求,易于患者留样待检。
综上所述,多重微球流式免疫荧光发光法检测外周血细胞因子的方法学性能良好,该方法的精密度、准确度、线性范围、最低检测限、参考区间和抗干扰能力均符合厂家要求,可为临床诊断提供准确和可信的检测结果。